电针胃俞募穴对大鼠胃运动及延髓DVC区c-fos表达的影响
2012-11-13申国明王浩秦勇
申国明,王浩,秦勇
(安徽中医学院中西医结合临床学院,合肥 230038)
近年来, 国内外许多学者对高位中枢核团在胃运动调节中的作用进行了大量研究[1-3]。现已证明,中枢的某些部位及核团参与了针刺对胃运动和胃电活动的调节。但高位中枢是否参与电针胃俞募穴对胃运动的调节尚未见报道。我们利用电针刺激大鼠胃俞募穴,并设立空白对照组,通过观察 c-fos在与胃运动密切相关的中枢延髓 DVC中的表达,探讨电针胃俞募穴对胃运动作用的中枢作用靶点。
1 材料与方法
1.1 实验动物
健康成年SD大鼠,雌雄各半,体重220~250 g,购自安徽医科大学实验动物中心(No.0001305)。置于室温(25±2)℃,12/12 h昼夜循环光照条件下生活,自由摄食、饮水。
1.2 主要实验设备
Biopac多导生理记录仪及Acqknowledge软件分析系统(美国 BIOPAC公司),CS-Ⅵ型摊片烤片机、LeicaRM2016切片机、TS-12A生物组织自动脱水机、BM-Ⅸ生物组织包埋机(湖北省孝感市宏业医用仪器有限公司),DHG-924385-Ⅲ电热恒温鼓风干燥箱(上海新苗医疗器械制造有限公司),日本OLYMPUS生物显微镜等。
1.3 实验器械及主要试剂
华佗牌 SDZ-Ⅳ型电子针疗仪、针灸针,均由苏州医疗用品厂有限公司提供;电阻应变片,由中国航天空气动力研究所提供;SABC免疫组化试剂盒、兔抗 Fos多克隆抗体等,均由武汉博士德生物工程有限公司提供。
1.4 动物分组及应力传感器的埋置
选择健康SD大鼠32只,称重记录后,随机分为空白对照组(空白组)、针刺中脘组(中脘组)、针刺胃俞组(胃俞组)、针刺中脘配胃俞组(中脘+胃俞组),每组8只。同等条件下饲养。适应性饲养1星期后,禁食12 h,自由饮水,用10%水合氯醛(300 mg/kg)腹腔注射麻醉,消毒条件下开腹,暴露胃体,距幽门0.3 cm处沿环形肌方向将自制应力传感器缝贴于胃窦腹侧面浆膜,导线经皮下引至颈部固定。
1.5 取穴及针刺方法
根据华兴帮《大鼠穴位图谱》和体表的骨性标志,胃俞取第十三胸椎下旁开5 mm,毫针直刺4~6 mm;中脘取脐上约20 mm,毫针直刺2 mm,采用平补平泻手法。至针下出现沉紧感时,接 SDZ-Ⅳ型电子针疗仪,电压9 V,疏密波型,频率20~100 Hz混频刺激,电针左侧胃俞、中脘,强度以局部皮肤肌肉轻微颤动为度。治疗时间20 min,每日治疗1次,连续治疗7 d。
1.6 观察指标及方法
针刺 1星期后,记录各组大鼠胃运动,记录完毕,10%水合氯醛(300 mg/kg)腹腔注射麻醉,快速剪开胸廓,捏住心脏,于心尖处剪一小口,插入灌注针头到主动脉,止血钳固定,剪开右心耳,快速滴入氯化钠150 mL,再注入4%多聚甲醛300 mL,取脑,浸入固定液中,4℃放置48 h,脱水、包埋、切片。观察DVC区c-fos表达情况。
1.6.1 胃运动的记录
大鼠禁食 12 h,自由饮水。将清醒动物置于特制鼠笼内,应力传感器导线接于Biopac多导生理记录仪,通过生物信号记录系统记录胃运动(胃运动量程1 mv、滤波20 Hz)。应用Acqknowledge软件分析系统,取胃运动幅度的平均值及频率作为观察指标。
1.6.2 免疫组化染色
切片脱蜡至水,3%H2O2室温孵育灭活内源性酶,PBS液冲洗3次,热修复抗原,自然冷却;滴加5%BSA封闭液,室温孵育 20 min;甩去多余液体,滴加 1:300稀释度的兔抗c-fos(一抗),4℃过夜;室温放置1 j,滴加生物素化山羊抗小鼠IgG(二抗),37℃孵育20 min后PBS冲洗 3次;甩去 PBS液滴加试剂 SABC,37℃孵育20 min后PBS冲洗4次;甩去PBS滴加新鲜配制的DAB液,显微镜下观察 5 min,适时终止反应。苏木素轻度复染,脱水,透明,封片,显微镜观察,以胞浆或胞核有棕色颗粒者为阳性细胞。参考大鼠脑立体定位图谱[4],在低倍镜下明确DVC区,在400倍光镜下选取DVC区视野摄像,用Image-Pro Plus 5.1图像处理与分析系统分析所选视野的表达强度(积分光密度)。
1.7 统计学方法
2 结果
2.1 电针对大鼠胃运动的影响
空白组和各电针组大鼠胃运动收缩波以胃运动幅度的平均值及频率作为观察指标(详见图 1)。由表 1可见,电针各组胃窦运动幅度明显增加,与空白组比较,差异均具有统计学意义(P<0.01);且中脘+胃俞组胃运动幅度增加更为显著,与中脘组和胃俞组比较,差异均有统计学意义(P<0.01)。电针对各组大鼠胃运动频率影响不明显,各组之间比较,差异无统计学意义(P>0.05)。
表1 电针对各组大鼠胃运动幅度及频率的影响 (s)
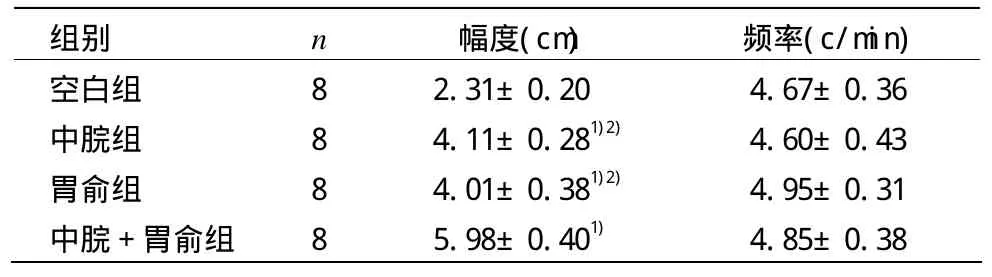
表1 电针对各组大鼠胃运动幅度及频率的影响 (s)
注:与空白组比较1)P<0.01;与中脘+胃俞组比较2)P<0.01
空白组 8中脘组 8胃俞组 8中脘+胃俞组 8 2.31±0.20 4.67±0.36 4.11±0.281)2) 4.60±0.43 4.01±0.381)2) 4.95±0.31 5.98±0.401) 4.85±0.38
2.2 各组大鼠DVC区c-fos表达比较
图2、3可见,电针中脘、胃俞以及中脘+胃俞均能上调大鼠脑DVC区c-fos的表达,各电针组与空白组比较,差异均有统计学意义(P<0.01);中脘+胃俞组与中脘组和胃俞组比较,DVC区c-fos的表达显著上调,差异均有统计学意义(P<0.05);中脘组和胃俞组之间比较,差异无统计学意义(P>0.05)。
3 讨论
迷走神经运动背核(dorsal motor nucleus of the vagus,DMV)和孤束核(nucleus tractus solitarius,NTS)是调节胃运动和分泌的的中枢部分,两者位置上紧邻,功能上密不可分,共同构成迷走背核复合体(dorsal vagal complex,DVC),发挥对胃运动的调节。本研究利用电针胃俞募穴,以原癌基因 c-fos的表达为标志,通过癌基因c-fos的表达产物Fos蛋白在与胃运动密切相关的中枢延髓 DVC中的表达情况,来探讨胃俞募配穴对胃运动的调节作用及其中枢机制。原癌基因 c-fos广泛存在于真核细胞基因组内,绝大多数正常细胞都有c-fos极低水平的表达[5]。c-fos表达可能是神经元被刺激激活的一种标志,可用以分析中枢神经系统的神经元受到外周刺激后的活动变化[6,7]。当机体受到某种刺激时,在该刺激信息向中枢传导的神经通路上,相应神经元会出现Fos蛋白阳性表达,用免疫组织化学的方法可以将其显示出来。虽然我们应用的是形态学的方法来显示,但是某种程度上反映了一定的功能意义。

图1 各组大鼠胃运动收缩波

图2 各组大鼠免疫组化染色显示DVC区c-fos的表达(SABC,×400)
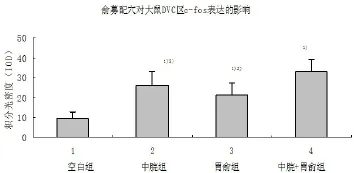
图3 电针胃俞募穴对各组大鼠DVC区c-fos表达的影响
既往研究中,我们观察到 DVC是针刺调整胃运动和分泌的重要中枢部位[8]。有研究表明,在针刺调整胃运动作用中,DMV和NTS神经元被明显激活[9]。在笔者实验的免疫组化染色观察中,电针胃俞募穴后大鼠的Fos蛋白阳性反应产物集中表达在延髓DVC中,且表达较空白对照组明显增加,其中,中脘+胃俞组Fos蛋白的表达较单独针刺中脘和胃俞组增加明显。这一实验结果表明,电针胃俞募穴对中枢核团 DVC具有激活作用。与此同时,实验还显示在电针刺激胃俞募穴位的情况下,胃运动的幅度明显增加,且俞募配穴效果更显著。因此提示胃俞募配穴对胃运动的调节作用具有协同效应。根据本实验结果,我们可以初步推断,电针胃俞募穴对胃运动的调节作用可能是通过激活对胃运动具有调节作用的中枢延髓DVC中的神经元而实现的。
由上述的实验结果,我们可以看出,电针胃俞募穴对胃运动具有调节作用,而且这种调节作用的实现与中枢核团DVC神经元的激活有密切关系,表明DVC参与了胃俞募配穴对胃运动的调节作用,初步揭示胃俞募配穴的中枢作用靶点。为进一步证实胃俞募配穴作用的中枢靶点,本项目组下一步将通过微透析技术,探讨DVC内单胺类和氨基酸类神经递质含量变化,并摧毁中枢核团DVC,观察电针胃俞募穴对胃运动的作用。
[1]Tada H, Fujita M, Harris M, et al. Neural mechanism of acupuncture-induced gastric relaxations in rats[J]. Dig Dis Sci, 2003,48:59-68.
[2]王景杰,刘琳娜,秦明,等.胃经穴位电针对胃运动的调节及对星形胶质细胞 GFAP、小胶质细胞 OX42表达的影响[J].胃肠病学和肝病学杂志,2008,17(12):1006-1009.
[3]Liu JH, Yan J, Yi SX, et al. Effects of electroacupuncture on gastric myoelectric activity and substance P in the dorsal vagal complex of rats[J]. NeurosciLett, 2004,356(2):99-102.
[4]诸葛启钏主译.大鼠脑立体定位图谱[M].北京:人民卫生出版社,2005:45.
[5]Hare AS, Clarke G, Tolchard S. Bacterial lipopolysaccharide induced changes in Fos protein expression in the rat brain: correlation with thermoregulatory changes and plasma corticosterone[J]. J Neuroendocrinology, 1995,7(10):791-799.
[6]Clark PJ, Bhattacharya TK, Miller DS, Rhodes JS. Induction of c-Fos,Zif268, and Arc from acute bouts of voluntary wheel running in new and pre-existing adult mouse hippocampal granule neurons[J].Neuroscience, 2011,10(4):245-246.
[7]XIE Fang, LIANG Xun-chang, WU Hong-jin, et al. Effect of Acupuncture at Acupoint Neiguan (PC 6)on the Myocardial c-fos Gene Expression of Acute Myocardial Ischemia in Rats[J]. J Acupunct Tuina Sci, 2006,4(3):132-135.
[8]Shen GM, Zhou MQ, Xu GS. Role of vasoactive intestinal peptide and nitric oxide in the modulation of electroacupuncture on gastric motility in stress rats[J]. World J Gastroenterol, 2006,38(12):6156-6160.
[9]Liu JH, Yan J, Yi SX, et al. Effects of electroacupuncture on gastric myoelectric activity and substance P in the dorsal vagal complex of rats[J]. Neurosci lett, 2004,356(2):99-102.
