心脏功能与透析中低血压的相关性
2012-11-13叶文玲方理刚李雪梅
叶文玲,方理刚 ,马 杰,李雪梅
中国医学科学院 北京协和医学院 北京协和医院 1肾内科 2心内科,北京 100730
·论著·
心脏功能与透析中低血压的相关性
叶文玲1,方理刚2,马 杰1,李雪梅1
中国医学科学院 北京协和医学院 北京协和医院1肾内科2心内科,北京 100730
目的研究左心收缩和舒张功能与维持性血液透析患者透析中低血压(IDH)的关系。方法以115例窦性心律的血液透析患者为研究对象,其中29例为IDH(IDH组),其余为对照组。根据纽约心脏协会(NYHA)心功能分级标准进行透析前临床心脏功能评估,透析次日检测超声心动图,采用GE EchoPAC软件分析心脏收缩和舒张功能各种参数,包括左室射血分数(EF)、左室短轴缩短分数(FS)、搏出量(SV)、心输出量(CO)、左室质量指数(LVMI)、Tei指数、等容舒张时间(IVRT)、E峰下降时间(EDT)、脉冲多谱勒二尖瓣舒张早期峰速(E)/舒张晚期峰速度比值(A)、E/组织多谱勒侧壁舒张早期峰速度比值(Em)。结果IDH组的患者年龄(P=0.045)和心功能不全者的比例(P<0.01)明显高于对照组,两组在性别、透析维持时间、透析间期体重增长、透析前血压方面差异无统计学意义(P均>0.05)。超声心动检测结果显示,IDH组左室舒张末内径(LVIDd)、SV和CO明显低于对照组(P均<0.05),两组在EF、FS、Tei指数及IVRT、EDT、E/A、E/Em等指标方面差异无统计学意义(P均>0.05)。多因素Logistic回归分析,NYHA心功能分级为IDH的独立预测因素,NYHA分级每升高1个级别,IDH危险性增加1.134倍。结论IDH为血液透析患者的常见并发症,透析间期超声心动图检测的左心收缩和舒张功能不影响IDH的发生,而透析前NYHA心功能分级与IDH密切相关,为其独立预测因素。
血液透析;心脏功能;超声心动图;透析中低血压
ActaAcadMedSin,2012,34(6):573-579
尽管最近几十年肾脏替代治疗取得迅猛的发展,透析中低血压(intradialytic hypotension,IDH) 仍然是透析治疗的重要并发症,发生率高达20%~33%[1-2]。IDH频繁发生不仅影响慢性肾功能衰竭(chronic renal failure,CRF)患者的透析充分性,降低生活质量,也增加患者的死亡风险[3]。多种因素参与IDH的发生,包括透析期间的体重增长过度、不合适的干体重、超滤过多等。但心脏功能对IDH的影响至今仍不清楚,研究结果不一[4-7]。本研究全面系统地分析了心脏的结构和功能,包括临床心功能分级、超声心动图检测的左室收缩和舒张功能等,探讨了心脏病变对CRF血液透析患者IDH发生的影响。
对象和方法
对象2011年1月至2011年6月在北京协和医院透析中心透析的患者115例,其中,男42例,女73例,平均年龄(57.01±13.08)岁(21~81岁),透析维持中位时间为72个月(7~216月)。入选条件:(1)年龄≥18岁;(2)每周3次每次4 h规律血液透析6个月以上;(3)排除房颤、安装起搏器及严重瓣膜病变者;(4)同意接受检查,签署知情同意书。入选肾衰竭的主要病因为慢性肾小球肾炎38例(33%),良性肾硬化18例(15.7 %),糖尿病肾病15例(13.0%),慢性间质性肾炎(包括马兜铃酸肾病)14例(12.2%)。
资料收集记录患者血液透析治疗时间、透析间期体重增长等一般资料,根据干体重计算体重指数(body mass index,BMI)。于透析前空腹取血,检测血常规、肝肾功能等指标,根据透析前后尿素氮,计算尿素氮清除率Kt/V。连续记录3次透析前血压,计算平均值。
IDH的定义及临床心功能评估标准透析3个月内至少1/3的透析过程收缩压降低25%以上或低于100 mmHg(1 mmHg=0.133 kPa),定义为IDH[1-2]。其他不符合IDH诊断条件者,列为对照组。为排除不适当的干体重对透析中血压的影响,检测前根据患者近期饮食情况、透析水负荷、是否有水肿等因素进行综合判断,首先进行干体重的评估和调整。临床心脏功能根据美国纽约心脏病学会(NYHA)心功能分级标准:Ⅰ级,活动量不受限制,平时一般活动不引起疲乏、心悸、呼吸困难或心绞痛;Ⅱ级,体力活动受到轻度限制,休息时无自觉症状,但平时一般活动下可出现疲乏、心悸、呼吸困难或心绞痛;Ⅲ级,患者体力活动明显限制,小于平时一般活动即引起上述症状;Ⅳ级,不能从事任何体力活动,休息状态下也出现心衰症状,体力活动后加重[7]。NYHA分级于透析前进行评估。
超声心动图检查及指标检测采用GE Vivid E9彩色多普勒超声诊断仪,探头频率1.7/3.4 MHz,数字化方式记录胸骨旁左室长轴、胸骨旁左室短轴、心尖四腔心、心尖二腔心和心尖左室长轴完整的超声心动图二维切面、M型超声、频谱多谱勒以及组织多谱勒图像,并同步记录心电图。超声心动图检查于透析后次日进行,所有测量由对患者临床资料不了解的心脏超声医生专人完成。参照美国超声心动图协会指南[8-9],采用GE EchoPAC软件进行图像分析。在二维超声和M型超声中测量主动脉内径、左房内径、室间隔厚度(interventricular septal thickness,IVST)和左室后壁厚度(left ventricular posterior wall thickness,PWT)、左室舒张末内径(left ventricular end-diastolic internal diameter,LVIDd)、左室收缩末直径(left ventricular end-systolic diameter,LVIDs)及左室短轴缩短分数(fractional shortening,FS)。根据三尖瓣反流峰值速度估测肺动脉收缩压(pulmonary artery systolic pressure,PASP):PASP=4×三尖瓣反流峰值速度2+右房压。左室质量指数(left ventricular mass index,LVMI)计算方法:LV质量=0.8×1.04[(LVIDd+PWT+IVST)3-(LVIDd)3]+0.6 g,LVMI=左室质量/体表面积。男性LVMI高于116 g/m2,女性高于104 g/m2为左心室肥大(left ventricular hypertrophy, LVH)[10]。用脉冲多谱勒测量二尖瓣瓣口水平血流频谱,记录二尖瓣早期峰速(E)和晚期峰速(A),E/A比值,E峰下降时间(E wave deceleration time, EDT)和等容舒张时间(isovolumic relaxation time, IVRT)。使用组织多谱勒(tissue Doppler imaging, TDI)记录侧壁瓣环和间隔瓣环的舒张早期峰值速度(Em)和舒张晚期峰值速度(Am),并计算E/Em。将舒张功能不全分为:左室松驰功能下降(E/A<1)、假性充盈正常化、限制性充盈(E/A>2)。利用心尖二腔心和四腔心切面双平面测得左室舒张末容积(left ventricular end-diastolic volume, LVEDV)、左室收缩末容积(left ventricular end-systolic volume, LVESV)、搏出量(stroke volume, SV)。采用改良的双平面Simpson法计算左室射血分数(left ventricular ejection fraction, LVEF),LVEF<50%为收缩功能不全。心输出量(cardiac output, CO)为SV与心率的乘积。Tei指数是指心室等容收缩时间(ventricular isovolumic systolic time,IVCT)与IVRT之和与心室射血时间(left ventricular ejection time, ET)的比值,即Tei指数=(IVCT+IVRT) /ET。
统计学处理采用SPSS 13.0统计软件,计量资料以均数±标准差表示,常态分布者进行非配对t检验,非常态分布变量使用非参数检验,计数变量使用卡方检检;年龄、NYHA心功能分级以及搏出量等与IDH的独立相关性采用单因素和多因素Logistic回归分析;P<0.05为差异有统计学意义。
结 果
一般情况115例患者中,29例(25.2%)为IDH(IDH组),其余86例为对照组。IDH组中,23例(79.3%)在透析过程中调节透析液钠离子浓度和/或降低透析液温度以改善低血压,其中1例因透析过程中血压明显下降,于透析前服用受体激动剂米多君5 mg治疗。IDH组的患者年龄(P=0.045)明显高于对照组,两组在性别、透析维持时间、透析间期体重增长、透析前血压方面差异无统计学意义(P均>0.05)。基础疾病为糖尿病肾病的比例,IDH组为20.7%,高于对照组的10.5%,但差异无统计学意义(P=0.202)(表1)。
NYHA心功能分级对IDH的影响对照组NYHA心功能分级Ⅰ、Ⅱ、Ⅲ、Ⅳ级的患者例数分别为52(60.5%)、22(25.6%)、11(12.8%)、1(1.2%),IDH组分别为6(20.7%)、15(51.7%)、7(24.1%)、1(3.4%),两组相比差异有统计学意义(χ2=13.845,P=0.003)。
两组超声心动图参数及左室收缩和舒张功能比较在所有血管及心脏参数中,IDH组的LVIDd明显小于对照组(P=0.042),两组在IVST、PWT、LVIDs和LVMI等方面差异无统计学意义(P均>0.05)(表2)。左心室收缩功能中,IDH组的SV(P=0.012)和CO(P=0.025)明显低于对照组,两组在FS、LVEF及反应心肌作功的Tei指数间差异均无统计学意义(P均>0.05)(表3)。左室舒张功能不全是本组患者的主要心脏功能异常,发生率达84.3%,IDH组与对照组左心舒张功能不全者分别为86.2%和83.7%,在左室舒张功能检测指标中,IVRT、EDT、E/Em及E/A比值等两组间差异均无统计学意义(P均>0.05)(表4)。对照组左心舒张功能分级正常、松弛功能降低、假性正常化、限制性充盈的例数分别为14(16.3%)、58(67.4%)、11(12.8%)、3(3.5%),IDH组分别为4(13.8%)、22(75.9%)、2(6.9%)、1(3.4%),两组相比差异无统计学意义(χ2=3.843,P=0.279)。
IDH的预测因素以是否为IDH为因变量,将上述有统计学意义的指标,包括年龄、NYHA、LVIDd、SV、CO等自变量代入Logistic回归方程,单因素回归分析结果显示,年龄大、NYHA分级高以及LVIDd和SV低为IDH的危险因素;多因素回归分析结果显示,去除年龄等混杂因素后,只有NYHA分级和SV为IDH的独立预测因素,其中NYHA分级每升高1个级别,IDH的危险性增加1.134倍,SV为保护性因素,每增高1 ml,IDH的风险减少3.2%(表5)。
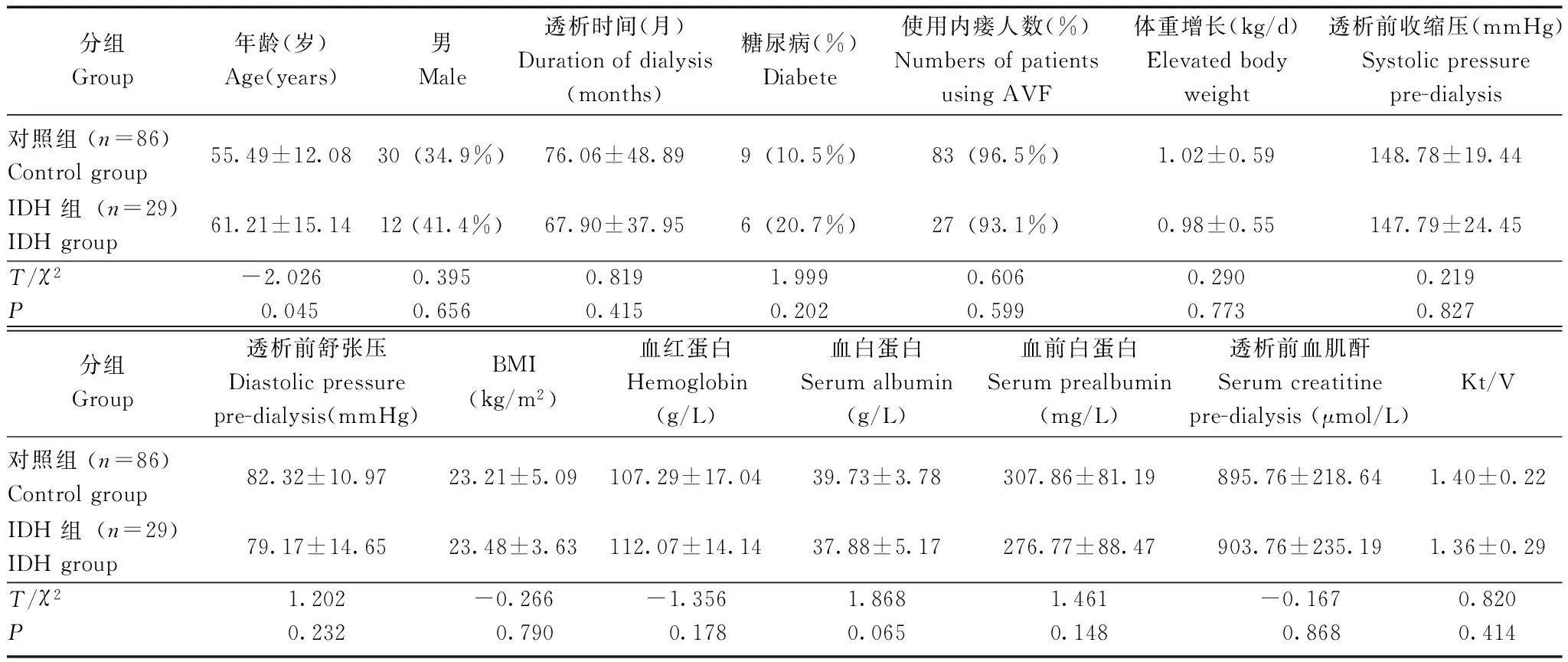
表 1 两组患者的一般情况比较
1 mm Hg=0.133 kPa; AVF:动静脉内瘘;BMI:体重指数;Kt/V:尿素氮清除率
1 mm Hg=0.133 kPa; AVF: arteriovenous fistula; BMI: body mass index; Kt/V: urea nitrogen clearance rate
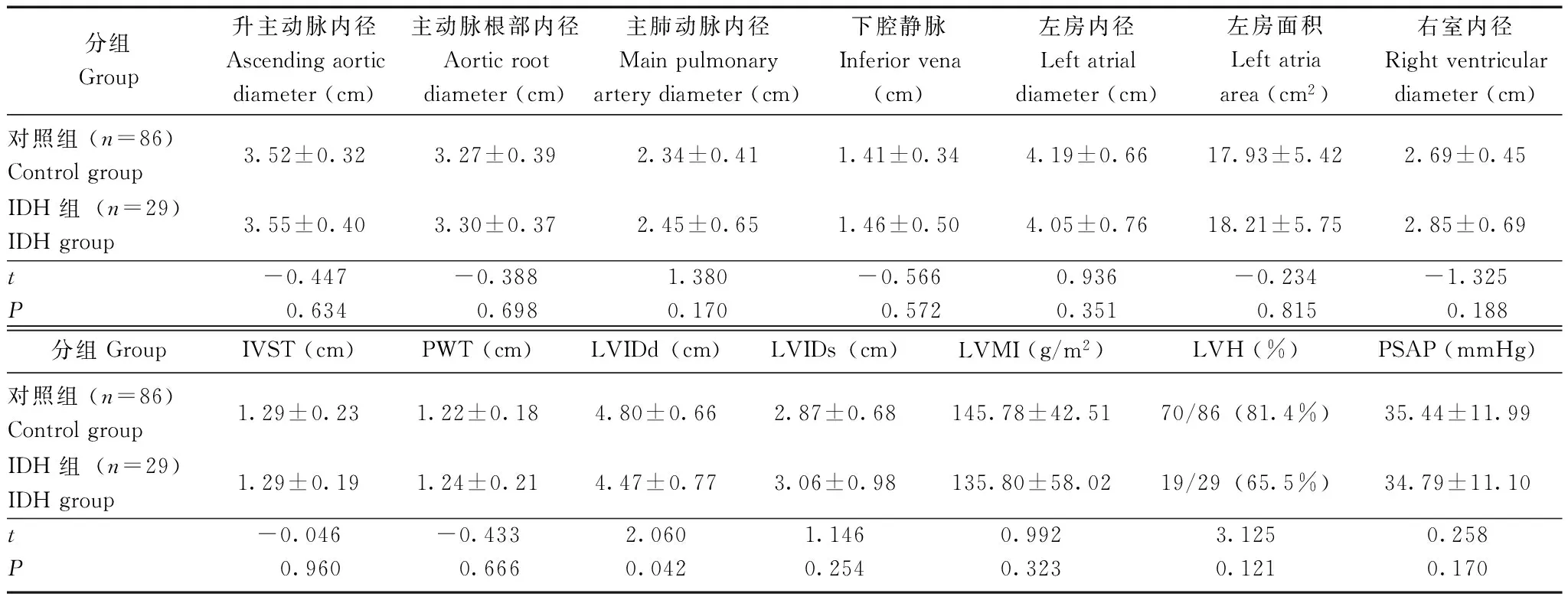
表 2 两组的超声心动图血管及心脏参数
IVST:室间隔厚度;PWT:左室后壁厚度;LVIDd:左室舒张末直径;LVIDs:左室收缩末直径;LVMI:左室质量指数;LVH:左室肥厚;PSAP:肺动脉收缩压
IVST: interventricular septal thickness; PWT: left ventricular posterior wall thickness; LVIDd: left ventricular end-diastolic internal diameter; LVIDs: left ventricular end-systolic internal diameter; LVMI: left ventricular mass index; LVH: left ventricular hypertrophy; PSAP: pulmonary artery systolic pressure

表 3 两组左室收缩功能比较
LV:左心室;LVEDV:左室舒张末容积;LVESV:左室收缩末容积;SV:搏出量;CO:心输出量;FS:左室短轴缩短分数;EF:左室射血分数
LV:left ventricle; LVEDV: left ventricular end-diastolic volume; LVESV: left ventricular end-systolic volume; SV: stroke volume; CO: cardiac output; FS: left ventricular fraction shortening; EF: ejection fraction

表 4 两组左室舒张功能比较
IVRT:等容舒张时间;EDT:E峰下降时间;E/A:脉冲多谱勒二尖瓣舒张早期峰速/舒张晚期峰速度比值;E/Em:脉冲多谱勒二尖瓣舒张早期峰速/组织多谱勒侧壁舒张早期峰速度比值
IVRT: isovolumic relaxation time; EDT: E wave deceleration time; E/A: mitral inflow peak early diastolic velocity to late diastolic velocities; E/Em: mitral inflow peak early diastolic velocity to peak mitral annulus velocity

表 5 Logistic回归分析IDH相关影响因素
NYHA:纽约心脏协会分级;SV:搏出量;CO:心输出量:LVIDd:左室舒张末内径
NYHA: New York Heart Association classification; SV: stroke volume; CO: cardiac output; LVIDd:left ventricular end-diastolic internal diameter
讨 论
心血管并发症是终末期肾脏病患者主要的死亡原因,在开始透析替代治疗时,约3/4患者已经存在LVH,LVH常常并发左室舒张和/或收缩功能不全,而且,随着透析维持时间的延长,代偿性肥厚引起的心脏扩张可能进行性加重[11-12]。血液透析患者普遍存在的心血管病变是否与透析过程的常见并发症IDH存在关联,目前仍无定论[4-6]。
IDH是血液透析治疗的常见并发症,在除外不适当的干体重因素后,本研究组患者IDH的发生率达25.2%。IDH的发生与多种病理生理机制有关,包括动静脉张力调节缺陷、血浆再充盈缺陷、异常体热、内皮素和氧化氮合成失衡等[13-14]。已经明确,在众多因素中因超滤脱水产生的容量下降是IDH最重要的始动因素。在超滤过程中除急性低血容量外,不充分的心脏代偿机制,如左室收缩和舒张功能不全是否参与IDH的发生,仍是个临床研究的问题。有研究表明,左室收缩功能下降是透析患者IDH相关因素之一,心肌收缩功能下降可能导致充血性心力衰竭,血液透析过程血液动力学发生改变时,不能产生足够的心输出量导致IDH发生[4]。但亦有研究得出,心肌收缩功能受损与IDH的发病无关[6]。本研究中,IDH组LVEF和FS与对照组均无明显差异,EF<50%的收缩功能不全者在IDH和对照组分别为7%和13.8%,但因例数所限,差异亦无统计学意义。心肌作功指数Tei指数为一个评价心室收缩和舒张整体功能的指标,具有不依赖心室的几何形态、不受瓣膜反流及心率影响等优点[15]。IDH组和对照组Tei指数基本接近,无明显差异。综合各指标,提示透析间期检测的心脏收缩功能对IDH的发生无明显相关性。Yang等[2]使用超声心动图检测IDH患者透析过程中的血液动力学改变,在透析前IDH组与对照组EF、SV及血管内容量均无明显区别。尽管检测时间点不同,结果与本研究结果一致,同样提示透析间期的左室收缩功能非IDH的直接相关指标,但IDH组在透析过程中EF值和SV较对照组明显下降。另有研究表明,在血液透析过程中血压下降的患者,SV下降更为明显,导致CO下降[16],提示IDH的发生可能与心脏功能储备有关。小样本研究对易于发生透析中低血压的患者(HP)进行多巴胺负荷试验,非HP患者平均动脉压无明显变化,但HP组患者平均动脉压下降,在整个药物试验负荷过程中压力反射敏感度HP组低于对照组,提示HP患者存在对多巴胺负荷试验的心血管反应受损,心肌收缩功能贮备下降[5]。
左室舒张功能不全CRF血液透析患者常见的心脏功能异常发现,本组舒张功能不全发生率高达84.3%,IDH组与对照组分别为86.2%和83.7%。透析脱水静脉压下降时,左室舒张功能是维持心脏合适充盈的必需条件,长期的左室舒张功能不全似乎是超滤耐受能力下降的因素之一。舒张功能不全继发于心肌纤维化增加导致的顺应性下降,左室僵硬度增加限制了心腔的充盈,左室容量充盈压力曲线陡峭,容量快速下降诱发了低输出状态和低血压发生[1]。本研究结果显示,在所有的血管及心脏参数中,IDH组LVIDd明显小于对照组,SV和CO低于对照组。透析间期检测的LVIDd、SV和CO差异是否为IDH组患者心肌僵硬度增加舒张受限所致,尚有待进一步研究。因单一指标估测心脏舒张功能准确性及敏感性较差,本研究采用了二尖瓣口血流频谱E/A比值、EDT、E/Em、IVRT等指标全面评估了左室舒张功能,但这些参数两组间均无统计学差异。将舒张功能程度分为正常、松驰功能下降、假性充盈正常化、限制性充盈4个不同级别,两组间在构成比上无统计学差异。E/Em比值是心力衰竭预后、心肌梗死和ESRD的一个独立危险因素,E/Em升高,提示肺毛细胞血管楔压增高,左房压力升高[13,17]。因此指标估计LV充盈压较其他方法更为精确,被欧洲心脏协会推荐为无创估计LV充盈压的方法[18]。IDH组的E/Em为11.62±8.43,对照组为10.17±4.55,两组无统计学差异。提示与对照组相比,透析间期左室充盈IDH组并无明显改变。综合上述指标,本研究基本除外了透析间期超声心动图检测的左心舒张功能受损对IDH的潜在影响,此结果与Barberato等[1]的研究结果一致。
透析前临床心功能分级与IDH的发生密切相关,IDH组和对照组NYHA分级Ⅱ以上者分别为79.3%和39.5%,其中Ⅱ和Ⅲ级的比例明显高于对照组。在本研究中,IDH患者年龄高于对照组。在去除年龄等混杂因素后,经Logistic回归,NYHA分级仍是IDH最有预测价值的变量。既往曾有研究发现心力衰竭史是症状性低血压最有预测价值的因素,但该研究并未对患者当时存在的心功能状态分级进行分析[1]。临床心力衰竭患者对透析脱水的耐受力下降已在小规模的研究中证实,NYHA分级Ⅲ和Ⅳ者,透析过程中少量超滤脱水(500 ml/h)即可引起收缩压明显下降,而心功能正常的患者只有在大量脱水(1 L/h)时才引起收缩压的降低,而且下降幅度较小[19]。在普通心力衰竭患者的分析中,超声心动图显示的心脏功能与临床NYHA心功能分级之间并不很一致[20]。本研究中NYHA心功能分级和超声心动图检测的心脏收缩和舒张功能与IDH的关系存在较大差异,分析原因,可能为透析前的NYHA心功能分级不仅与透析患者心脏收缩和舒张功能下降有关,也受透析间期体重增长引起的心脏前负荷增加影响,可能为心脏功能、心脏负荷以及血管反应等多种结合因素的综合反应。
总之,IDH为血液透析患者的常见并发症,透析间期超声心动图检测的左心收缩与舒张功能对IDH无明显影响,心功能异常并不能预示IDH的发生,但透析前NYHA心功能分级与IDH密切相关,去除年龄等混杂因素后为其独立预测因素。
[1] Barberato SH, Misocami M, Pecoits-Filho R, et al. Association between left atrium enlargement and intradialytic hypotension: role of diastolic dysfunction in the hemodynamic complications during hemodialysis[J]. Echocardiography, 2009, 26(7):767-771.
[2] Yang NI, Wang CH, Hung MJ, et al. Real-time three-dimensional echocardiography provides advanced haemodynamic information associated with intra-dialytic hypotension in patients with autonomic dysfunction[J]. Nephrol Dial Transplant, 2010, 25(1):249-254.
[3] Zager PG, Nikolic J, Brown RH, et al.“U”curve association of blood pressure and mortality in hemodialysis patients[J]. Kidney Int, 1998, 54(2):561-569.
[4] Daugirdas JT. Pathophysiology of dialysis hypotension: An update[J]. Am J Kidney Dis, 2001, 38(4 Suppl 4):S11-S17.
[5] Owen PJ, Priestman WS, Sigrist M, et al. Myocardial contractile function and intradialytic hypotension[J]. Hemodial Int, 2009, 13(3):293-300.
[6] Ie EH, Krams R, VletterWB, et al. Myocardial contractility does not determine the haemodynamic response during dialysis[J]. Nephrol Dial Transplant, 2005, 20(11):2465- 2471.
[7] Malyszko J, Levin-Iaina N, Malyszko JS, et al. Copeptin and its relation to arteriovenous fistula type and NYHA class in hemodialysis patients[J]. Ren Fail, 2011, 33(10):929-934.
[8] Rudski LG, Lai WW, Afilalo J, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography[J]. J Am Soc Echocardiogr, 2010, 23(7):685-713.
[9] Lang RM, Bierig M, Devereux RB, et al. Recommendations for chamber quantification: A report from the American Society of Echocardiography’s Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology[J]. J Am Soc Echocardiogr, 2005, 18(12):1440-1463.
[10] Palecek T, Skalicka L, Lachmanova J, et al. Effect of preload reduction by hemodialysis on conventional and novel echocardiographic parameters of left ventricular structure and function[J]. Echocardiography, 2008, 25(2):162-168.
[11] Foley RN, Parfrey PS, Kent GM, et al. Serial change in echocardiographic parameters and cardiac failure in end-stage renal disease[J]. J Am Soc Nephrol, 2000, 11(5):912-916.
[12] Foley RN, Parfrey PS, Kent GM, et al. Long-term evolution of cardiomyopathy in dialysis patients[J]. Kidney Int, 1998, 54(5):1720-1725.
[13] Wang AY, Wang M, Lam CW, et al. Left ventricular filling pressure by Doppler echocardiography in patients with end-stage renal disease[J]. Hypertension, 2008, 52(1):107-114.
[14] Graziani G, Finazzi S, Mangiarotti R, et al. Different cardiovascular responses to hemodialysis-induced fluid depletion and blood pressure compliance[J]. J Nephrol, 2010, 23(1):55-61.
[15] Lakoumentas JA, Panou FK, Kotseroglou VK,et al. The Tei index of myocardial performance: applications in cardiology[J]. Hellenic J Cardiol, 2005, 46(1):52-58.
[16] Boon D, van Montfrans GA, Koopman MG, et al. Blood pressure response to uncomplicated hemodialysis: The importance of changes in stroke volume[J]. Nephron Clin Pract, 2004, 96(3):c82-c87.
[17] Bajraktari G, Berbatovci-Ukimeraj M, Hajdari A, et al. Predictors of increased left ventricular filling pressure in dialysis patients with preserved left ventricular ejection fraction[J]. Croat Med J, 2009, 50(6):543-549.
[18] Paulus WJ, Tschöpe C, Sanderson JE, et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology[J]. Eur Heart J, 2007, 28(20):2539-2550.
[19] van der Sande FM, Mulder AW, Hoorntje SJ, et al. The hemodynamic effect of different ultrafiltration rates in patients with cardiac failure and patients without cardiac failure: comparison between isolated ultrafiltration and ultrafiltration with dialysis[J]. Clin Nephrol, 1998, 50(5):301-308.
[20] Hebert K, Macedo FY, Trahan P, et al. Routine serial echocardiography in systolic heart failure: is it time for the heart failure guidelines to change[J]. Congest Heart Fail, 2011, 17(2):85-89.
Association between Cardiac Function and Intradialytic Hypotension
YE Wen-ling1, FANG Li-gang2, MA Jie1, LI Xue-mei1
1Department of Nephrology,2Department of Cardiology, PUMC Hospital, CAMS and PUMC, Beijing 100730, China
LI Xue-mei Tel/Fax:010-69155058,E-mail:0605.mei@gmail.com
Objective To prospectively determinate the association of left ventricular systolic and diastolic function with intradialytic hypotension (IDH) in patients on maintenance hemodialyis.MethodsTotally 115 patients with sinus rhythm were included in this study and divided into IDH group (n=29) and control group (n=86). The cardiac function was assessed by New York Heart Association (NYHA) classification before hemodialysis. Echocardiograms were performed in the next day after hemodialysis and the software of GE EchoPAC was used to estimate parameters of cardiac systolic and diastolic functions including ejection fraction, fractional shortening of left ventricular diameter, stroke volume (SV), cardiac output (CO), left ventricular mass index, Tei index, isovolumetric relaxtion time, E-deceleration time, mitral inflow peak early diastolic velocity (E) to late diastolic velocities (A) ratio, and E to peak mitral annulus velocity (E/Em) ratio.ResultsThe mean age (P=0.045) and the ratio of heart failure evaluated by the NYHA classification (P<0.01) were significantly higher in IDH group than those in control group. No difference was noted for gender, body mass index, duration of dialysis, body weight elevated rate and blood pressure between these two groups (allP>0.05). Left ventricular diameters at the end of diastolic phase, SV, and CO in IDH group were significantly lower than those in control group (allP<0.05), whereas no significant difference was found for EF, FS, Tei index, IVRT, EDT, E/A and E/Em ratio (allP>0.05). Multivariate logistic regression analysis showed that NYHA cardiac function was an independent predictor of IDH, and the risk of IDH increased by 1.134 times with incremental one grade of NYHA classification.ConclusionsIDH is a common complication of hemodialysis. Neither systolic dysfunction nor diastolic dysfunction of left ventricle evaluated in second day after hemodialyis affects its frequency, whereas the clinical cardiac function is an independent predictor of IDH.
hemodialysis; heart function; echocardiography; intradialytic hypotension
李雪梅 电话/传真:010-69155058,电子邮件:0605.mei@gmail.com
R544
A
1000-503X(2012)06-0573-07
10.3881/j.issn.1000-503X.2012.06.007
北京协和医院青年基金(2009155)Supported by the Youth Fund of Peking Union Medical College Hospital(2009155)
2012-02-20)
