改良三维条件下人胚胎干细胞向内皮细胞的分化及功能
2012-11-13苏位君王宝玉宋祥和王丽娜刘艳华周曼倩童玲玲李宗金
苏位君, 王宝玉,宋祥和,王丽娜 ,刘艳华,周曼倩,童玲玲, 李宗金
1南开大学医学院病理学系,天津 3000712南开大学人民医院内分泌科,天津 300121 3山东省日照市中医院心内科,山东日照 276800 4南开大学医学院免疫学系,天津 300071 5南开大学医学院病理生理学系,天津 300071
·论著·
改良三维条件下人胚胎干细胞向内皮细胞的分化及功能
苏位君1, 王宝玉2,宋祥和3,王丽娜4,刘艳华4,周曼倩4,童玲玲5, 李宗金5
1南开大学医学院病理学系,天津 300071
2南开大学人民医院内分泌科,天津 3001213山东省日照市中医院心内科,山东日照 2768004南开大学医学院免疫学系,天津 3000715南开大学医学院病理生理学系,天津 300071
目的建立一种改良的三维分化无血清方法,对人胚胎干细胞(hESCs)向内皮细胞进行分化,并对这种方法得到的人胚胎干细胞来源内皮细胞(hESC-ECs)进行功能检测。方法在低附着培养皿中培养未分化的H9 hESCs 12 d,使其形成类胚体(EBs),12 d后将已形成的EBs收集起来,用浓度为1.5 mg/ml的Ⅰ型鼠尾胶原重悬,加入六孔板中,在37℃待胶原凝固后加入EGM-2培养基培养3 d,获得出芽类胚体后用0.25%胶原酶Ⅰ和0.56 U/ml Liberase Blendzyme消化芽生类胚体各20 min,采用流式技术分选出其中CD31阳性的细胞,并用乙酰化低密度脂蛋白(ac-LDL)摄取实验和成管实验验证这部分细胞的内皮细胞功能。结果建立了一种基于胶原培养环境的三维分化方法,采用这种方法能够将hESCs向内皮细胞分化的效率提高到18%,最终获得的hESC-ECs具有和人脐带静脉内皮细胞(HUVECs)相似的细胞表面标志物,并在乙酰化LDL吞噬实验和血管新生实验中表现出良好的内皮细胞功能。结论建立的改良三维分化方法能够明显提高hESCs向内皮细胞的分化效率,是一种简单高效的分化方法,同时无血清培养方法为将来hESC-ECs的临床应用提供了可能。
人胚胎干细胞;人胚胎干细胞来源内皮细胞;三维分化法;CD31
ActaAcadMedSin,2012,34(6):539-544
心肌梗死、下肢缺血等心血管疾病是世界范围内致死、致残的重要疾病。目前的治疗方法只能缓解症状,不能达到恢复坏死灶功能的目的。近年来,有研究者将从脐带血、骨髓等来源分离得到的内皮前体细胞用于缺血性疾病动物模型的治疗,并取得一定疗效[1-2],但这些来源的内皮前体细胞均不易获得且数量有限。人胚胎干细胞(human embryonic stem cells,hESCs)具有无限的自我更新和向各种成体细胞分化的能力,这使其具有被用作大量内皮细胞来源的可能性。目前,由hESCs向内皮细胞分化的方式主要分为三维分化法和二维分化法,这两种方法分别具有分化效率低和容易被鼠源细胞污染的缺点[3-7],严重阻碍了其临床应用。本研究采用一种改良的三维分化法,在无血清条件下对hESCs向内皮细胞进行分化,以期更加安全、高效地获得大量hESCs来源的内皮细胞(hESC-derived endothelial cells,hESC-ECs)。
材料和方法
材料hESCs H9细胞系购自美国Wicell研究所,IMDM培养基、EGM-2培养基(Lonza)、KnockoutTM血清替代物购自美国Invitrogen公司,牛血清白蛋白、胰岛素、转铁蛋白(bovine serum albumin, insulin, transferrin,BIT)购自美国Stem Cell Technologies公司,非必需氨基酸、谷氨酰胺、单硫甘油购自美国Sigma公司,青霉素、链霉素、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)购自美国R&D Systems公司,Ⅰ型鼠尾胶原购自美国BD公司,0.25%胶原酶Ⅰ、Liberase Blendzyme、鼠抗人CD31抗体、Matrigel购自美国BD公司,人纤维连接蛋白购自美国Millipore公司,乙酰化低密度脂蛋白(acetylated low density lipoprotein,ac-LDL)、4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)、二甲基亚砜(dimethyl sulphoxide,DMSO)、牛血清白蛋白(bovine serum albumin,BSA)购自中国生工公司,甲醇、过氧化氢购自中国天津化学试剂厂。
hESCs向内皮细胞分化在低附着培养皿中培养未分化的H9 hESCs 12 d使其形成类胚体(embryonic bodies, EBs),培养基具体配方为:在IMDM基本培养基中加入15%KnockoutTM血清替代物、1×BIT、0.1 mmol/L非必需氨基酸、2 mmol/L谷氨酰胺、450 μmol/L单硫甘油、50 U/ml青霉素、50 μg/ml链霉素、20 ng/ml bFGF及50 ng/ml VEGF。12 d后,将已形成的EBs收集起来,在冰上用终浓度为1.5 mg/ml 的Ⅰ型鼠尾胶原重悬,加入六孔板中,放入37℃培养箱使胶原凝固。30 min后在凝固的胶原上方加入含有5% KnockoutTM血清替代物、20 ng/ml bFGF和50 ng/ml VEGF的EGM-2培养基。
内皮细胞的分选采用流式细胞技术,分别用0.25%胶原酶Ⅰ和0.56 U/ml Liberase Blendzyme消化芽生EBs各20 min,并使消化后细胞悬液通过40 μm滤膜。用鼠抗人CD31抗体对细胞进行染色,上机分选出CD31+细胞,将分选出的细胞用包被了人纤维连接蛋白的培养皿进行培养。
乙酰化LDL(Dil-ac-LDL)摄取实验用10 μg/ml乙酰化LDL在37℃条件下孵育hESC-ECs 6 h,用PBS洗2遍后对细胞进行固定,用DAPI对细胞核进行染色后封片,在显微镜下观察、拍照。
血管新生实验将Matrigel加入六孔板中,置于37℃培养箱使凝固;将用EGM-2培养基重悬的分化后内皮细胞铺于凝固的Matrigel上,置于37℃培养箱培养24 h后,在显微镜下观察、拍照。
整体免疫荧光染色将EBs置于甲醇/DMSO 4∶1混合液中,4℃固定过夜。将固定后的EBs置于甲醇、DMSO和30%过氧化氢的混合溶液(4∶1∶1)中1.5 h,消除内源性过氧化物酶的作用,之后将EBs在PBS缓冲液中水化30 min,并用PBSBT(含2%BSA)进行封闭,加稀释后CD31抗体4℃孵育过夜,用PBS冲洗后,加稀释后荧光标记二抗室温孵育2 h, 冲洗后用DAPI复染细胞核并封片,在显微镜下观察、拍照。
结 果
hESCs向内皮细胞的分化情况Oct-4和碱性磷酸酶染色结果显示,hESCs呈集落生长,细胞紧密堆积,细胞间无明显间隙,集落中大多数细胞Oct-4、碱性磷酸酶染色呈阳性(图1)。将hESCs在分化培养基中培养12 d后,可形成典型的EBs形态;对形成的EBs进行整体免疫荧光染色,可见EBs中已经有部分细胞已经开始表达内皮细胞标志物CD31;将形成的EBs用Ⅰ型鼠尾胶原重悬,加EGM-2培养基培养3 d后,可见EBs周围成簇出现新生芽状结构;对芽生EBs进行整体免疫荧光染色,可见其四周和芽状结构均表达内皮细胞标志物CD31(图2)。
hESC-ECs表面标志物的表达流式细胞技术检测结果显示,未分化hESCs的CD31和CD144表达水平低,均小于1%;而血管内皮生长因子受体2(kinase insert domain-containing receptor,KDR)和CD133有相当比例的表达。EBs的CD31和CD144表达水平较hESCs有所提高,分别达到3.3%和8.0%;将hESCs置于胶原中培养后得到的出芽EBs表达CD31和CD144的比例进一步升高至18.3%和24.8%。最终分选得到的hESC-ECs除KDR表达比例低于人脐带静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)外,CD31、CD144和CD133表达均达到HUVECs的水平(图3)。
hESC-ECs的功能检测结果由hESCs分化得到的内皮细胞形态呈铺路石样,与体外培养的HUVECs细胞基本相同;免疫荧光染色可见hESC-ECs绝大多数都表达CD31;Dil-ac-LDL摄取实验可见分化得到的内皮细胞胞浆中呈现明亮的红色荧光,这种分化得到的内皮细胞能够在Matrigel上形成血管样条索结构,相互连接(图4)。
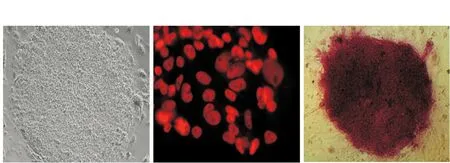
hESCs: 人胚胎干细胞;Oct-4: 八聚体结合转录因子-4;ALP:碱性磷酸酶hESCs: human embryonic stem cells;Oct-4: octamer-binding transcription factor 4;ALP: alkaline phosphateA.光镜下未分化hESCs集落;B.未分化hESCs Oct-4的表达情况;C.未分化hESCs ALP的表达情况A.the colony of hESCs; B.the expression of Oct-4 in hESCs; C.the expression of ALP in hESCs图 1 未分化hESCs表面标志物的表达(×200)Fig 1 Expressions of Oct-4 and ALP in undifferentiated hESCs(×200)
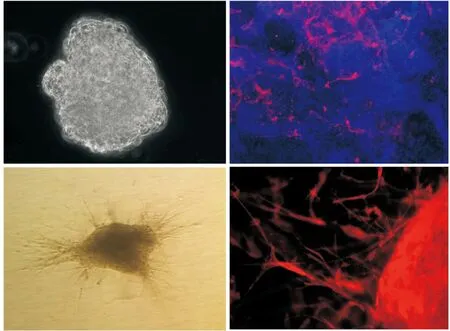
A.光镜下hESCs在分化培养条件下12 d形成的类胚体 (×200);B.类胚体CD31的表达情况,红色为CD31,蓝色为细胞核(×200);C.光镜下类胚体在胶原条件下培养3 d后形成的出芽类胚体 (×200);D.出芽类胚体周边部位CD31的表达情况 (×400)A.the embryonic body cultured in differentiation medium for 12 days (×200); B.the expression of CD31 in embryonic body, in which red represents CD31 and blue represents nuclei(×200); C. embryonic body-sprouting formed in rat tail collagen type Ⅰ (×200); D.the expression of CD31 in embryonic body-sprouting (×400)图 2 类胚体和出芽类胚体CD31的表达情况Fig 2 Expression of CD31 in embryonic body and embryonic body-sprouting
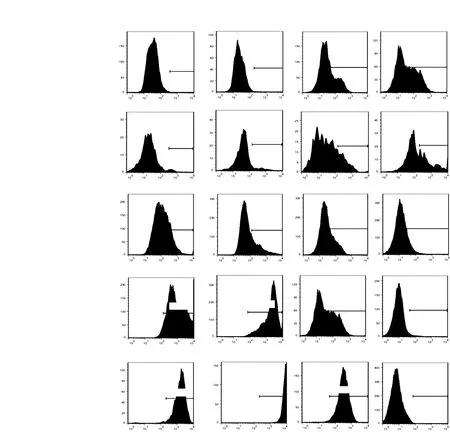
hESC-ECs:人胚胎干细胞来源内皮细胞;HUVECs:人脐带静脉内皮细胞hESC-ECs:human embryonic stem cells-derived endothelial cells;HUVECs: human umbilical vein endothelial cells图 3 未分化hESCs、类胚体、出芽类胚体、hESC-ECs和HUVECs的CD31、CD144、KDR和CD133表达比例Fig 3 Expressions of CD31, CD144, KDR and CD133 in undifferentiated hESCs, embryonic bodies, embryonic body-sproutings, hESC-ECs and HUVECs by FACS
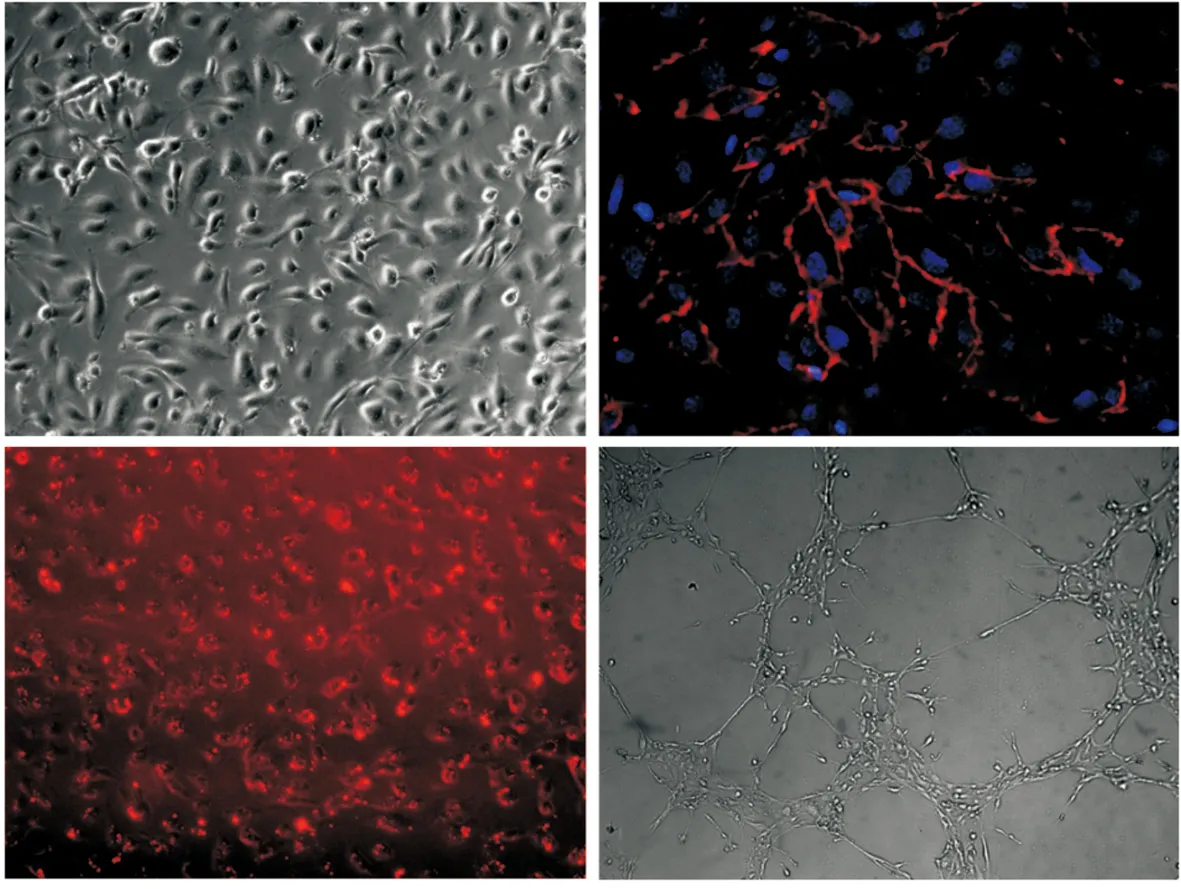
A.光镜下hESC-ECs的形态;B.hESC-ECs的CD31表达情况,红色为CD31,蓝色为细胞核;C. hESC-ECs对乙酰化LDL的摄取情况;D. hESC-ECs在Matrigel中形成的管状结构A.morphology of hESC-ECs; B.expression of CD31 in hESC-ECs, red represents CD31, blue represents nuclei; C. uptake of Dil-ac-LDL by hESC-ECs; D.formation of endothelial tubes by hESC-ECs seeded in 24-well plates coated with Matrigel图 4 hESC-ECs的体外功能检测(×200)Fig 4 Functional characterization of hESC-ECs in vitro(×200)
讨 论
胚胎干细胞是一种未分化的、具有自我更新能力和全能性的细胞。随着近年来干细胞相关技术的发展,有越来越多的研究试图利用胚胎干细胞分化为各种成体细胞的能力将其应用于医学组织工程。已经有多项研究证明了hESCs分化为内皮细胞的潜力,包括EBs能够分化为血管样结构。胚胎干细胞来源的内皮细胞对于缺血性疾病治疗的有效性已经在动物模型中得到了证明[8],为将其今后应用于临床治疗打下基础。
以往将hESCs分化为内皮细胞的方法主要分有三维分化法和二维分化法两种。Levenberg等[3]在2002年首次采用三维分化法,将hESCs在低附着培养皿中培养9~13d,使其形成EBs,然后将EBs消化成单个细胞悬液,并从中分选CD31阳性细胞。随着EBs的分化,内皮标志物CD31、VE-cadherin和CD34的表达水平不断升高,在13~15d时达到最高。同样,本研究在对EBs的整体免疫荧光染色中也发现CD31阳性细胞,且连接成条索状,提示了EBs能够自发地向内皮细胞方向进行分化。但这种EBs自发分化的效率较低,采用流式分选技术只能分选出2%~3%左右的CD31阳性细胞。此外,本研究还发现只有3.3%的EBs阶段细胞表达CD31。二维分化法是将hESCs在鼠胚胎成纤维细胞饲养层上进行分化,绕开了形成EBs的步骤,有效地提高了向内皮细胞方向的分化效率[5]。但这种在饲养层上进行分化的方法可能会造成鼠源细胞的污染,是将来hESC-ECs应用于临床的一个障碍。鉴于上述2种分化方法各有不足,本研究试图找到一种无血清、并具有较高效率的改良三维分化方法。
传统的三维分化法多采用由hESCs形成的EBs分选出内皮表面标志物阳性的细胞,但效率较低,本研究采用改进后的三维分化法将EBs加入胶原中进行培养,使之进一步分化得到出芽EBs,并由出芽EBs中分选CD31阳性细胞。从流式结果来看,这种方法能够得到18%左右的CD31阳性细胞,较传统三维法效率有了大幅度的提高。本研究在由hESCs向内皮细胞分化的过程中,向培养基中加入VEGF和bFGF细胞因子,结果显示其能够促进内皮细胞的分化,CD144和CD31的表达上调。胶原是细胞外基质的主要骨架成分,有报道认为包括Ⅰ型胶原在内的细胞外基质成分能够促进EBs向成骨细胞和心肌细胞方向分化[9-10]。因为Ⅰ型鼠尾胶原在常温下容易部分凝固,从而导致EBs细胞不能在胶原中均匀分布,所以涉及胶原的步骤要全程在冰上操作。
总之,应用改良后的三维分化法可以有效避免二维分化法中鼠源细胞的污染,并且将EBs置于Ⅰ型胶原中可以有效提高向内皮细胞方向的分化效率。经此方法分选出的CD31阳性细胞能够很好的表达内皮标志物,并具有内皮细胞功能,是一种切实可行、简单高效的由hESCs向内皮细胞分化的方法。
[1] Aicher A, Brenner W, Zuhayra M, et al. Assessment of the tissue distribution of transplanted human endothelial progenitor cells by radioactive labeling[J]. Circulation, 2003, 107(16):2134-2139.
[2] Hung H, Shyu W, Tsai C, et al. Transplantation of endothelial progenitor cells as therapeutics for cardiovascular diseases[J]. Cell Transplant, 2009, 18(9):1003-1012.
[3] Levenberg S, Golub J, Amit M, et al. Endothelial cells derived from human embryonic stem cells[J]. Proc Natl Acad Sci USA, 2002, 99(7):4391-4396.
[4] Lu SJ, Feng Q, Caballero S, et al. Generation of functional hemangioblasts from human embryonic stem cells[J]. Nat Methods, 2007, 4(6):501-509.
[5] Wang ZZ, Au P, Chen T, et al. Endothelial cells derived from human embryonic stem cells form durable blood vesselsinvivo[J]. Nat Biotechnol, 2007, 25(3):317-318.
[6] Yamahara K, Sone M, Itoh H, et al. Augmentation of neovascularization in hindlimb ischemia by combined transplantation of human embryonic stem cells-derived endothelial and mural cells[J]. PLoS One, 2008, 3(2):e1666.
[7] Li Z, Suzuki Y, Huang M, et al. Comparison of reporter gene and iron particle labeling for tracking fate of human embryonic stem cells and differentiated endothelial cells in living subjects[J]. Stem Cells, 2008, 26(4):864-873.
[8] Li Z, Han Z, Wu J. Transplantation of human embryonic stem cell-derived endothelial cells for vascular diseases[J]. J Cell Biochem, 2009, 106(2):194-199.
[9] Evans ND, Gentleman E, Chen X, et al. Extracellular matrix-mediated osteogenic differentiation of murine embryonic stem cells[J]. Biomaterialsm, 2010, 31(12):3244-3252.
[10] Duan Y, Liu Z, O’Neill J, et al. Hybrid gel composed of native heart matrix and collagen induces cardiac differentiation of human embryonic stem cells without supplemental growth factors[J]. J Cardiovasc Transl Res, 2011, 4(5):605-615.
Differentiation of Human Embryonic Stem Cells to Endothelial Cells via Improved Three-dimension Approach
SU Wei-jun1, WANG Bao-yu2, SONG Xiang-he3, WANG Li-na4, LIU Yan-hua4,ZHOU Man-qian4, TONG Ling-ling5, LI Zong-jin5
1Department of Pathology, Nankai University School of Medicine, Tianjin 300071, China2Department of Endocrinology, Nankai University People’s Hospital, Tianjin 300121, China3Department of Cardiology, Rizhao Hospital of Traditional Medicine, Rizhao, Shandong 276800,China4Department of Immunology, Nankai University School of Medicine, Tianjin 300071, China5Department of Pathophysiology, Nankai University School of Medicine, Tianjin 300071, China
WANG Bao-yu Tel: 022-27557477, E-mail:wbylwg@sina.com;
Objective To establish an improved three-dimension (3D) and serum-free approach to differentiate human embryonic stem cells (hESCs) into endothelial cells, and detect the endothelial functions of the obtained cells.MethodsWe cultured undifferentiated H9 human embryonic stem cell line in low-adhesion dishes to form embryonic bodies (EBs). After 12 days, EBs were harvested, re-suspended into rat tail collagen type I, and put into the incubator (37℃). After 30 minutes, EGM-2 culture medium was added to the solidified collagen, and the EBs were cultured for another 3 days to form embryonic body-sproutings (EB-sproutings). EB-sproutings were digested with 0.25% collagenase I and 0.56 U/ml Liberase Blendzyme for 20 minutes respectively, and the CD31+cells were sorted by FACS. The endothelial functions were tested by Dil-ac-LDL uptake assay and tube formation assay.ResultsThis approach raised the efficiency of endothelial differentiation to 18%, and also avoided the contamination with animal materials. The obtained hESC-derived endothelial cells (hESC-ECs) had the similar pattern of surface biomarkers as human umbilical vein endothelial cells (HUVECs), and their endothelial functions were confirmed by the uptake of Dil-ac-LDL and the tube formation on Matrigel.ConclusionsThe improved 3D approach can enhance the efficiency of differentiation from hESCs into endothelial cells. Furthermore, serum free differentiation system may be applied in future hESC-based therapies for various ischemic diseases.
human embryonic stem cells; human embryonic stem cell-derived endothelial cells; three dimension differentiation; CD31
王宝玉 电话:022-27557477,电子邮件:wbylwg@sina.com;李宗金 电话:022-23509475,电子邮件:zongjinli@nankai.edu.cn
R322.1
A
1000-503X(2012)06-0539-06
国家自然科学基金 (31071308)和天津应用基础与前沿技术研究计划重点项目(12JCZDJC24900)Supported by the National Natural Sciences Foundation of China(31071308) and Tianjin Research Program of Application Foundation and Advanced Technology (12JCZDJC24900)
10.3881/j.issn.1000-503X.2012.06.001
LI Zong-jin Tel:022-23509475, E-mail: zongjinli@nankai.edu.cn
2012-01-13)
