白藜芦醇对肝脂肪积累的抑制作用及其分子机制
2012-11-13李燕强华伟娜杨俊霞潘志强
李燕强 华伟娜 杨俊霞 潘志强
1.徐州医学院江苏省麻醉学重点实验室江苏省麻醉与镇痛应用技术重点实验室,江苏徐州 221000;2.广东省罗定市廷锴纪念中学,广东罗定 527200
白藜芦醇对肝脂肪积累的抑制作用及其分子机制
李燕强1华伟娜2杨俊霞1潘志强1
1.徐州医学院江苏省麻醉学重点实验室江苏省麻醉与镇痛应用技术重点实验室,江苏徐州 221000;2.广东省罗定市廷锴纪念中学,广东罗定 527200
目的研究白藜芦醇对SIRT基因家族表达的影响,探讨白藜芦醇抑制不同条件引起脂肪积累的分子机制。方法分别用高糖、高糖+白藜芦醇、高脂、高脂+白藜芦醇的培养基处理肝细胞HL7702,油红O染色法检测细胞内脂肪积累水平;后提取各组蛋白质,Western blotting方法检测不同组间SIRT基因家族各成员的表达情况。结果白藜芦醇能明显降低高脂引起的脂肪积累,对高糖引起的脂肪积累作用不明显;在高脂条件下,白藜芦醇可以促使SIRT1、SIRT3、SIRT4和SIRT5的表达增加,使SIRT7表达降低;在高糖条件下,白藜芦醇可以促使SIRT1、SIRT4、SIRT5和SIRT7的表达增加。结论SIRT1、SIRT3和SIRT7是白藜芦醇抑制脂肪积累的关键基因。
白藜芦醇;肝脂肪积累;抑制作用;分子机制
白藜芦醇是一种多酚类植物化合物,是普遍存在于葡萄酒中的活性成分,近期研究表明白藜芦醇具有抵抗肥胖、抗高血糖和高血脂等作用,对能量代谢疾病有潜质的治疗作用[1]。白藜芦醇在哺乳动物中主要通过激活组蛋白脱乙酰基酶沉默信息调节因子1(SIRT1)发挥作用[2]。
SIRT家族共有7个成员,其活性都依赖于细胞内NAD+ /NADH的比例,提示SIRT家族可能参与能量代谢的调控[3]。已有研究表明,白藜芦醇通过激活SIRT1,进而抑制脂肪酸合成、增加脂肪降解,并能促进糖异生抑制糖酵解作用[3]。然而,白藜芦醇对SIRT家族其他成员的调控作用尚未见报道。本文采用高糖和高脂肝细胞模型,检测白藜芦醇对两种细胞模型脂肪积累的影响,并检测在两种细胞模型中白藜芦醇对SIRT家族成员表达量的影响,进一步探讨白藜芦醇抑制不同条件引起的脂肪积累的分子机制。
1 材料与方法
1.1 细胞和主要试剂
本研究采用的正常人肝细胞HL7702购自中科院上海细胞库,采用含10%胎牛血清的DMEM培养基进行培养,培养条件为37℃、5%CO2。
白藜芦醇购自Sigma;SIRT家族成员抗体以及HPR二抗均购自Santa Cruz;Protein Detector LumiGLOWestern Blot Kit购自KPL公司;油红O购自Sigma公司;PVDF膜购自Roche。
1.2 细胞处理
细胞根据处理方式不同分成以下四组:HP组(高脂处理,培养基含有200μmol/L软脂酸)、HPR组(高脂+白藜芦醇组,培养基含有200μmol/L软脂酸钠和50μmol/L白藜芦醇)、HG组(高糖处理,培养基含4 500mg/L葡萄糖)和HGR组(高糖+白藜芦醇组,培养基含4 500mg/L葡萄糖和50μmol/L白藜芦醇);各组细胞处理24 h后收获,进行下一步的实验。
1.3 油红O染色
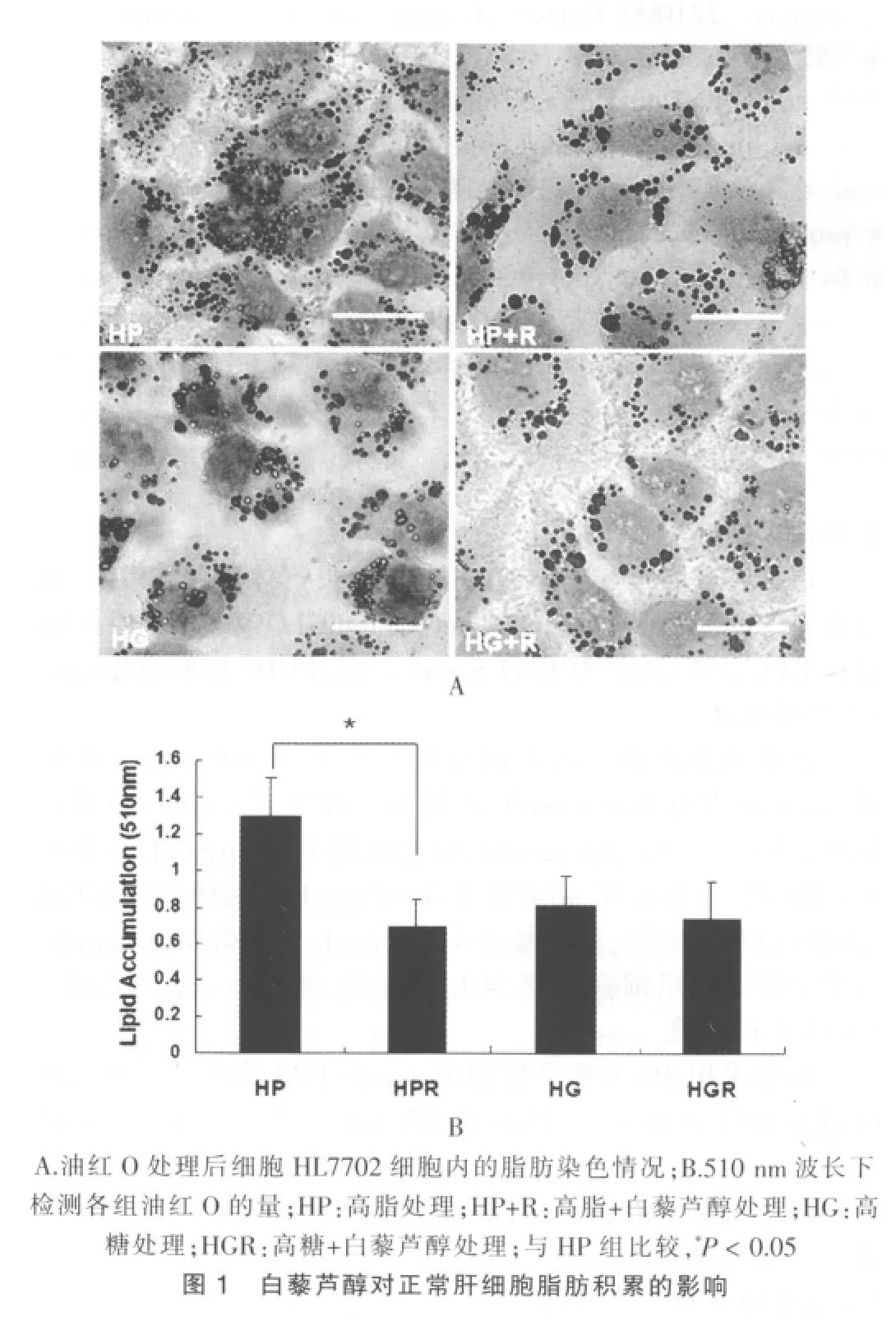
细胞采用4%多聚甲醛固定4min,PBS清洗,后加入稀释过的油红O溶液,摇床染色20 min,自来水冲洗,然后进行以下实验:苏木素复染10 s,1%盐酸酒精分化,拍照;或采用异丙醇溶解溶液,收获溶解液,在510 nm波长下检测吸光值。实验均重复3次。
1.4 总蛋白提取
预冷的PBS洗涤细胞2次,按照细胞数1.0×106/20μL裂解液的比例,加入预冷的单去污裂解液[50mmol/LTris(pH 8.0),150mmol/L NaCl,1%NP-40],同时按一定比例加入蛋白酶抑制剂,冰上裂解30min,4℃下12 000 r/min离心5min,吸取上清,紫外分光光度计定量检测蛋白浓度后-70℃分装保存。
1.5 W estern blotting
每条泳道加入等量的蛋白样本(50~100μg),加入5×蛋白上样缓冲液[1 mmol/L Tris-HCl(pH 6.8),5%beta-巯基乙醇,2%SDS,0.01%溴酚蓝,10%甘油]。100℃变性5 min,后10%~12%SDS-PAGE电泳分离,后转移到PVDF膜上,5%脱脂奶粉室温封闭1 h,Protein Detector LumiGLOWestern Blot Kit检测,实验均重复3次。
1.6 统计学方法
采用统计软件SPSS 13.0对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 白藜芦醇对HL7702细胞脂肪积累的影响
图1结果显示,在高脂组,白藜芦醇处理HL7702细胞后,脂肪积累量显著下降(P<0.05);在高糖组,白藜芦醇处理后,细胞脂肪积累量变化不明显,说明在肝细胞中,白藜芦醇能有效抑制由高脂引起的脂肪积累,对高糖引起的脂肪积累抑制效果并不明显。
2.2 白藜芦醇对SIRT家族表达量的影响
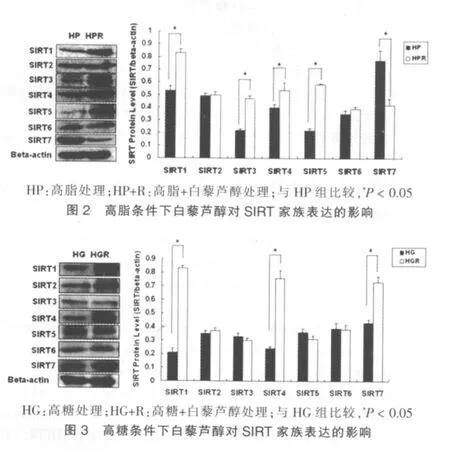
为进一步探讨白藜芦醇对不同条件引起的脂肪积累的作用机制,笔者检测了高脂处理组和高糖处理组中SIRT家族的表达量变化。Western Blotting结果显示,与HP组比较,HP+R组HL7720细胞中的SIRT1,SIRT3,SIRT4和SIRT5的表达增加,SIRT7表达降低(P<0.05)(图2);与HG组比较,高糖+白藜芦醇处理可以促使SIRT1,SIRT4,SIRT5和SIRT7的表达增加(P<0.05)(图3)。以上结果提示,在不同条件引起的脂肪积累中,白藜芦醇的作用机制是截然不同的。
3 讨论
白藜芦醇是一种多酚化合物,在葡萄皮和葡萄籽中含量丰富。白藜芦醇具有减轻高热量饮食带来的不良影响、抵抗肥胖和延长寿命等作用[4],因此,从分子水平上了解白藜芦醇的作用机制,为其作为预防和治疗能量代谢疾病、保持健康和延长寿命的关键调控因子提供重要的理论依据。本结果显示,在正常肝细胞中,白藜芦醇对于高脂引起的脂肪积累有显著的抑制作用,然而对高糖引起的脂肪积累作用并不明显,提示白藜芦醇对不同条件导致的脂肪积累的机制可能是截然不同的。目前研究表明,白藜芦醇能特异性激活SIRT1,进而调控下游p53、NF-κB、FoxO、PGC-1α、PPAR、C/EBPa和C/EBPd等重要信号通路关键分子[2,5-8],发挥其生理学和生物学功能,然而,由白藜芦醇引起的SIRT1激活涉及哪些相互蛋白的相应活化,白藜芦醇对SIRT家族其他成员是否存在调控作用,SIRT成员之间是否存在联系等问题尚不清楚。本结果显示,在高脂和高糖处理的细胞模型中,白藜芦醇除了可以激活SIRT1蛋白的表达,还能使SIRT4和SIRT5的表达增加。已有研究表明,SIRT1具有核穿梭功能,主要定位与细胞浆和细胞核[9],而SIRT4和SIRT5则主要定位于线粒体[10-11],定位的不同提示其发挥的功能截然不同,具有核穿梭能力的SIRT1更多发挥的是信号传导分子的作用,定位于线粒体的SIRT4和SIRT5则主要参与呼吸作用的能量传递,但由于他们对于NAD(+)的依赖性[12],使他们不可避免存在功能相关性,例如它们都参与能量代谢的调控,因此它们对白藜芦醇的刺激均表现活性的变化,正是其功能相关性的重要体现。
为了进一步探讨白藜芦醇的分子作用机制,需更关注在高脂和高糖处理的肝细胞模型中,表达趋势不一致的SIRT家族成员。在高脂处理的细胞模型中,SIRT3表达量增加,SIRT7表达量下降,而在高糖处理的细胞模型中,SIRT3表达量没有明显变化,SIRT7表达量升高,这些结果提示,SIRT3和SIRT7可能是白藜芦醇在高脂和高糖引起的脂肪积累中影响作用不一致的关键因素。已有研究表明,SIRT1和SIRT3均对AceCS1具有高亲和性,并且SIRT3对AceCS2的乙酰化修饰起调控作用[13],这些结果提示SIRT1和SIRT3在能量代谢中发挥协同作用,共同调控能量代谢的关键分子acetyl-CoA的合成。目前研究表明,SIRT7主要定位于细胞核,参与rDNA的转录,是PolⅠ转录的正调控因子,而SIRT1通过去乙酰化作用于TAFI68负调控PolⅠ[14-15],这些结果表明,SIRT1和SIRT7作用相反,是一对拮抗分子。因此,在高脂处理的细胞模型中,由于与SIRT1发挥协同作用的SIRT3表达增加而与SIRT1发挥拮抗作用的SIRT7下调表达,放大了SIRT1的作用,因此脂肪积累受到抑制;在高糖处理的细胞模型中,SIRT7表达增高而SIRT3表达不变,SIRT1的作用被抵消,因此白藜芦醇脂肪积累效果不明显。
综上所述,白藜芦醇发挥功能的关键在于SIRT1及其协同/拮抗作用因子的作用总和,如何通过增强协同因子、减少拮抗因子的作用进而放大SIRT1的功能,对于白藜芦醇发挥脂肪积累作用至关重要,这为白藜芦醇的应用提供理论基础。
[1]Baur JA,Sinclair DA.Therapeutic potential of resveratrol:the in vivo evidence[J].Nature Reviews,2006,5(6):493.
[2]Borra MT,Smith BC,Denu JM.Mechanism of human SIRT1 activation by resveratrol[J].The Journalof BiologicalChemistry,2005,280(17):17187.
[3]Lagouge M,Argmann C,Gerhart HZ,et al.Resveratrol improves mitochondrial function and protects againstmetabolic disease by activating SIRT1 and PGC-1alpha[J].Cell,2006,127(6):1109.
[4]Baur JA,Pearson KJ,Price NL,et al.Resveratrol improves health and survival ofmice on a high-calorie diet[J].Nature,2006,444(7117):337.
[5]Yeung F,Hoberg JE,Ramsey CS,et al.Modulation of NF-kappaB-dependent transcription and cell survival by the SIRT1 deacetylase[J]. The EMBO journal,2004,23(12):2369.
[6]Brunet A,Sweeney LB,Sturgill JF,et al.Stress-dependent regulation of FOXO transcription factorsby theSIRT1 deacetylase[J].ScienceNew York,2004,303(5666):2011-2015.
[7]Rodgers JT,Lerin C,Haas W,et al.Nutrient control of glucose homeostasis through a complex of PGC-1alpha and SIRT1[J].Nature,2005,434(7029):113.
[8]Picard F,KurtevM,Chung N,etal.Sirt1 promotes fatmobilization inwhite adipocytesby repressing PPAR-gamma[J].Nature,2004,429(6993):771.
[9]Cohen HY,Miller C,Bitterman KJ,et al.Calorie restriction promotes mammalian cell survival by inducing the SIRT1 deacetylase[J].Science New York,2004,305(5682):390-392.
[10]Argmann C,Auwerx J.Insulin secretion:SIRT4 gets in on the act[J]. Cell,2006,126(5):837.
[11]Schlicker C,Gertz M,Papatheodorou P,et al.Substrates and regulation mechanisms for the human mitochondrial sirtuins Sirt3 and Sirt5[J]. Journal of Molecular Biology,2008,382(3):790.
[12]Borradaile NM,Pickering JG.NAD(+),sirtuins,and cardiovascular disease[J].Current Pharmaceutical Design,2009,15(1):110.
[13]Hallows WC,Lee S,Denu JM.Sirtuins deacetylate and activate mammalian acetyl-CoA synthetases[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(27):10230.
[14]Ford E,Voit R,Liszt G,et al.Mammalian Sir2 homolog SIRT7 is an activator of RNA polymeraseⅠtranscription[J].Genes&Development,2006,20(9):1075.
[15]Grob A,Roussel P,Wright JE,et al.Involvement of SIRT7 in resumption of rDNA transcription at the exit from mitosis[J].Journal of Cell Science,2009,122(4):489.
Effect and mechanism of resveratrol on inhibition of fat accumulation in liver cells
LIYanqiang1 HUAWeina2 YANG Junxia1 PAN Zhiqiang1
1.Anesthesiology Key Laboratory of Xuzhou Medical College in Jiangsu Province Anesthesia and Analgesia Application Technology Key Laboratory in Jiangsu Province,Jiangsu Province,Xuzhou 221000,China;2.General Cai TingkaiMemorial Middle School in Luoding City,Guangdong Province,Luoding 527200,China
ObjectiveTo investigate the effect of resveratrol on SIRT family and the differentmechanism of inhibited effect of resveratrol on fat accumulation in liver cells causing by different conditions.MethodsLiver cells were treated by high palmitate,high palmitate+resveratrol,high glucose or high glucose+resveratrol respectively.Then the level of fat accumulation wasmeasured by Oil red O staining.The SIRT family protein level was detected by Western blotting.ResultsResveratrol could significantly decrease fat accumulation caused by high palmitate,but not by high glucose.Resveratrol could increase the expression of SIRT1,SIRT3,SIRT4,SIRT5,but decrease SIRT7 in high palmitate condition,while it could increase SIRT1,SIRT4,SIRT5 and SIRT7 expression in high glucose condition.ConclusionSIRT1,SIRT3 and SIRT7 play important roles of inhibiting fat accumulation inducing by resveratrol.
Resveratrol;Fat accumulation in liver cells;Inhibition;Mechanism
R735.7
A
1673-7210(2012)11(c)-0009-03
李燕强(1978.8-),男,广东从化人,博士研究生,助理研究员;研究方向:生物医学工程。
潘志强(1974.7-),男,安徽淮北人,博士研究生,副研究员;研究方向:药物的脑保护作用及机制。
2012-05-24 本文编辑:卫轲)
