含驱白巴布期胶囊血清对人黑素瘤细胞A375增殖和迁移的影响
2012-11-12霍仕霞康雨彤彭晓明唐晓琴
霍仕霞,康雨彤,彭晓明,高 莉,唐晓琴,彭 英,闫 明
(1.新疆维吾尔医药研究所细胞分子实验室,新疆维吾尔医方剂学实验室,新疆乌鲁木齐 830049;2.新疆维吾尔自治区药物研究所分析室,新疆乌鲁木齐 830004)
白癜风的发生与酪氨酸酶活性、细胞黑素含量及黑素细胞增殖的关系非常密切。黑素细胞通过氧化酪氨酸合成表皮黑素,酪氨酸酶是黑素合成的关键酶。文献报道,增强酪氨酸酶活性和加速黑素生成的药物能够有效治疗白癜风[1]。维药治疗白癜风有较好的疗效,但作用机制尚不明确。驱白巴布期片是由补骨脂(Psoralea corylifolia L.)、驱虫斑鸠菊〔Vernonia anthelmintica(Linn.)Willd〕、高良姜(Alpinia officinarum Hance)、盒果藤(Opercalina turperthum L.)和白花丹(Plumbago zeylanica L.)组成的维吾尔药复方制剂,具有通脉和理血的作用,用于治疗白癜风[2]。本课题组通过工艺改进,将其制备成驱白巴布期胶囊(qubaibabuqi capsule,QBC)。本研究从细胞水平探讨该胶囊含药血清体外对人黑素瘤细胞A375增殖和迁移、酪氨酸酶活性及黑素生成的影响,为临床治疗白癜风提供参考。
1 材料与方法
1.1 动物和细胞
SD大鼠,雄性,体质量180~220 g,由新疆维吾尔自治区疾病预防控制中心实验动物中心提供,许可证号:SYXK(新)2003-0003。人黑素瘤细胞A375由上海中科院细胞库提供。
1.2 药物、主要试剂和仪器
QBC由补骨脂、驱虫斑鸠菊、高良姜、盒果藤和白花丹以质量比6∶6∶3∶3∶2配伍组成,70%乙醇回流提取3次,浓缩干燥后,提取物加淀粉混匀,制备成每粒重0.25 g的胶囊(每粒胶囊相当于原料药0.1565 g),其中每粒含补骨脂素不低于0.8041 mg,异补骨脂素不低于0.6606 mg,高良姜素不低于0.3522 mg。DMEM干粉培养基,美国Gibco公司;胎牛血清,美国Hyclone公司;MTT,美国Amresco公司。YJ-875净化工作台,中国上海苏达实验仪器厂;XD-101倒置显微镜,中国江南光电仪器有限公司;MCO-18AIC型CO2培养箱,日本Sanyo公司;Bip-Rad550型酶标仪,美国伯乐公司;MM-3微量振荡器,江苏沈高康健生化器具厂;DK-80电热恒温水槽,上海医用恒温设备厂。
1.3 QBC大鼠含药血清的制备
QBC 200粒,去除胶囊壳,取内容物,研匀。以0.5%羧甲基纤维素钠溶液制备灌胃用的药液。将20只大鼠随机分为4组,正常对照组和QBC 0.54,2.7 和5.4 g·kg-1组,禁食12 h 后,正常对照组大鼠ig给予等体积0.5%羧甲基纤维素钠,QBC组大鼠分别ig给药。每天2次,连续3 d,末次给药后2~3 h后腹主动脉无菌取血,825×g分离血清,-20℃保存备用。临用前56℃灭活30 min,0.22μm微孔滤膜除菌[3-4]。
1.4 MTT法测定人黑素瘤A375细胞存活
选择对数生长期细胞,用0.25%胰酶消化,收集并调整细胞密度为5×107L-1,接种于96孔细胞培养板中,每孔100μl。待细胞贴壁后弃去培养基,分别加入最终浓度为5%,10%,20%和30%正常对照组血清或含药血清的培养液100μl,继续培养48 h[5]。培养结束前 4 h,每孔加入 20 μl MTT 5 mg·L-1,继续培养 4 h后弃去上清液,每孔加入DMSO 150μl,震荡10 min左右,使结晶完全溶解,立即于酶标仪490 nm处测定吸光度(absorbance,A)值[6]。每个样品设4个复孔。
1.5 人黑素瘤A375细胞酪氨酸酶活性[7]的测定
分别将各组含药血清加入细胞上,继续培养48 h,弃去培养液,PBS液洗2次,每孔加体积分数为0.01的 TritonX-100溶液50μl;迅速置 -80℃冻存30 min;随后室温融化;37℃预温后加入0.1%左旋多巴溶液10μl,置37℃电热恒温水槽中反应2 h,于酶标仪490 nm处测定A值。每个样品设4个复孔。
1.6 人黑素瘤A375细胞黑素含量[8]的测定
选择对数生长期的细胞,用0.25%胰酶消化,收集并调整细胞密度为5×107L-1,接种于96孔细胞培养板中,每孔100μl。待细胞贴壁后弃去培养基,分别加入终浓度为20%的正常对照组血清或含药血清的培养液100μl,继续培养48 h,弃去培养液,用 PBS液洗 2次,每孔加入 100μl NaOH 1 mol·L-1,置 37℃ 48 h 后,于酶标仪 490 nm 处测定A值。每个样品设4个复孔。
1.7 人黑素瘤A375细胞迁移能力的测定
1.7.1 Transwell微孔膜法
选择对数生长期的细胞,用0.25%胰酶消化,收集并调整细胞密度为1×108L-1,接种于24孔板,每孔1 ml。待细胞贴壁后弃去培养基后,分别加入终浓度为20%的正常对照组血清或含药血清的培养液1 ml,继续培养48 h后,胰酶消化并用培养基稀释为2×108L-1,取200μl加入用30μl人纤维粘连蛋白5 ml·L-1预处理过的Transwell小室的上室中继续培养18 h,取出Transwell,用棉签擦去上室细胞和人纤维粘连蛋白,用PBS洗3遍,将小室放入醋酸∶甲醇=1∶3(V/V)的固定液600μl中4℃固定30 min,晾干,姬姆萨染色10 min,PBS洗涤5遍,晾干后将小室放在载玻片上,置于显微镜下观察细胞,于不同视野拍照,每组8张,进行细胞计数[9]。
1.7.2 划痕实验
选择对数生长期的细胞,用0.25%胰酶消化,收集并调整细胞密度为1×1011L-1,接种于24孔板,每孔1 ml。培养24 h后,用200μl枪头在孔底均匀划出2道划痕,弃去培养基,用PBS轻轻清洗3次,除去漂浮细胞。分别加入终浓度为20%的正常对照组血清或含药血清的培养液1 ml。每组2个复孔,继续培养18 h,显微镜下观察细胞迁移情况[10]。
1.8 统计学分析
2 结果
2.1 含QBC血清对人黑素瘤A375细胞增殖的影响
表1结果显示,与正常对照组相比,QBC 0.54 g·kg-1组大鼠含药血清浓度为 30% 时,对A375黑素瘤细胞具有促增殖作用(P<0.05);QBC 2.7 g·kg-1大鼠含药血清浓度为10%时具有促增殖作用(P <0.01);QBC 5.4 g·kg-1含药血清浓度为20%时具有促增殖作用(P<0.05)。
2.2 含QBC血清对人黑素瘤A375细胞酪氨酸酶活性的影响
表2结果显示,与正常对照组相比,QBC 0.54 g·kg-1组含药血清浓度为 5%时对 A375 人黑素瘤细胞具有促酪氨酸酶活性的作用(P<0.05);QBC 2.7 g·kg-1组含药血清浓度为5%和 10%时,有抑制酪氨酸酶活性作用(P<0.01或P<0.05);QBC 5.4 g·kg-1组含药血清浓度为 5%,10% 和 20%时,有促酪氨酸酶活性作用(P<0.05或P<0.01)。
2.3 含QBC血清对人黑素瘤A375细胞黑素生成的影响
表3结果显示,与正常对照组相比,QBC 2.7和5.4 g·kg-1含药血清对 A375细胞具有显著促黑素含量增加的作用(P <0.05,P <0.01);且 QBC 5.4 g·kg-1含药血清促黑素含量增加的能力明显高于 QBC 2.7 g·kg-1(P <0.01)。QBC 0.54 g·kg-1含药血清无显著增加黑素含量的作用。

Tab.1 Effect of Qubaibabuqi capsule(QBC)containing serum on human melanoma A375 cell proliferation
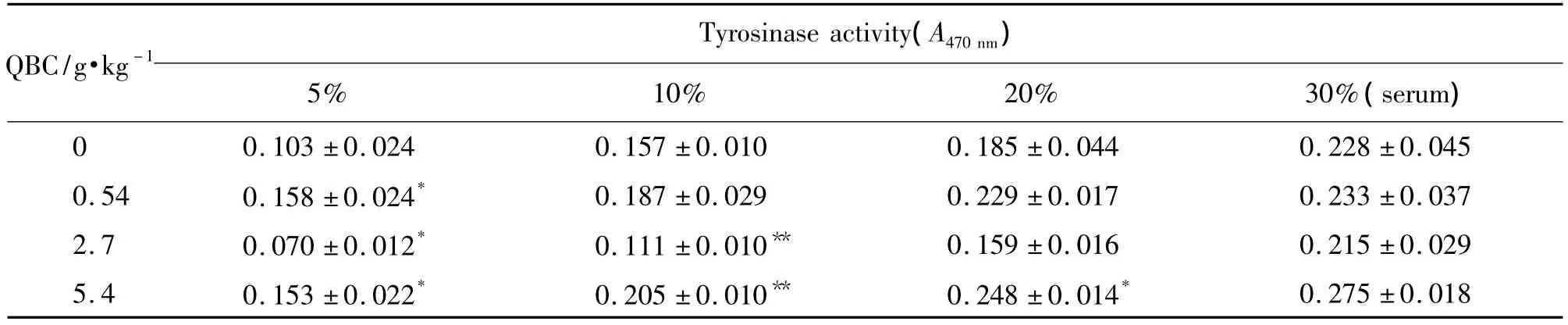
Tab.2 Effect of serum-containing QBC on tyrosinase activity of human melanoma A375 cells
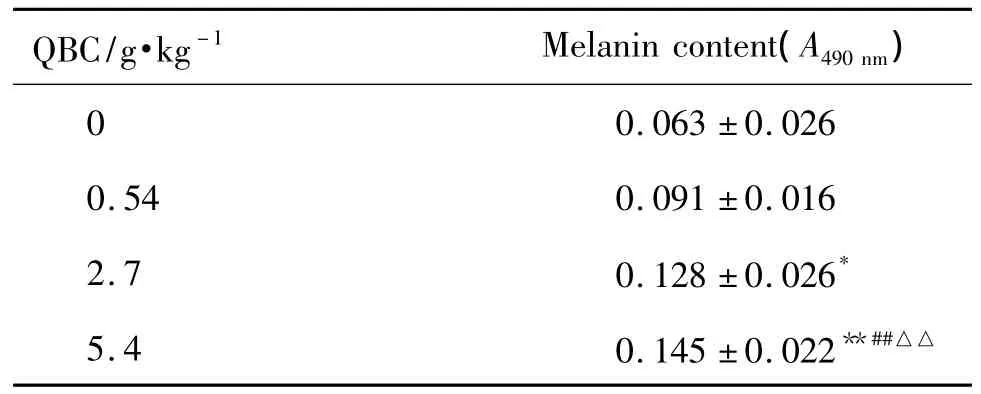
Tab.3 Effect of QBC containing 20%serum on melanin content in human melanoma A375 cells
2.4 QBC含药血清对人黑素瘤A375细胞迁移能力的影响
Transwell微孔膜法实验结果(表4)显示,与正常对照组相比,QBC 0.54,2.7 和 5.4 g·kg-1大鼠20%含药血清均能显著提高A375细胞的迁移能力(P <0.01)。QBC 5.4 g·kg-1含药血清促 A375 细胞的迁移能力明显高于2.7 g·kg-1,并且有随剂量增加作用增强的趋势。
划痕结果表明(图1),与正常对照组的(104±6)μm相比,QBC 0.54,2.7 和 5.4 g·kg-1含药血清组细胞划痕边界距离分别为50±3,43±5和(12±2)μm,说明均能明显促进A375细胞伤痕愈合,而QBC 5.4 g·kg-1含药血清促伤口愈合能力明显强于 QBC 0.54和2.7 g·kg-1组(P <0.01),提示 QBC 可能有促进A375细胞迁移的能力。

Tab.4 Effect of QBC containing 20%serum on migration of human melanoma A375 cells
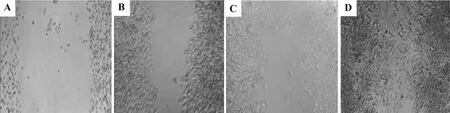
Fig.1 Effect of QBC on migration of A375 cells.A:normal control;B,C and D:QBC 0.54,2.7 and 5.4 g·kg-1 group,respectively.
3 讨论
血清药理学是近年来建立和发展起来的一种适合于体外研究中药药理的新方法,主要是通过研究给药动物血清的生物学活性来揭示药物作用机制。本研究通过合并一组动物的血清消除个体差异。预实验中,进行了含药血清灭活与不灭活的比较及采用不同给药剂量进行体外筛选,最后确定采用灭活后的含药血清,增大给药剂量以便优选体外实验所需合适的血清比例,确保了实验结果的可靠性[11]。
近年来,针对中药对酪氨酸酶活性影响进行了较大规模筛查,并在此基础上以黑素瘤细胞和动物模型进行实验。本研究结果显示,QBC含药血清显著促进黑素的合成,且具有一定的剂量相关性,并能显著促进细胞增殖。研究发现,白癜风早期皮损处黑素细胞数量明显减少,故细胞数量的增加在一定程度上有利于色斑恢复[12]。QBC含药血清能够上调酪氨酸酶活性,促使黑素细胞合成色素增加。
白癜风晚期患者皮肤基底层黑素细胞完全消失,患者白斑区色素恢复只能依赖于毛囊外毛根鞘处黑素细胞储库或白斑区周边黑素细胞的活化、增殖和迁移,且以毛囊为主。刺激毛囊前体及白斑区周边区黑素细胞增殖和向病灶迁移亦是一条重要的治疗思路。本研究在观察了QBC对黑素合成影响的基础上,进一步研究其对黑素细胞迁移的影响,有助于全面阐明其作用机制。
本研究表明,QBC不但能促进黑素合成,还能促使黑素细胞向病灶部位迁移,提示其可能通过不同的作用机制发挥治疗作用,但对其中的具体有效活性成分尚待更深入的研究。
[1]Manga P,Sato K,Ye L,Beermann F,Lamoreux ML,Orlow SJ.Mutational analysis of the modulation of tyrosinase by tyrosinase-related proteins 1 and 2 in vitro[J].Pigment Cell Res,2000,13(5):364-374.
[2]Ministry of Health of the People's Republic of China.Uygur Pharmaceutical Standards[S].Xinjiang Science and Technology Publishing House,1999.
[3]Xu SY,Bian RL,Chen X.Methodology of Pharmacological Experiments(药理实验方法学)[M].Beijing:People's Medical Publishing House,2001:202-203.
[4]Cheng DQ,Wei XD,Wang SQ,Xu AE.Effect of traditional Chinese medical on the tyrosinase activity and melanogenesis in B-16 murine melanoma[J].Chin J Dermatol(中国皮肤科杂志),2000,33(3):173-174.
[5]Cha XS,Liu YI,LI Y.The effects of medicated blood serum with compound Chinese drugs on melanocytes proliferation and tyrosinase activity[J].Chin J Dermol Venereol(中国皮肤性病学杂志),2008,22(11):652-654.
[6]Zhang L,Zhao JX,Li P,Liu WH,Wang JS.In vitro study of drug contained serum with Chinese medicines nourish liver and kidney on B16M elanocyte cytotoxicity,melanin synthesis and cAMP[J].Liaoning J Tradit Chin Med(辽宁中医杂志),2009,36(3):467-469.
[7]Wang H,Wang JS,Wang P,Cai NN,Tao Y,Guo NJ.Effects of traditional Chinese medicine for nourishing liver and kidney on melanogenesis in normal human melanocytes in vitro[J].Chin J Dermatol Venereol Integ Trad Western Med(中国中西医结合皮肤性病学杂志),2004,3(4):208-210.
[8]Deng RC,Zhou Y,Zhang JG,Xu JG,Shang J,Yu LH.Effect of Vernonia anthelmintica Willd.on tyrosinase activity andmelanogenesis in A375 human melanoma[J].Lett Biotechnol(生物技术通讯),2002,13(2):135-137.
[9]Zhang XQ,Feng J,Mou KH,Ma HQ,Niu XW,Liu C.Effects of bFGF andα-MSH on adhesion and migration of human melanocytes in vitro[J].J Zhejiang Univ:Med Sci(浙江大学学报:医学版),2006,35(2):161-164.
[10]Zhang XQ,Mou KH,Ma HQ,Zhao J,Yan XN,Feng J.Effects ofα-MSH on melanocytemigration and intracellular[Ca2+]iin vitro[J].J Med Postgrad(医学研究生学报),2005,18(5):391-392,396.
[11]Cui L, Yan WD, Gao TW. Review and prospect of methods in serum pharmacology on Chinese herbal medicine[J].Med J Chin PAPF(武警医学),2004,15(6):460-461.
[12]Zhou MN, Lin FQ, Guan CP, Fu LF,Hong WS,Xu AE.Effect of InnVit gene on migration of immortally melanocyte B10BR[J].Chin J Dermatol Venereol Integ Trad Western Med(中国中西医结合皮肤性病学杂志),2010,9(2):75-78.
