多沙唑嗪对映体对大鼠离体心脏心肌活力的作用
2012-11-12段立华任雷鸣
段立华,任雷鸣
(1.河北化工医药职业技术学院制药工程系医药营销教研室,河北石家庄 050026;2.河北医科大学药学院药理学教研室,河北石家庄 050026)
良性前列腺增生(benign prostatic hyperplasia,BPH)是男性老人的常见病和多发病之一,临床上常使用α1受体阻断药进行药物治疗[1]。这些药物在治疗BPH的同时,对心血管系统的不良反应如低血压和头晕等,在一定程度上限制了该类药物的临床应用[2]。因此,开发对下尿路具有高选择性的α1受体阻断药具有重要的临床意义。本课题组曾报道了消旋多沙唑嗪(rac-doxazosin,rac-Dox)显著抑制电刺激麻醉猫腹下神经引起的尿道压升高[3]。在兔离体胸主动脉和颈动脉,左旋多沙唑嗪(S-doxazosin,S-Dox)拮抗去甲肾上腺素(NA)诱发血管收缩的pA2值显著小于右旋多沙唑嗪(R-doxazosin,RDox)和rac-Dox[4]。在兔耳动脉、肠系膜动脉和肺动脉,S-Dox拮抗NA诱发血管收缩的作用同样弱于R-Dox[5],提示S-Dox可能成为心血管不良反应小的治疗BPH药物。但是,Dox对映体对离体心房肌和心室肌功能活动的影响未见文献报道,本研究试图探讨Dox对映体对大鼠离体右心房心率、左心房以及右心室心肌收缩力的作用,从而为开发S-Dox用于治疗BPH提供实验基础。
1 材料与方法
1.1 药品及仪器
甲磺酸S-Dox原粉、甲磺酸R-Dox原粉、甲磺酸rac-Dox原粉,均为华药集团新药研发公司合成,纯度均大于99%。BL-420E生物机能实验系统(成都泰盟科技有限公司)。
1.2 动物及离体标本的制备
Wistar大鼠,雄性,体质量250~320 g,河北医科大学实验动物中心提供,动物许可证号605005。
Wistar大鼠 ip 给予 25% 乌拉坦 1.5 g·kg-1麻醉后,经颈动脉放血处死。迅速开胸,剪断与心脏相连大血管,取出心脏置于充氧的冷Krebs溶液中,沿房室沟剪去右心室,保留右心房(不可损伤窦房结)。在右心耳两端尖部各系一丝线,一端固定于麦氏浴槽底部,另一端连接张力换能器;施静息张力1g,并通过生物机能实验系统(BL-420E+)记录右心房自发性收缩反应[6]。麦氏浴槽内盛有10 ml Krebs溶液,持续通以95%O2+5%CO2混合气体,维持温度34.5 ~35.5℃,平衡1 h,其间每20 min 换液1次。标本平衡1 h后,开始实验。
左心房标本的制备操作基本同右心房,只是保留左心房。由于左心房没有自发性收缩,所以在平衡30 min后,电刺激(波宽 2 ms,频率 4 Hz,120 ~150%阈电压)驱动左心房肌收缩,并通过生物机能实验系统(BL-420E+)记录心肌收缩力[6]。
右心室标本的制备操作同左心房,只是沿右心室左缘将右心室剪开,用手术刀把右心室纵向一分为二,在标本上、下两端各系一丝线。其余同左心房。
1.3 心率的检测
取1.2制备的平衡处理后的右心房,分为正常对照(n=14)、S-Dox(n=14)、R-Dox(n=14)和rac-Dox(n=14)组,按累积给药法给药。正常对照、S-Dox、R-Dox和rac-Dox组分别用微量进样器将15 μl的蒸馏水和 2 mmol·L-1的 S-Dox,R-Dox和rac-Dox加入浴槽,间隔20 min,再分别加入35μl蒸馏水和 2 mmol·L-1的 S-Dox,R-Dox 和 rac-Dox,以此类推。3种药物的给药终浓度均为3,10和30 μmol·L-1。以第1次给药时的前3 s内平均心率作为药前值;每次给药后,记录药后第20分钟时前3 s内的平均心率作为药物的反应。心率变化率(%)=药后心率-药前心率/药前心率×100%。
1.4 心肌收缩力的检测
取1.2制备并平衡处理后的左心房,每组8个标本,分为正常对照、S-Dox、R-Dox和rac-Dox组,按累积给药法给药(同1.3)。
取1.2制备并平衡处理后的右心室,每组8个标本,分为正常对照、S-Dox、R-Dox和rac-Dox组,按非累积给药法给药。正常对照、S-Dox、R-Dox和rac-Dox组用微量进样器分别将15μl的蒸馏水和2 mmol·L-1的 S-Dox,R-Dox 和 rac-Dox 加入浴槽,观察20 min后反复冲洗,平衡5~7 min再分别加入50 μl的蒸馏水和 2 mmol·L-1的 S-Dox,R-Dox和rac-Dox,以此类推。3种药物的给药终浓度均为3,10 和 30 μmol·L-1。
以第1次给药时的前3 s内平均肌张力作为药前值;记录每次药后第20分钟时3 s内的平均肌张力作为药物的反应。心肌收缩力变化率(%)=药后收缩力-药前收缩力/药前收缩力×100%。
1.5 统计学分析
2 结果
2.1 多沙唑嗪对映体对大鼠离体右心房心率的作用
正常对照组的14个标本均未发生停搏反应。R-Dox 3 μmol·L-1处理时,2 个出现停搏,R-Dox 10 μmol·L-1时,又2 个出现停搏,R-Dox 30 μmol·L-1时,3个出现停搏。S-Dox<30 μmol·L-1时,未诱发停搏反应;rac-Dox<10 μmol·L-1时,未诱发停搏反应。
正常对照组在累积给蒸馏水处理时间,心率处于208±31~(211±34)min-1,无显著差异,说明实验条件对心率无影响。表1~表3结果显示,S-Dox对大鼠离体右心房心率无影响。R-Dox 3~30 μmol·L-1均显著减慢心率(P <0.05),随浓度增加,抑制作用有增强趋势(各浓度之间无显著性差异)。rac-Dox 3 ~30 μmol·L-1分别使心率下降了(6.8 ±8.7)%,(15.7 ±20.8)%和(15.7 ±22.6)%。

Tab.1 Effect of S-Dox enantiomer on heart rate(HR)in isolated right atrium of rats
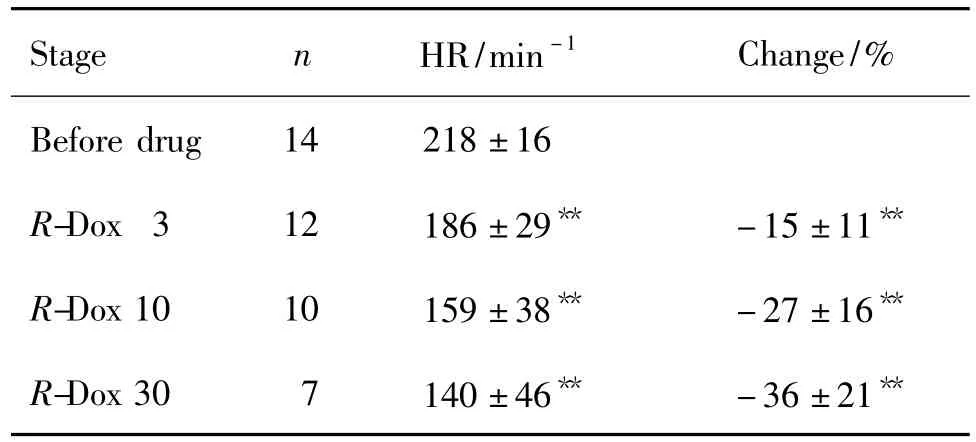
Tab.2 Effect of R-Dox enantiomer on heart rate in isolated right atrium of rats

Tab.3 Effect of rac-Dox enantiomer on heart rate in isolated right atrium of rats
2.2 多沙唑嗪对映体对大鼠离体左心房心肌收缩力的作用
实验期间正常对照组大鼠左心房心肌收缩力为0.32 ±0.06~(0.29 ±0.05)g,无明显差异性改变。表4~表6结果显示,S-Dox 3,10和30 μmol·L-1大鼠离体左心房的心肌收缩力显著增强(P<0.05),并具有浓度依赖性,S-Dox的增强百分率分别为(10.4 ± 12.7)%,(25.7 ± 14.9)% 和(50.4 ±19.7)%。相反,R-Dox和rac-Dox显著抑制左心房心肌收缩力,并具有浓度依赖关系(r=0.9743,P<0.01);R-Dox 3,10,30 μmol·L-1对左心房收缩力的抑制百分率分别为(17.3±7.1)%,(29.2±9.7)%和(60.5 ±17.4)%;同浓度 rac-Dox 对左心房收缩力的抑制百分率分别为(17.2±8.1)%,(20.4 ±14.2)%和(45.7 ±18.4)%。
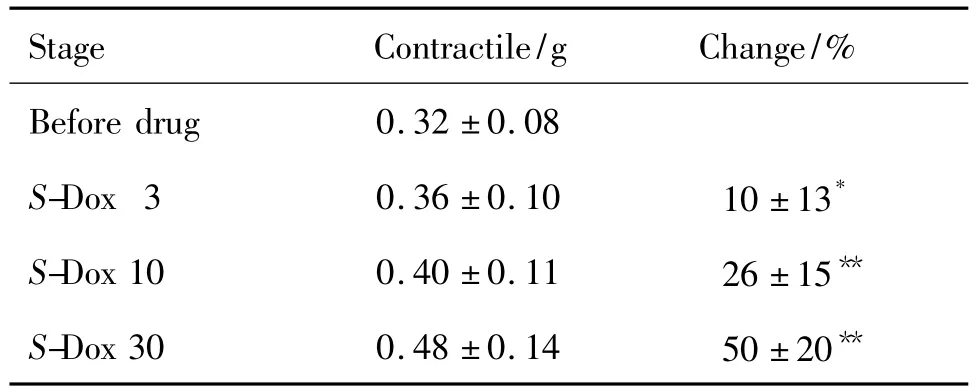
Tab.4 Effect of S-Dox enantiomer on contractile force in isolated left atrium of rats

Tab.5 Effect of R-Dox enantiomer on contractile force in isolated left atrium of rats
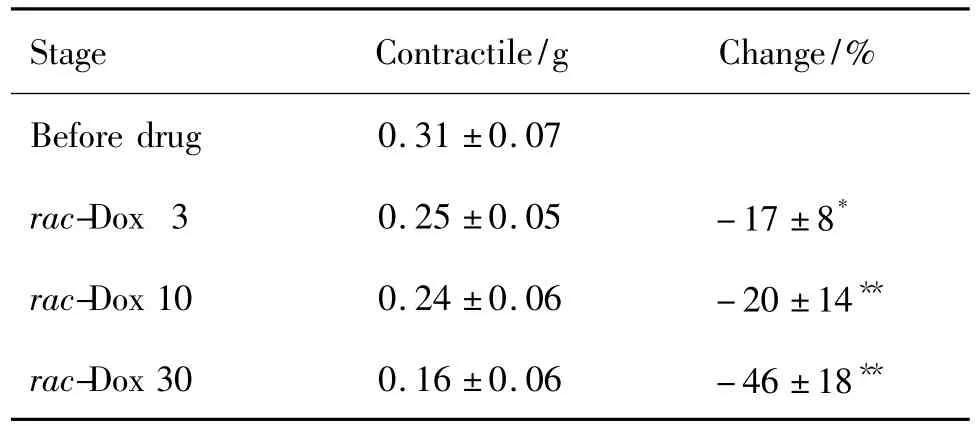
Tab.6 Effect of rac-Dox enantiomer on contractile force in isolated left atrium of rats
2.3 多沙唑嗪对映体对大鼠离体右心室肌收缩力的作用
表7结果显示,与正常对照组大鼠右心室收缩力相比,S-Dox 3,10 和30 μmol·L-1对大鼠右心室肌收缩力无显著性影响。R-Dox 3,10和30 μmol·L-1浓度依赖性地抑制大鼠右心室肌收缩力(r=0.9896,P <0.05),抑制百分率分别为(38.1 ±16.4)%,(66.2 ±10.9)%和(87.6 ±6.2)%(P <0.05)(表5)。rac-Dox 3,10 和 30 μmol·L-1浓度依赖性地抑制大鼠右心室肌收缩力(r=0.9822,P <0.05),抑制百分率分别为(21.1 ±8.7)%,(35.2 ±9.7)%和(70.9 ±10.2)%(P <0.05)。
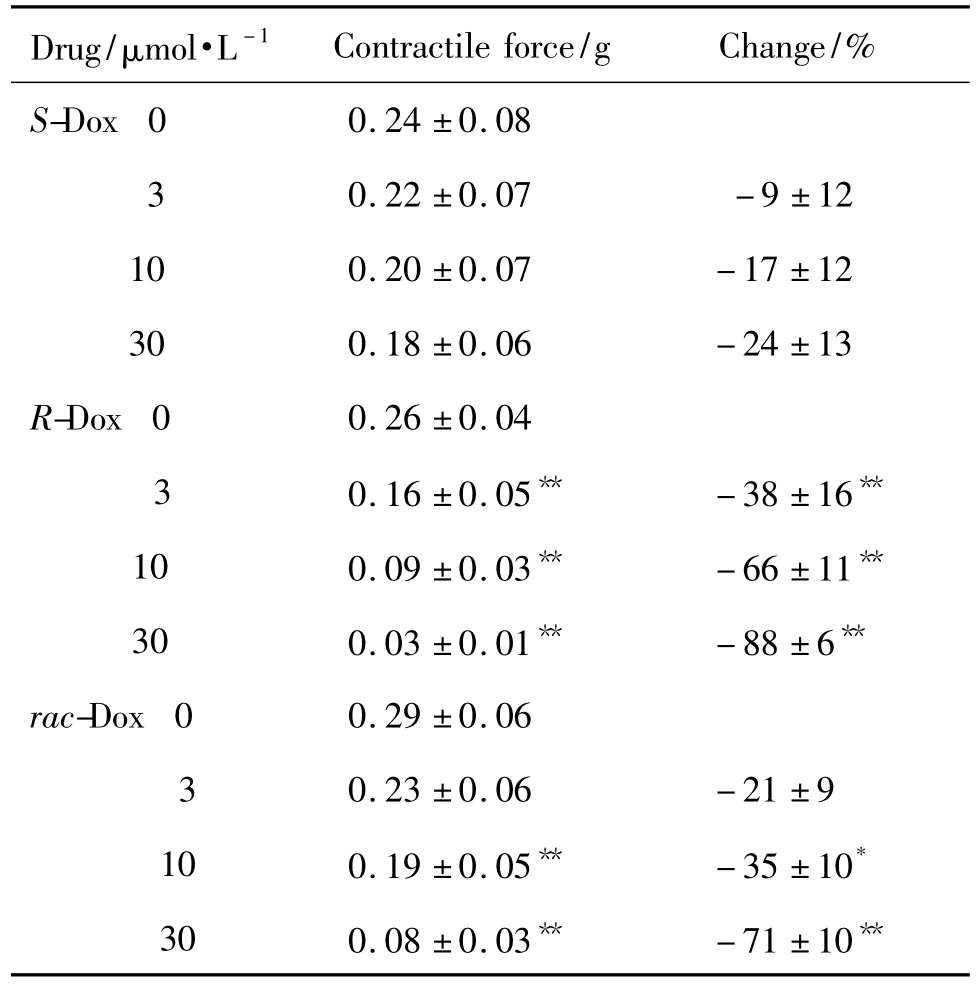
Tab.7 Effect of doxazosin enantiomers on contractile force in isolated right ventricle preparation of rats
3 讨论
α1受体阻断药在高浓度时,可能产生不同程度的α2受体阻断作用;交感神经末梢的α2受体被阻断时,可促进末梢释放NA,导致心率加快等不良反应。本研究发现,S-Dox在浓度低于30μmol·L-1时,未诱发停搏反应;R-Dox和rac-Dox在浓度低于30μmol·L-1时,分别使28%和7%的右心房标本发生停搏反应。S-Dox 3~30 μmol·L-1对大鼠离体右心房心率无影响;R-Dox和rac-Dox各浓度均显著减慢心率。Lee等[7]曾报道,多沙唑嗪导致的心律失常与多沙唑嗪立体构型有关,与多沙唑嗪抑制结区组织L型钙电流内流有关。本研究结果与Lee等[7]的预测基本一致,提示rac-Dox对心率的不良反应与R-Dox有关,S-Dox与R-Dox的作用机制有差异。
研究结果表明,大多数哺乳动物心脏中均存在相当数量的α1受体,其中以大鼠心脏的α1受体密度最高,超出其他种属5倍以上,而人心脏α1受体的密度最低。目前已证实α1受体的三种亚型在心脏中均有表达,但它们在mRNA和蛋白表达水平上不尽相同,不同种属间亦存在明显差异[8]。心脏的α1受体激动后,通过提高心肌细胞内Ca2+浓度以及提高心肌肌原纤维对Ca2+的敏感性实现正性变力效应[9]。在离体心肌收缩力方面,本研究发现,S-Dox 3 ~30 μmol·L-1显著增强大鼠离体左心房的心肌收缩力,对大鼠右心室收缩力无显著性影响。同浓度R-Dox和rac-Dox显著抑制左心房和右心室心肌收缩力。S-Dox与R-Dox都是选择性较高的α1受体阻断剂。本研究结果提示,α1受体阻断作用与多沙唑嗪及其对映体的心脏效应无关。
孙家安等报道[10],在小鼠离体左心房标本,R-Dox抑制心收缩力,而S-Dox增强心肌收缩力,多沙唑嗪的手性结构对其上述活性具有明显的影响。本研究结果与其报道一致,进一步证实多沙唑嗪对映体对离体心肌有显著不同的作用,这种不同的作用与其手性结构有关。王荣英等[11]报道,S-Dox和R-Dox对大鼠胸主动脉血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的抗增殖作用具有化学结构的立体选择性,S-Dox的抗VSMCs增殖作用明显强于R-Dox,说明多沙唑嗪及其对映体对心血管系统的作用存在立体选择性,而且该立体选择性与药物阻断α1受体的活性无关。
结合本实验可以推测,与R-Dox相比,作为治疗BPH的药物S-Dox对心脏心肌活力的不良反应明显少于R-Dox和rac-Dox,S-Dox可能成为对心脏不良反应小的治疗BPH的药物。
[1]Wilde MI,Fitton A,McTavish D.Alfuzosin.A review of its pharmacodynamic and pharmacokinetic properties,and therapeutic potential in benign prostatic hyperplasia[J].Drugs,1993,45(3):410-429.
[2]Kirby RS,Coppinger SW,Corcoran MO,Chapple CR,Flannigan M,Milroy EJ.Prazosin in the treatment of prostatic obstruction.A placebo-controlled study[J].Br J Urol,1987,60(2):136-142.
[3]Yang ZH,Ren LM,Wu ZJ,Fu SX,Li YS.Selective effects of alfuzosin and doxazosin with intraduodenal administration on urethral pressure of cats[J].Acta Pharmacol Sin(中国药理学报),1999,20(5):431-434.
[4]Niu CQ,Zhao D,Jia XM,Ren LM.α1-Adrenoceptor antagonist profile of doxazosin and its enantiomers in isolated rabbit blood vessels[J].Chin JPharmacol Toxicol(中国药理学与毒理学杂志),2003,17(5):354-359.
[5]Lu HG,Liu LF,Ren LM,Zhao QH,Duan LH,Zhang XY.Effects of doxazosin enantiomers on α-adrenoceptors of isolated rabbit blood vessels[J].Acta Pharm Sin(药学学报),2007,42(2):145-151.
[6]Zhu ZN,Zhao D,Ren LM.Selective positive inotropic action of urocortin on rat and rabbit isolated heart tissues[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2005,19(6):428-435.
[7]Lee AS,Chen WP,Su MJ.Comparison of the cardiac electrophysiological effects between doxazosin and bunazosin[J].J Biomed Sci,2008,15(4):519-528.
[8]Su DF.Cardiovascular Pharmacology[M].Beijing:Scinece Press.2001:78-79.
[9]Hattori Y,Kanno M.Role of alpha1-adrenoceptor subtypes in production of the positive inotropic effects in mammalian myocardium:implications for the alpha1-adrenoceptor subtype distribution[J].Life Sci,1998,62(17-18):1449-1453.
[10]Sun JA,Wang YW,Ren LM.Effects of enantiomers of alfuzosin and doxazosin on heart rate and contractile force in the isolated mouse atrium[J].Chin Pharmacol Bull(中国药理学通报),2010,26(11):1476-14 80.
[11]Wang RY,Ren LM.Chiral selective effects of doxazosin and its enantiomers on cell proliferation in cultured vascular smooth muscle cells of the rat aorta[J].Chin Pharmacol Bull(中国药理学通报),2009,25(1):81-84.
