紫外-可见分光光度法测定普乐安片中总甾醇含量
2012-11-10盛卫国叶剑锋马丽萍王如伟
盛卫国 叶剑锋 徐 勇 吴 健 马丽萍 王如伟
浙江现代中药与天然药物研究院有限公司浙江省中药制药技术重点实验室,浙江杭州 310052
紫外-可见分光光度法测定普乐安片中总甾醇含量
盛卫国 叶剑锋 徐 勇 吴 健 马丽萍 王如伟
浙江现代中药与天然药物研究院有限公司浙江省中药制药技术重点实验室,浙江杭州 310052
目的 建立紫外-可见分光光度法测定普乐安片中总甾醇的含量测定方法。 方法 以β-谷甾醇为对照品,通过香草醛-高氯酸显色反应,测定普乐安片中总甾醇的含量。 结果 对照品和样品最大吸收波长均在542 nm,对照品β-谷甾醇在0.030 39~0.081 04 mg范围内线性关系良好,r=0.998 8,样品平均回收率为100.6%,RSD=2.75%。结论 本法测定总甾醇含量准确、灵敏,重现性好,可用于测定普乐安片中总甾醇含量,为普乐安片质量控制提供可靠依据。
紫外-可见分光光度法;β-谷甾醇;普乐安片;总甾醇;含量测定
普乐安片是以油菜蜂花粉为原料制成的片剂,具有补肾固本的功能,主治肾气亏虚所致的腰膝酸软,尿后余沥或不禁,临床用于前列腺增生和慢性前列腺炎的治疗,疗效确切,安全性高。目前研究结果显示[1-5],植物甾醇可以很大程度地改善良性前列腺增生(BPH)患者泌尿系统症状,对抑制前列腺肥大和改善膀胱收缩均有明显效果。油菜花粉中总甾醇含量测定尚未见报道,本法通过紫外-可见分光光度法测定普乐安片中总甾醇含量,为提升普乐安片质量标准提供可靠依据。
1 仪器与试药
1.1 仪器
UV-2201紫外可见分光光度计(日本岛津公司);AX205分析天平(METTLER TOLEDO公司);DK-S26型电热恒温水浴锅(上海精宏实验设备有限公司);R206旋转蒸发器(上海申生科技有限公司)。
1.2 试药
普乐安片(浙江康恩贝制药股份有限公司);β-谷甾醇对照品(上海中药标准化研究中心,供含量测定用,批号:16-2001),高氯酸、香草醛、冰醋酸、氯仿等试剂均为分析纯(国药集团化学试剂有限公司)。
2 方法与结果
2.1 对照品溶液的制备
精密称取β-谷甾醇对照品10.13 mg于10 mL量瓶中,加三氯甲烷适量使溶解,并稀释至刻度,摇匀,精密移取1.0 mL于10 mL量瓶中,用三氯甲烷稀释至刻度,摇匀,即得,浓度为0.101 3 mg/mL。
2.2 供试品溶液的制备
取普乐安片若干,用润湿的洁净纱布小心擦去表面薄膜衣层,70℃减压干燥2 h,置研钵中研磨成粉,过80目筛,称取本品0.5 g,精密称定,置具塞锥形瓶中,精密加入50 mL氯仿,密塞称定重量,超声处理60 min,放冷,再称定重量,用氯仿补足失重,摇匀,滤过。精密移取续滤液10 mL于烧瓶中,减压蒸干,加入20 mL 10%氢氧化钠-乙醇溶液,95℃水浴回流2 h,放冷,加入40 mL蒸馏水,振摇,混匀,转移至分液漏斗中,用正己烷萃取3次,每次20 mL,合并正己烷萃取液,用蒸馏水洗涤正己烷液2次,每次40 mL,弃去水层,正己烷层减压回收至适当体积后,转移至50 mL量瓶中,用适量正己烷洗涤烧瓶,洗涤液并入量瓶中,用正己烷稀释至刻度,摇匀,即得。
2.3 测定条件的选择
2.3.1 测定波长的选择
精密移取0.5 mL β-谷甾醇对照品溶液、1.0 mL供试品溶液于10 mL具塞玻璃管中,85℃水浴挥尽溶剂,加入0.6 mL 5%香草醛-冰醋酸溶液,0.8 mL高氯酸,混匀,密塞,70℃水浴保温30 min,取出,流水迅速冷却至室温,精密加入冰醋酸4.6 mL,摇匀,随行试剂作空白,在190~900 nm进行波长扫描,对照品和供试品溶液均在在542 nm有最大吸收峰,故选择542 nm为总甾醇含量测定的检测波长。
2.3.2 显色条件的选择
2.3.2.1 显色反应正交设计 采用四因素三水平L9(34)正交试验优选显色条件,正交因素水平表设计见表1。
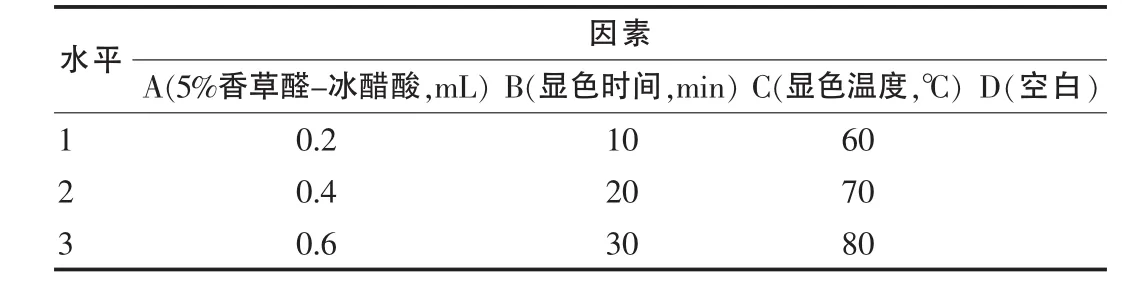
表1 显色条件正交设计因素水平表
精密移取0.5 mL β-谷甾醇对照品溶液于10 mL具塞玻璃试管中,85℃水浴挥尽溶剂,加入不同用量5%香草醛-冰醋酸溶液,0.8 mL高氯酸,混匀,密塞,70℃水浴保温30 min,取出,流水迅速冷却至室温,精密加入不同用量冰醋酸,使溶液体积为6.0 mL,摇匀,随行试剂作空白,在542 nm处测定吸光度值,结果见表2。
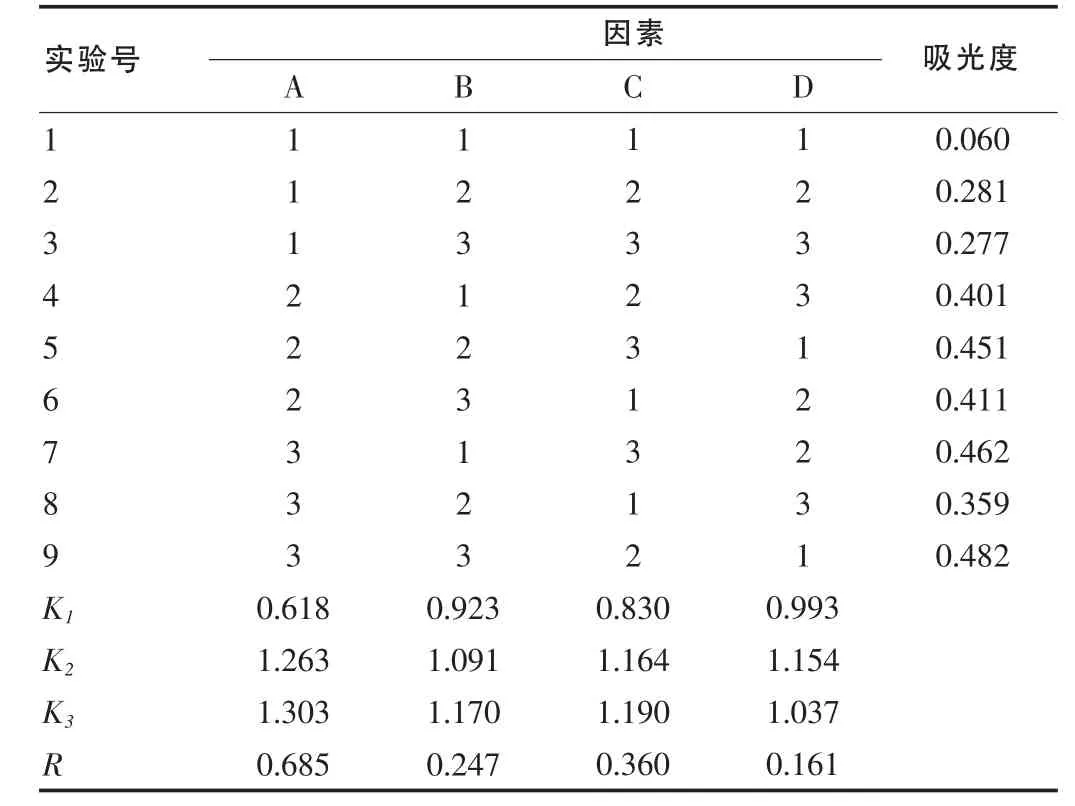
表2 显色反应正交设计试验结果
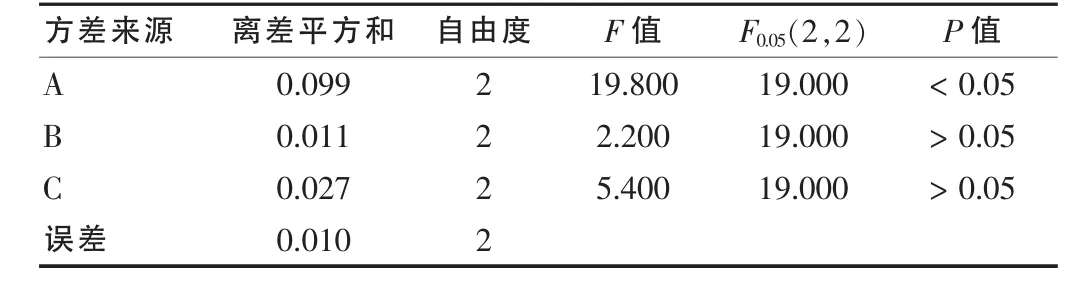
表3 方差分析
由表2可见,直观分析显示各因素对显色反应吸光度的作用主次为A>C>B,最佳显色条件为A3B3C3;方差分析结果表明A因素有统计学意义,而B、C因素无统计学意义;由于显色温度对吸光度无显著影响,考虑供试品稳定性,显色温度70℃为佳。
2.3.2.2 高氯酸用量的选择 参考文献报道,高氯酸用量对显色反应有较大影响,故在已选定的显色条件下,以β-谷甾醇对照品制备供试品溶液,单独考察不同高氯酸用量对显色反应的影响。结果显示,随着高氯酸用量增加,吸光度增加,当用量为1.2 mL时,吸光度出现下降;用量为0.4 mL时,λmax为545 nm,用量为1.0 mL时,λmax为541 nm,可见不同高氯酸用量可引起最大吸收波长及吸光度的变化,考虑对照品和供试品最大吸收波长的一致性以及供试品的稳定性,高氯酸用量以0.8 mL为宜。
综上所述,总甾醇最佳显色条件为:精密移取适量对照品溶液、供试品溶液于10 mL具塞玻璃试管中,85℃水浴挥尽溶剂,加入0.6 mL 5%香草醛-冰醋酸溶液,0.8 mL高氯酸,混匀,密塞,70℃水浴保温30 min,取出,流水迅速冷却至室温,精密加入冰醋酸4.6 mL,摇匀,随行试剂作空白,于542 nm测定吸光度。
2.3.2.3 显色稳定性试验 精密移取0.5 mL β-谷甾醇对照品溶液、1.0 mL供试品溶液于10 mL具塞玻璃试管中,自“85℃水浴挥尽溶剂”起,按确定的显色条件进行显色,分别于显色结束 10、15、20、25、30 min 测定对照品和供试品吸光度变化,结果表明对照品和供试品在30 min内显色稳定。
2.4 总甾醇标准曲线的制备
精密移取0.101 3 mg/mL的β-谷甾醇对照品溶液0.3、0.4、0.5、0.6、0.7、0.8 mL 于 10 mL 具塞玻璃试管中, 自“85℃水浴挥尽溶剂”起,按确定的显色条件进行显色和测定,以对照品质量和吸收值进行回归计算,得回归方程Y=-0.062 08+11.033 7 X,r=0.998 8,表明 β-谷甾醇在 0.030 39~0.081 04 mg线性关系良好。
2.5 供试品溶液稳定性试验
按供试品溶液的制备方法,自“称取本品0.5 g”起制备供试品溶液,分别于制备后 0、2、4、6、8 h 各精密移取 1.0 mL 于10 mL具塞玻璃试管中,自“85℃水浴挥尽溶剂”起,按确定的显色条件进行显色和测定,测得不同时间供试品溶液中β-谷甾醇含量见表4,RSD=2.33%,说明供试品溶液在8 h内稳定。

表4 供试品溶液稳定性试验
2.6 精密度试验
2.6.1 重复性
取普乐安片适量(批号:090220),按上述含量测定方法制备6份供试品溶液,测得总甾醇的含量分别为2.70%、2.66%、2.64%、2.79%、2.61%、2.70%,平均含量为 2.68%,RSD=2.36%,表明其重复性良好。
2.6.2 中间精密度
取普乐安片适量(批号:090220),按上述含量测定方法,于数天内测定总甾醇含量,分别为2.64%、2.68%、2.71%、2.71%、2.57%、2.55%,平均含量 2.64%,RSD=2.64%,中间精密度良好。
2.7 加样回收率试验
取普乐安片适量(批号:090220),按供试品溶液的制备方法,称取6份,每份0.25 g,精密称定,精密加入β-谷甾醇对照品溶液(含β-谷甾醇6.626 mg),自“精密加入50 mL氯仿”起,按供试品溶液的制备方法制备供试品溶液,按确定的显色条件进行显色和测定,计算加样回收率,结果见表5,表明本法回收率符合要求。
2.8 普乐安片中总甾醇含量测定
取5批不同批号的普乐安片,按上述含量测定方法测定总甾醇含量,结果分别为2.44%、2.43%、2.49%、2.46%、2.48%。

表5 总甾醇加样回收试验结果
3 讨论
3.1 样品溶液的皂化处理
样品溶液如果不进行皂化处理直接按显色条件进行显色,其最大吸收峰在537 nm,与对照品最大吸收峰542 nm相差较大,不符合《中国药典》2005年版附录ⅤA[6]紫外-可见分光光度法对供试品溶液吸收峰波长的规定。样品经皂化处理后,吸收峰波长与对照品最大吸收峰波长一致,符合规定,故样品需进行皂化处理。
3.2 显色方法的选择
根据文献报道,选择了Liebermann反应、改良Liebermann-Burchard试剂进行显色反应,但样品、对照品均存在吸光度变化快,无明显的显色稳定时间,故不适合作为本样品甾醇显色方法,香草醛-高氯酸反应灵敏度高,显色稳定,适合作为甾醇含量测定的显色反应。
[1]Coleman CI,Hebert JH,Reddy P,et al.The efect of phytosterols on quality of life in the treatment of benign prostatic hyperplasia[J].Pharmacother,2002,22(11):1426-1432.
[2]程丽艳,郑晓亮,屠凌岚,等,植物甾醇对非细菌性前列腺炎治疗作用的实验研究[J].中国临床药理学与治疗学,2010,9(15):991-996.
[3]赵国志,刘喜亮,刘智锋.植物甾醇及其产品开发利用(下)[J].粮食与油脂,2006,(3):3-8.
[4]徐卓云.植物类制剂治疗良性前列腺增生的作用研究进展[J].中国现代实用医学杂志,2006,5(5):41-43.
[5]韩军花.植物甾醇的性质、功能及应用[J].国外医学:卫生学分册,2001,28(5):285-287.
[6]国家药典委员会.中国药典[S].一部.北京:化学工业出版社,2005:附录28.
Quantitative determination of total sterol in Pule'an Tablets by UV spectrophotometry
SHENG WeiguoYE JianfengXU YongWU Jian MA LipingWANG Ruwei
Zhejiang Modern Chinese Medicine and Natural Drug Research Academy Co.,LTD.Zhejiang Provincial Key Laboratory of Traditional Chinese Medicine Pharmacecutical Technology,Zhejiang Province,Hangzhou 310052,China
Objective To establish the determination method of total sterol in Pule'an Tablets by UV spectrophotometry.Methods The determination was performed by using β-sitosterol as control substance.Through the vanillin-high chlorine acid color reaction,the content of total sterols in Pule'an Tablets were determined.Results The absorption wavelength of reference substance and sample maximum were both in the 542 nm.The absorbency and quality of β-sitosterol have good linearity in the range of 0.030 39-0.081 04 mg (r=0.998 8).The average recovery rate was 100.6%with RSD=2.75%.Conclusion The method is simple,highly accurate,reproducible,and can be applied to the determination of total sterol in Pule'an Tablets.
UV Spectrophotometry;β-sitosterol;Pule'an Tablets;Total sterol;Content determination
R285.5
A
1673-7210(2012)08(b)-0008-03
浙江省科技计划项目(项目编号:2009E10009);杭州市科技发展计划项目(项目编号:20061921N01)。
盛卫国(1972-),男,博士,工程师;研究方向:药物制剂新剂型与新技术。
王如伟,高级工程师,博士生导师。
2012-02-16 本文编辑:卫 轲)
