酵母发酵法提纯地木耳粗多糖的工艺优化
2012-11-09朱双杰孙艳辉贾晓丽
朱双杰, 孙艳辉, 贾晓丽, 张 汆
(滁州学院 生物与食品工程学院,安徽 滁州,239012)
地木耳(Nostoc commune Vauch),学名普通念珠藻,也称地皮菜、葛仙米、地耳等[1]。地木耳属原核生物界,蓝藻门、念珠藻属的单细胞陆生固氮蓝藻,是植物界最原始类群之一[2],我国各地均有分布,多见于无污染的背阴山坡及潮湿土壤表面,钙质丰富的土壤中生长较多[3]。成熟的地木耳形似木耳,墨绿色或褐绿色,生命力强,极耐干旱,雨后迅速吸水膨胀,恢复生机。地木耳具有一定的药理性,常食能清热解毒,凉血明目,有促进新陈代谢之功效[4-6],地木耳提取物对大肠杆菌、啤酒酵母、枯草芽孢杆菌、白色念珠菌和粘质沙雷细菌等5种常见微生物具有较好的抑制作用[7],是一种具有很高营养价值和经济价值的资源植物。近年来国内研究发现,地木耳含有丰富的水溶性多糖[8-10],地木耳的水溶性多糖具有很强的清除自由基的能力[11-12]。从植物中提取多糖的提取剂有酸液、碱液、酶及热水等[13],但这些提取方法有一个共同的弱点,即在多糖提取后,植物的其他营养成分被丢弃,使成本增加。酵母发酵法提取多糖是利用酵母在生长过程中,利用浸提液中的还原糖为碳源、地耳蛋白质为氮源、无机盐、维生素等营养物质进行生长,但酵母并不能够利用多糖,从而达到对植物多糖的去杂纯化的效果,分离出的酵母又是生产酵母粉、酵母蛋白肽、酵母多糖的原料,因此,酵母发酵法有利于资源的利用。安徽琅琊山地木耳资源丰富,探讨酵母发酵法对地木耳多糖的去杂纯化工艺,以期为本地地木耳的深加工提供参考。
1 材料与方法
1.1 材料与设备
啤酒酵母:湖北安琪酵母有限公司产品;鲜地木耳 :购于市场;蔗糖:购于市场。
KIELETEG ANALYSISER全自动凯氏定氮仪:瑞典FROSS公司产品;THZ-82水浴恒温振荡器:江苏荣华仪器有限公司产品;UV-720紫外分光光度计:北京瑞利分析仪器公司产品;酸度计:上海雷磁公司产品。
1.2 实验方法
1.2.1 啤酒酵母的活化 取250 mL容量瓶,加15 g蔗糖后用地木耳浸提定容,另取一个容量瓶,配制浓度为1.2×107个/mL酵母溶液,合并两容量瓶溶液与1 000 mL的容量瓶,于25℃下培养12 h。
1.2.2 提取及测定方法 准确称取地木耳干粉20 g,按1∶6比例加入蒸馏水[17],榨汁后分别加入0.01 g纤维素酶和0.01 g蛋白酶,温度25℃保持8 h,升温灭酶活。加入酵母发酵,过滤,滤液用旋转蒸发仪将上清液浓缩到适当体积后,缓慢加入3倍体积的无水乙醇,4℃低温放置过夜,可见白色絮状粗多糖析出,4 500 r/min离心20 min,收集沉淀物,干燥得粗多糖。
采用苯酚-硫酸法测定粗多糖中多糖含量[13],计算多糖得率。

1.2.3 pH值对多糖质量分数的影响 改变浸提液的pH值,测定pH值对多糖质量分数的影响。
1.2.4 单因素及正交实验 分别考察酵母量、蔗糖量、发酵温度及时间4个因素对总氮去除率影响。在此基础上,以粗多糖纯度及粗多糖得率为指标,采用L9(34)正交试验进行提取工艺的优化。
1.2.5 地木耳多糖的抗氧化性实验 清除·OH能力的测定采用Fenton反应法;清除O2-·自由基能力的测定采用邻苯三酚氧化法[16]。
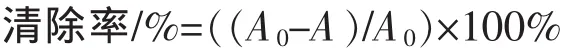
2 结果与分析
2.1 pH值对多糖提取率的影响
提取液的酸碱性对多糖提取率有一定的影响。提取液酸性或碱性碱较强可能会引起所提植物多糖的部分降解,引起多糖提取率的降低,但也有实验证明,有些材料的多糖用稀酸提取效果较佳[19]。因此在提取多糖前要考察酸碱度对多糖的影响,作者采取的是酵母发酵提纯多糖,酵母发酵会引起发酵液的酸度降低,故首先考察pH值对地木耳多糖提取率的影响是必要的。从图1可以看出,地木耳多糖提取率受提取液的pH值的影响。pH值为5时,多糖的提取率最高,为79.5±4.1%,说明稀酸有利于地木耳多糖的提取,当pH<5时,随着pH值的降低,多糖的提取率也在降低,这有可能是强酸性导致地木耳多糖的降解[19]。当pH>5时,多糖提取率随着pH值提高而降低,可能是提取液偏中性不利于多糖的释放。
图1显示,pH为5时,多糖的提取率最高,但与pH分别为5.5和4.5时的值76.5和76.2无统计学上的差异(P<0.05)。综合发酵的目的是获得地木耳多糖,同时又不影响纯化效果,设定发酵液的pH为 5±0.5。
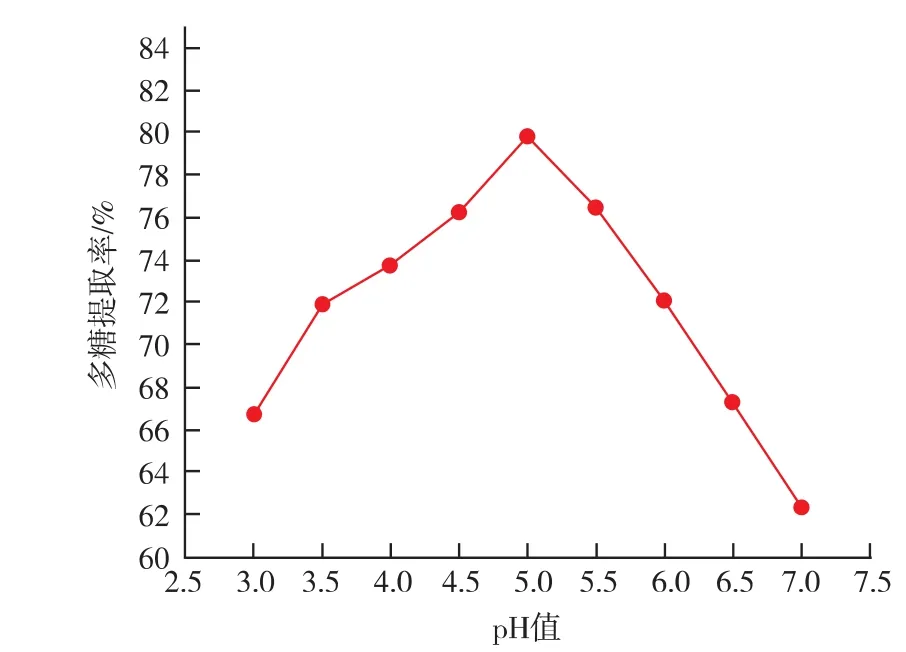
图1 pH值对多糖提取率的影响Fig.1 Effect of pH on the rate of polysaccharide extraction
2.2 单因素实验
2.2.1 酵母的添加量对总酸的影响 设发酵温度为30℃,蔗糖的添加量为30 mg/mL,发酵时间为24 h。 考察酵母添加量分别为 0.1、0.2、0.3、0.4、0.5 mg/mL时总氮去除率。图2显示,在一定浓度范围内,随着发酵初始酵母添加量的增大,对总氮的去除效果越好。但酵母量过大时,总氮去除率有降低的趋势。这是因为发酵液中的营养物质过早的消耗完而导致酵母过早的代谢和自溶,发酵滤液中的总氮的含量又升高,就表现为总氮去除率降低。从图2可以看出,初始酵母的最适添加量为0.3 mg/mL。
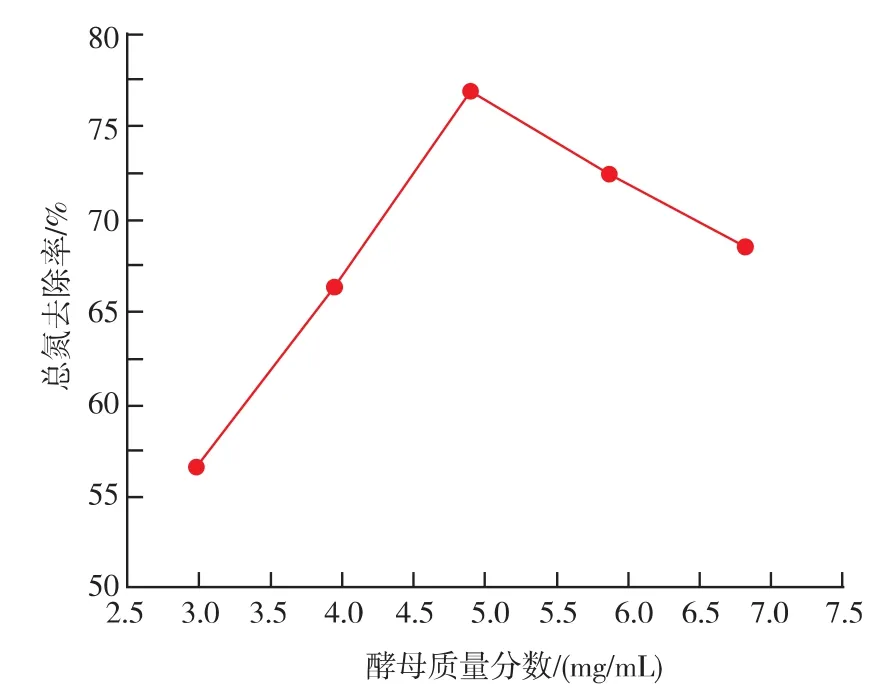
图2 酵母添加量对总氮去除效果的影响Fig.2 Effect of ridding of totle nitrogen by the additive number of yeast
2.2.2 蔗糖的量对总氮的影响 设发酵温度为30℃,酵母添加量为30 mg/mL,发酵时间为24 h。考察蔗糖添加量分别为 10、20、30、40、50 mg/mL 时总氮去除率。由3可以看出,初始蔗糖添加量的越大,总氮去除效果越好。但是,蔗糖的量超过一定值时,总氮去除率降低。这有可能是碳源量过大,酵母以代谢为主,代谢产物使发酵液氮源含量提高。由图3可以看出,蔗糖的最适添加量为30 mg/mL。
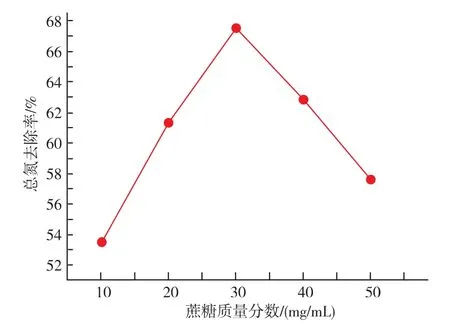
图3 蔗糖的添加量对总氮的去除效果影响Fig.3 Effect of ridding of totle nitrogen by the additive amount of sucrose
2.2.3 温度对总氮的影响 温度是影响啤酒酵母生长的重要因素,设蔗糖添加量为30 mg/L,酵母添加量为30 mg/mL,发酵时间为24 h,考察温度分别为25、30、35、40、45℃时总氮去除率。 由图4可知,温度为35℃时,总氮去除率最高,低于或高于35℃都不利于氮源的去除,这可能是35℃更适合酵母的生长,低温和高温都不利于酵母的生长。
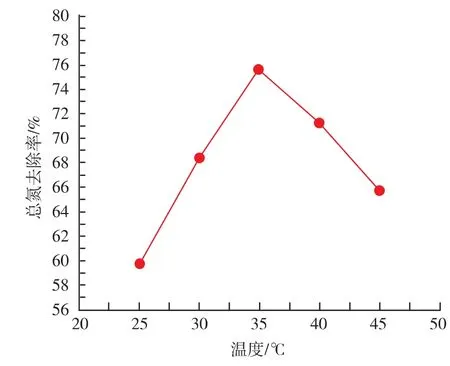
图4 温度对总氮去除效果的影响Fig.4 Effect of ridding of totle nitrogen by the temperature
2.2.4 发酵时间对总氮的影响 设蔗糖添加量为30 mg/L,酵母添加量为30 mg/mL,发酵温度为35℃。 考察时间分别为 8、16、24、32、40 h 时总氮去除率。图5显示,随着时间的延长,发酵液中的总氮去除的效果越好,但时间超过24 h时,总氮去除率反而降低。这可能是因为随着发酵时间的延长,营养物质随之被消耗,酵母由对数增长期进入稳定期,产生了氮源代谢产物,随着时间的延长,酵母转入衰亡期,导致发酵液中的氮源含量进一步增加,表现为总氮去除率的降低。
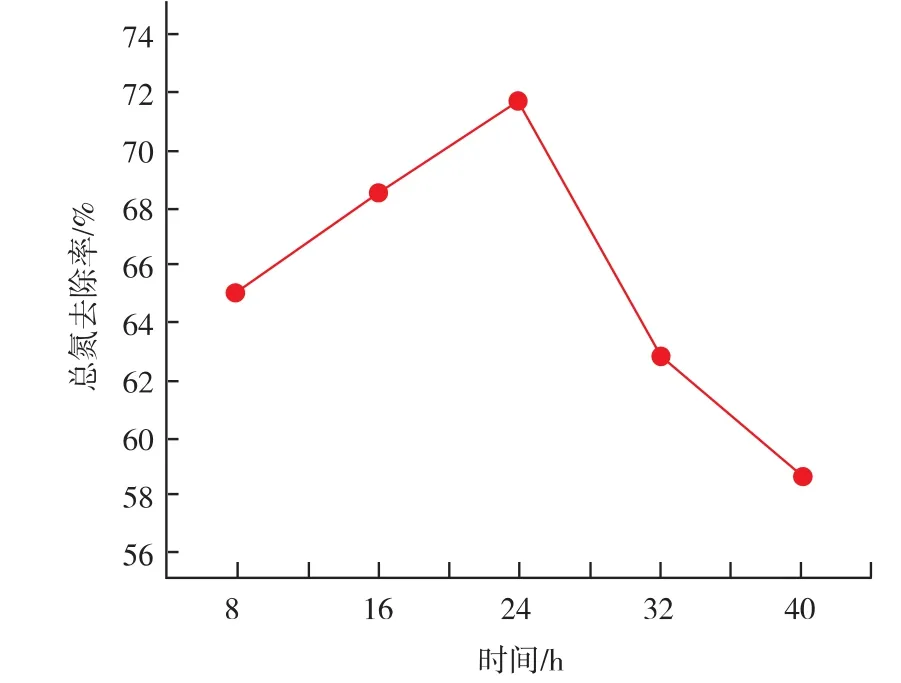
图5 时间对总氮去除效果的影响Fig.5 Effect of ridding of totle nitrogen by the time
2.3 正交实验优化酵母纯化地木耳粗多糖的工艺
2.3.1 正交表设计 保持发酵过程发酵液的pH为5,以酵母添加量、蔗糖补加量、发酵温度及发酵时间为实验因素,以多糖的纯度及多糖得率为指标,采用 L9(34)正交表(见表1),根据前面单因素实验结果确定单因素的水平及编码。见表1。对所得实验结果进行极差分析,确定最佳工艺条件。
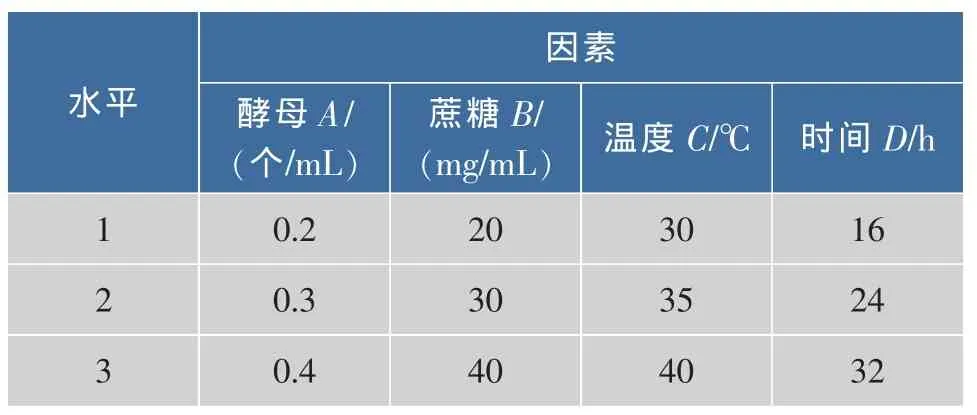
表1 因素水平表 L9(34)Tab.1 Factors and levels graph L9(34)
2.3.2 正交实验结果 由表 2、表3、表4可知,在发酵过程中,对多糖纯度的影响的因素大小为C>A>B>D,其中C因素对多糖纯度的影响极显著(P<0.01),酵母、蔗糖质量浓度对多糖纯度影响显著(P<0.05),发酵时间对多糖纯度的影响不显著 (P<0.05)。对多糖得率的影响因素大小为 B>A>D>C,但方差分析,4个因素对多糖得率的影响不显著 (P<0.05)。故以多糖纯度为标准确定最佳工艺,即最佳工艺条件为 C2>A3>B3>D1。即酵母量为 0.4 mg/mL,蔗糖的补加量为40 mg/mL,温度为35℃,时间为8 h。
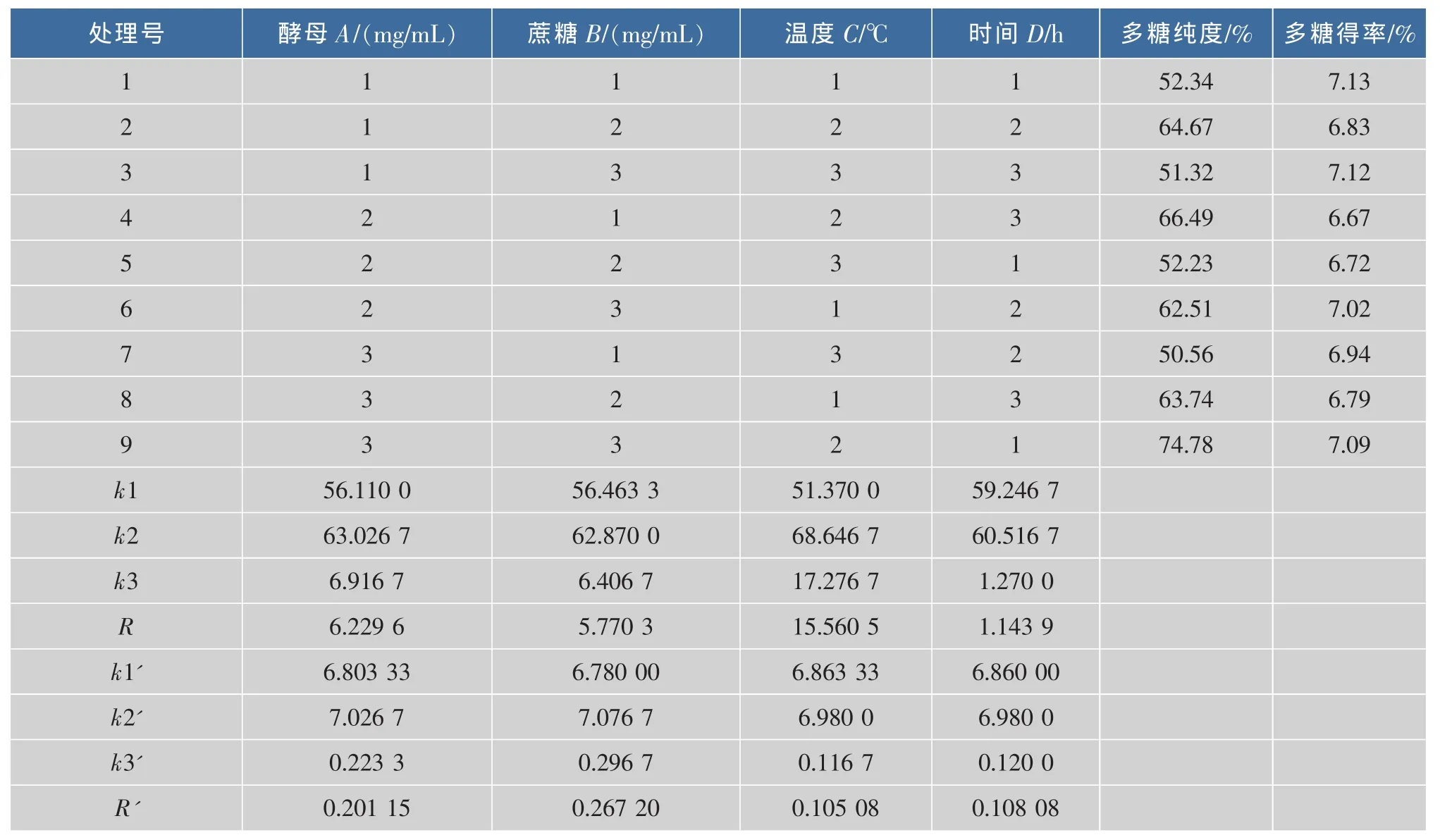
表2 正交实验结果Tab.2 Resut of orthogonal test
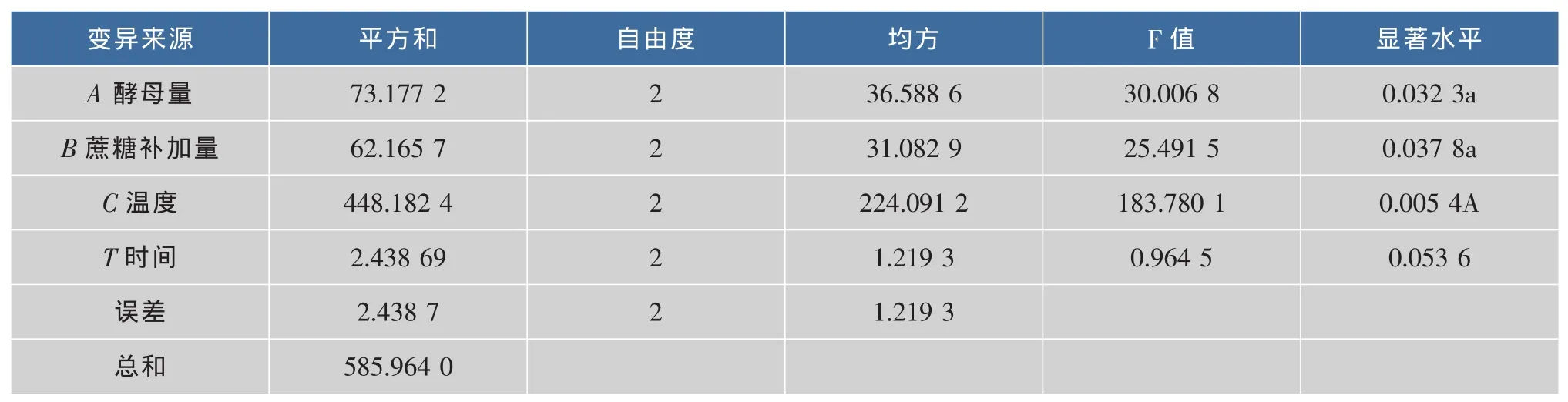
表3 正交设计方差分析表(去氮)Tab.3 Variance analysis of orthogonal design(denitrification)
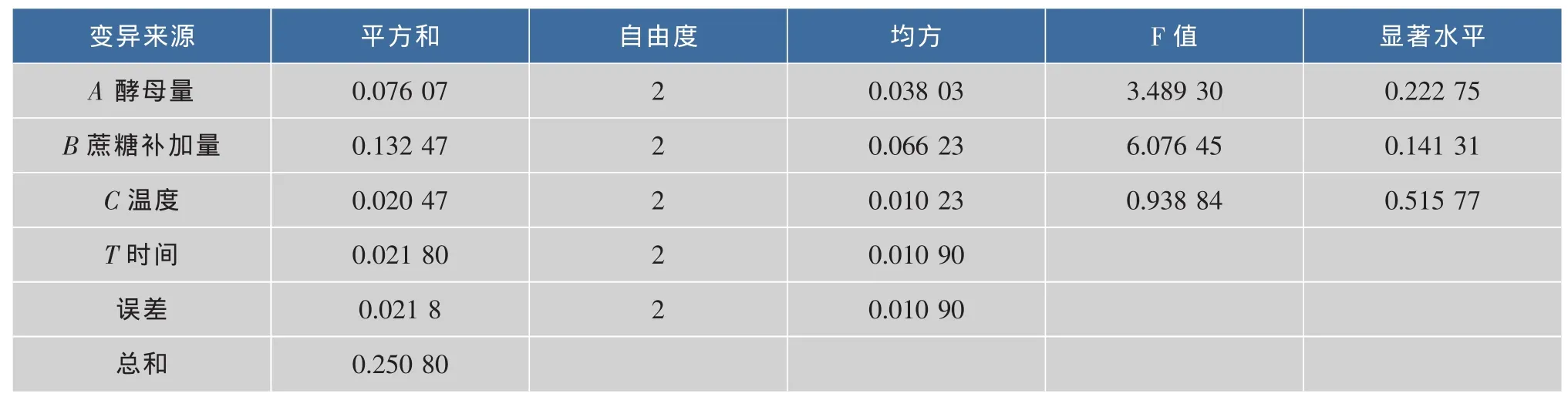
表4 正交设计方差分析表Tab.4 Variance analysis of orthogonal design(polysaccharose)
2.4 验证试验
实验显示,发酵前后多糖的含量未见显著变化(P<0.05), 纯度由 (27.56±1.32)%提高到 (75.38±2.53)%,差异极显著。多糖的抗氧化实验显示,发酵前后多糖的对·OH及O2-·清除率未见显著变化变。说明酵母发酵法不仅能提高地木耳粗多糖纯度,而且不会降低多糖的生物活性。
3 结语
对酵母发酵工艺进行了研究,得出最佳工艺为:发酵液的pH为5,酵母添加量为0.4 mg/mL,蔗糖的补加量为40 mg/mL,温度为35℃,发酵时间为8 h。在此基础上,对工艺可行性进行了验证,发现酵母在生长过程中未降低地木耳粗多糖的含量,也未见粗多糖抗氧化活性下降,但显著提了高粗多糖的纯度,表明酵母发酵法具有可行性。
粗多糖的提取方法的报道很多,有酸、碱法,但有些多糖在碱液或酸液中不稳定,容易分解[19],因此所得多糖量要低于实际含量。虽然近年开始使用膜法提取多糖[20],但提取液中蛋白质、氨基酸、微量元素、维生素等有益成分作为提取废液被排放掉,这不仅增加了提取成本,还会造成环境污染。酵母发酵法的原理是酵母在生长过程中不能利用多糖,但能利用还原糖,氨基酸、维生素以及提取液中的蛋白质等进行生长,达到粗多糖的去杂纯化目的,同时,在工业生产中,发酵滤渣还可以用作生产酵母肽、酵母粉、酵母多糖的原料[21-22],有利于降低企业的生产成本和减少环境污染。因此,相比其他提取工艺而言,酵母发酵法提取粗多糖具有独特的优点,为地木耳多糖的提取提供了实验依据。
[1]李敦海,刘永定.近十年中国地木耳研究概况[J].水生生物学报,2003,27(4):408-412.LI Dun-hai,LIU Yong-ding.The past decade’s researches on Nostoc commune vauch in China a review[J].Acta Hydrobiologica Sinica,2003,27(4):408-412.(in Chinese)
[2]范群艳,吴向阳,仰榴青.地木耳的研究进展[J].常熟理工学院学报:自然科学版,2007,21(4):55-59.FAN Qun-yan,WU Xiang-yang,YANG Liu-qing.Research progress of Nostoc commune Vauch[J].Journal of Changshu Institute of Technology:Naturai Sciences,2007,21(4):55-59.(in Chinese)
[3]毕润成,闰桂琴.山西南部地木耳群落特征及其资源分布的研究[J].武汉植物学研究1999,17(3):23-24.BI Run-cheng,YAN Gui-qin.Study on the community feature and resource distribution of Nostoc commune in the southern Shanxi province[J].Journal of Wuhan Botanical Research,1999,17(3):23-24.(in Chinese)
[4]贺宝珍,李义先.地木耳营养价值及利用潜能研究[J].山西大学学报:自然科学版,1991,14(1):93-96.HE Bao-zhen,LI Yi-xian.The study of nutritive and usage of Nostoc commune Vauch[J].Journal of Shanxi University:Natural Science Edition,1991,14(1):93-96.(in Chinese)
[5]李天才,陈桂琛,索有瑞.青海高原地木耳中氨基酸特征与分析[J].氨基酸和生物资源,2004,26(2):6-8.LI Tian-cai,CHEN Gui-chen,SUO You-rui.Characteristic analysis of amino acids of Nostoc commune in Qinghai plateau[J].Amino Acids and Biotic Resources,2004,26(2):6-8.(in Chinese)
[6]阎春兰,邓中洋,胡征宇.人工培养地木耳的群体显微结构及营养成分分析[J].食品科学,2010,31(3):22-26.YAN Chun-lan,DENG Zhong-yang,HU Zheng-yu.Colony structure and nutritional composition analysis of cultivated Nostoc commune Vauch[J].Food science,2010,31(3): 22-26.(in Chinese)
[7]钱森和,厉荣玉,魏明,等.地木耳提取物对几种常见微生物的抑菌研究[J].湖南农业科学,2011,(17):15-17,21.QIAN Sen-he,LI Rong-yu,WEI Ming,et,al.Antimicrobial activities of Nostoc commun extracts on several common microorganisms[J].Hunan Agricultural Sciences,2011,(17):15-17,21.(in Chinese)
[8]范群艳,吴向阳,仰榴青.响应面分析法优化地木耳多糖提取工艺的研究[J].江苏大学学报:医学版,2007,17(3):236-240.FAN Qun-yan,WU Xiang-yang,YANG Liu-qin.Study on extraction of Nostoc commune vauch polysaccharides by response surface methodology[J].Journal of Jiangsu University:Medicine Edition,2007,17(3):236-240.(in Chinese)
[9]李三相,李勃,左国防,等.陆生蓝藻地木耳中海藻糖研究初报[J].天水师范学院学报,2004,24(5):41-43.LI San-xiang,LI Bo,ZUO Guo-fang,et al.Investigation of trehalose in the Nostoc commune Vanch[J].Journal of Tianshui Normal University,2004,24(5):41-43.(in Chinese)
[10]盛家荣,翟春,邓学联.均匀设计法用于提取普通念珠藻粗多糖条件优选的研究[J].广西师院学报:自然科学版,2000,17(2):46-49.SHENG Jia-rong,ZAI Chun,DENG Xue-lian.Application of uniform design to the study of extraction conditions for the crude polysaccharide form Nostoc commune[J].Journal Guangxi Teachers College,2000,17(2):46-49.(in Chinese)
[11]马文杰,郭玉蓉,魏决.地木耳提取液对自由基清除能力的初探[J].食品工业科技,2009,30(4):113-115.MA Wen-jie,GUO Yu-rong,WEI Jue.Preliminary discussions on free radical scavenging capacity of different extracts from Nostoc commune[J].Science and Technology of Food Industry,2009,30(4):113-115.(in Chinese)
[12]汤俊,胡征宇.3种念珠藻多糖对自由基的清除作用[J].武汉植物学研究,2006,24(1):63-66.TANG Jun,HU Zheng-yu.Radical scavenging activities of polysaccharides in three Nostoc species[J].Journal Wuhan Botanical Research,2006,24(1):63-66.(in Chinese)
[13]刘洁,李文香,王文亮,等.生物多糖研究进展[J].山东农业科学,2011,(5):98-101.LIU Jie,LI Wen-xian,WANG Wen-lian.Research progress of biological polysaccharides[J].Shandong Agricultural Sciences,2011,(5):98-101.(in Chinese)
[14]张唐伟,李天才.地木耳多糖的提取工艺研究[J].光谱实验室,2001,28(1):144-148.ZHANG Tang-wei,LI Tian-cai.Optimal extraction conditions on polysaccharide of Nostoc commune Vauch[J].Chinese Journal of Spectroscopy Laboratory,2001,28(1):144-148.(in Chinese)
[15]张水华.食品分析[M].北京:中国轻工业出版社,2004.
[16]张唐伟,杨乐,柳青海,等.地木耳多糖的抗氧化性与抑菌作用[J].食品与生物技术学报,2011,30(6):868-873.ZHANG Tang-wei,YANG Le,LIU Qing-hai,et al.Antioxidant and antimicrobial activaties of Nostoc commune polysaccharides[J].Journal Food Science and Biotechnology,2011,30(6):868-873.(in Chinese)
[17]闫欲晓,粟桂娇.双酶法水解香菇蛋白的工艺研究[J].食品科技,2003,12(3):14-16.YAN Yu-xiao,SU Gui-jiao.Technological study of bi-enzyme hydrolysis on mushroom protein[J].Food Science and Technology,2003,12(3):14-16.(in Chinese)
[18]彭博,林维宣,王玉萍.发酵法提取枸杞中多糖[J].中国酿造,2008,19:53-55.PENG Bo,LIN Wei-xuan,WANG Yu-pin.Extraction of polysaceharide from Medlar by fermentation[J].Chinese Brewing,2008,19:53-55.(in Chinese)
[19]周启升,刘训理,段祖安.植物多糖的研究与开发应用进展[J].蚕业科学,2010,36(3):465-469.ZHOU Qi-sheng,LIU Xun-li,DUAN Zu-an.Progress of research,development and application of plant poly-saccharides[J].Science of Sericulture,2010,36(3):465-469.(in Chinese)
[20]尹军峰,袁海波,谷记平,等.膜法富集茶多糖的初步研究[J].茶叶科学,2006,26(2):108-111.YIN Jun-feng,YUAN Hai-bo,GU Ji-ping,et,al.Study on separation and concentration of tea polysaccharides by membrane system[J].Journal of Tea Science,2006,26(2):108-111.(in Chinese)
[21]赵季,任俊琦,卢彩霞,等.酵母细胞壁多糖的研究进展[J].中国食品添加剂,2009,9:82-85.ZHAO Ji,REN Jun-qi,LU Cai-xia,et,al.Research progress on yeast cell wall polysaccharides[J].China Food Additives,2009,9:82-85.(in Chinese)
[22]邵伟,乐超银,耿颖丽.利用啤酒废酵母酶法制备蛋白肽工艺研究[J].中国酿造,2009,4:194-196.SHAO Wei,YUE Chao-yin,GENG Ying-li.Preparation of yeast promin peptides by alcalase[J].Chinese Brewing,2009,4:194-196.(in Chinese)
