采后硅酸钠处理对杏果粉霉病的抑制及机理
2012-11-09赵宾宾葛永红李颖超
王 毅, 赵宾宾, 毕 阳, 葛永红, 李颖超
(甘肃农业大学 食品科学与工程学院,甘肃 兰州 730070)
我国是杏的原生起源中心之一,其果实风味独特、富有营养和保健功效[1-2]。由于杏果采收时正值高温夏季,加之果实皮薄多汁,易受机械损伤和微生物的侵染而发生腐烂,采后损失颇为严重。化学杀菌剂虽可有效控制杏果的采后病害[3],但由于其存在残留,环境污染及诱导病原物产生抗药性等问题而受到限制[4-5]。因此,寻求更为安全有效的防腐措施已十分紧迫。据报道,硅具有提高植物抗性减轻病害发生的作用[6]。采后硅酸钠处理不仅可以有效抑制厚皮甜瓜的的多种采后病害[7-10],减轻梨采后的黑斑病和青霉病[11-12],以及马铃薯的干腐病[13-14]及柑橘的青霉病[15];还可提高拮抗酵母Cryptococcus laurentii对采后病害的生防能力[16]。但尚未见硅酸钠在杏果实采后病害控制方面的报道。采用硅酸钠处理杏果实,观察处理对果实粉霉病病原物的体内和体外抑制效果,并探讨其部分抑制机理。
1 材料与方法
1.1 材料、试剂与仪器
供试李杏(Prunus armeniaca cv.Lixing):采自甘肃省白银市景泰条山农场,纸箱包装后于采收当日运抵作者所在实验室后在常温(25±2)℃,RH60%~70%下贮藏待用。供试Trichotethium roseum分离自自然发病果实,PDA上保存待用。
硅酸钠(Na2SiO3):天津科密欧化学试剂开发中心产品,分析纯;超净工作台:苏净集团苏州安泰技术有限公司产品;高压灭菌锅:北京广顺科技发展有限公司产品;电热恒温培养箱:上海一恒科技有限公司产品;UV-2550型紫外分光光度计:日本岛津公司产品。
1.2 方法
1.2.1 离体试验 参照李云华方法[12]并做修改。将PDA培养基融化后冷却至45℃,加入用灭菌水配制的硅酸钠溶液,制备成改良的平板PDA培养基,分别含有 0、6.25、12.50、25 mmol/L 的硅酸钠。 待培养基冷却后,将T.roseum菌饼(直径15 mm)接于培养基中央,25℃避光培养。当对照皿中菌体长至培养皿边缘时,测定病斑直径并计算抑菌率。每个处理用9个培养皿,重复3次。
抑菌率 (%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-原菌饼直径)×100%。
1.2.2 果实处理 选择外观整齐,无病虫的果实。配制不同浓度的硅酸钠溶液(0、25、50、75 mmol/L),加质量分数0.01%Tween-80作为表面活性剂,浸泡果实 10 min,取出晾干,在常温(23±2)℃、RH85%~95%条件下贮藏待用。
1.2.3 果实的损伤接种 参照毕阳方法[17]并做修改。以清水处理为对照,在处理后24 h进行接种试验。接种时,先用体积分数70%酒精擦拭果实表面进行消毒,再用灭菌铁钉在果实表面等距离刺孔3个(深3 mm,直径2 mm),1.5 h后用微量移液器向每孔中注入 10 μL (1×106cfu/mL)粉红单端孢(T.roseum)孢子悬浮液。 在常温 (23±2)℃、RH85%~95%条件下贮藏。4 d后利用十字交叉法测量病斑直径。每处理用果10个,重复3次。
1.2.4 硅酸钠对杏果实粉霉病的诱导时效 用1.2.3筛选出的最佳浓度处理果实,并用清水处理做对照。分别于硅酸钠溶液处理后的第24,48,72,96 h,进行损伤接种,方法同1.2.3。于接种4 d后利用十字交叉法测量病斑直径。每处理用果10个,重复3次。
1.2.5 生化指标测定
1)取样 用1.2.3筛选出的最佳浓度处理果实,以清水处理做对照。分别于处理后24,48,72,96 h取果实赤道部位阴阳两侧皮下 3 mm果肉组织或果皮组织,锡箔纸包裹,液氮冷冻后,低温(-80℃)保存待测。每个处理用果实10个,重复3次。
2)过氧化物酶(POD)活性测定 参照李合生[18]的愈创木酚法并修改。酶活性以470 nm处,3 min反应体系光密度的变化0.01为1个活性单位(u),酶活性单位以 U/(g·Fw)表示。
3)多酚氧化酶(PPO)的活性测定 参照 Chen et al[19]方法并作修改。酶活性以每分钟吸光度变化0.01 为 1 个活性单位(u),酶活性单位以 U/(g·Fw)表示。
4)总酚和类黄酮含量的测定 参照Pirie和Mullins的方法测定[20]。1 g果皮组织,与10 mL的1%HCL-甲醇在冰浴条件下充分研磨,然后在8 000 r/min,4℃的条件下离心10 min,取上清液直接用于比色。重复3次。
1.2.6 数据处理 所有实验数据采用Microsoft Excel2003计算标准偏差并作图,并用DPS7.05数据处理系统进行Duncan’s多重差异显著分析。图中竖线代表标准误,相同字母表示差异不显著(P<0.05)。
2 结果与分析
2.1 离体条件下硅酸钠对T.roseum的抑制
离体条件下,硅酸钠可明显抑制T.roseum菌丝的生长,抑制效果随硅酸钠浓度增加而增强。当浓度为25 mmol/L时,处理者120 h后的菌落直径仅为对照的三分之一(图 1(A))。 此外,25 mmol/L处理120 h后抑菌效果也最好,抑菌率可达 85%,其次为 12.5 mmol/L 处理 (图 1(B))。


图1 In vitro条件下不同浓度硅酸钠对粉霉病菌落直径(A)和抑菌率(B)的影响Fig.1 Effect of sodium silicate at different concentrations on colony diameter of T.roseum (A)and its inhibitory rate(B)in vitro
2.2 不同浓度硅酸钠对李杏粉霉病病斑直径和诱导持续时间的影响
硅酸钠处理可有效抑制杏损伤接种T.roseum病斑直径的扩展(图2(A))。随着浓度的增加,抑制效果逐渐增强,当浓度达到50 mmol/L时,处理者的病斑直径低于对照15%。更高浓度处理未进一步提高抑制效果,但也未对果实造成药害。50 mmol/L处理后间隔24,48,72 h损伤接种T.roseum果实的病斑直径均能显著降低,但处理后96 h损伤接种处理果实的病斑直径反而大于对照(图2(B))。由此表明,50 mmol/L硅酸钠处理诱导了杏果实的抗性,且诱导时间可持续72 h。
2.3 硅酸钠处理对果实抗性酶活性的影响
硅酸钠处理明显增强了果实体内的POD和PPO的活性,在处理后96 h内处理与对照的POD和PPO的活性均呈先上升后下降趋势,但其间处理者的活性均高于对照(图3)。处理者得POD和PPO的活性和对照相比均在72 h时差异达到最大,分别高出对照的76%和19%。


图2 不同浓度硅酸钠(A)和50 mmol/L硅酸钠处理间隔不同时间接种(B)对损伤接种果实病斑直径的影响Fig.2 Effecton lesion diameter ofsodium silicate concentration (A)or the time interval between application of odium silicate at 50 mmol/L and wound inoculation with T.roseum(B)in apricot fruit
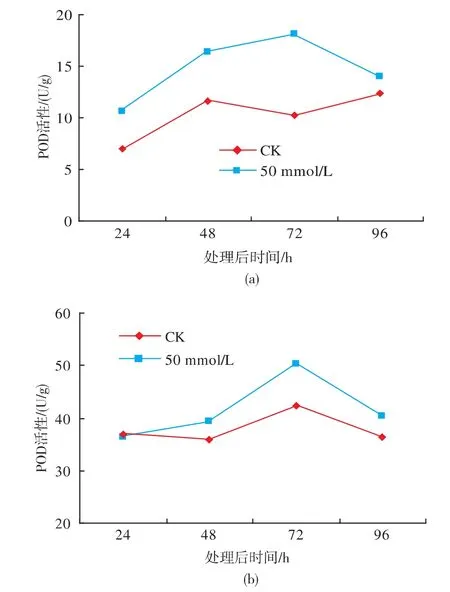
图3 硅酸钠处理对贮藏过程中果实POD(A)和PPO(B)活性的影响Fig.3 Effect of sodium silicate treatment on activities of POD(A)and PPO(B)in apricot fruit
2.4 硅酸钠处理对果实总酚和类黄酮含量的影响
硅酸钠处理可明显提高果实体内总酚的含量,在贮藏过程中,对照和硅酸钠处理的果实总酚含量呈先升高后降低趋势(图4(A))。在第48 h到96 h,处理者的总酚含量均高于对照。在72 h时差异达到最大,约为对照的1.06倍。随着贮藏时间的延长,对照和硅酸钠处理的果实体内类黄酮含量都保持相同的趋势,并且处理的含量始终高于对照,但差异不明显(图 4(B))。

图4 硅酸钠处理对杏果实总酚(A)和类黄酮(B)含量的影响Fig.4 Effect of sodium silicate treatment on the content of total phenolics(A)and flavoniods(B)in apricot fruit
3 结语
研究结果表明,采后硅酸钠处理可以有效减轻杏果实的粉霉病,其作用与硅酸钠直接抑制病原物的生长和诱导果实抗性相关[9]。离体条件下硅酸钠对T.roseum菌落的生长的抑制,与其改变培养基的pH,损害病原物质膜的完整性,导致细胞内一些功能物质泄漏有关[15]。前期试验观察到,硅酸钠可明显碱化培养基的pH,当硅酸钠处理浓度为6.25~25.0 mmol/L时,培养基的pH会由中性猛增至10~11。 在 硅 酸 钠 抑 制 Pencillium.digitatum[15],Alternaria alternata,Fusarium semitectum[9]的 生 长 试验中也观察到类似的结果。
硅酸钠处理后间隔不同时间对果实损伤接种的结果表明,硅酸钠处理诱导了杏果实体内的抗病性,但诱导的效果与处理剂量和处理与损伤接种间隔时间密切相关。据报道,多种防御酶和抗菌物质在产品的抗病性反应中具有积极的作用。POD和PPO活性,以及总酚和类黄酮含量是指示果实抗病性是否被诱导的重要生化指标[21]。POD参与了木质素的合成和酚类物质的聚合[22-23],以及细胞壁的生长和交联化反应[24],从而提高了细胞壁的抗病能力。在寄主-病原物互作中,酚类物质被认为与抗病性密切相关,它可以在PPO的作用下氧化成对病原菌具有很高毒性的醌类物质,直接抑制病原菌对植物的侵染[19,25]。作者研究观察到处理果实的POD、PPO活性及总酚含量增加,表明硅酸钠处理激活了果实体内的抗性生化反应,提高了果实的抗病性。在硅酸钠处理梨的试验中也观察到类似的结果[12]。类黄酮作为植物保卫素,具有抑制真菌孢子萌发、芽管伸长、菌丝生长及毒害菌丝末端细胞的作用[26]。但作者研究未能发现处理果实中有类黄酮的显著积累,可能与硅酸钠处理形成的碱性环境抑制了果实中类黄酮的积累有关[27]。
硅酸钠对杏果实粉霉病的的抑制可能还涉及苯丙烷代谢、活性氧代谢、病程相关蛋白等其它的防卫机制,以及硅在果实表面的机械屏障作用等方面。考虑到硅在地球表面分布的广泛性以及硅处理的安全性,硅处理将有望成为一种新的防腐技术。
[1]张加延,张钊.中国果树志·杏卷[M].北京:中国林业出版社,2003.
[2]项惠丹,许时婴.杏、南瓜、胡萝卜复合果蔬汁的制备[J].食品与生物技术学报,2009,28(3):320-324.XIANG Hui-dan,XU Shi-ying.Preparation of compound beverage of apricot,carrot and pumpkin[J].Journal of Food Science and Biotechnology,2009,28(3):320-324.(in Chinese)
[3]陈富,赵成纲.低温条件下单果包膜和戴挫霉浸泡处理对兰州大接杏贮藏性的影响[J].甘肃农业科技,2003,(3):34-36 CHEN Fu,ZHAO Cheng-gang.Effect of individual film wrapping and imazalil treatment on storage property of lanzhou apricot at low temperature[J].Gansu Agricultural Science and Technology,2003,(3):34-36.(in Chinese)
[4]BI Yang,LI Yong-cai,GE Yong-hong,et al.Induced resistance in melons by elicitors for the control of postharvest diseases[J].In:Prusky D; Gullino M L (eds.),Postharvest Pathology,Springer,2009,31-42.
[5]KUCK,K-H,GISI U.FRAC mode of action classification and resistance risk of fungicides.In:Kramer,W,Schirmer U (Eds.),Modern Crop Protection Compounds.Wiley-VCH Verlag GmbH&Co.KGaA,Weinheim,Germany,2007,415-432.
[6]Fauteux F,Rémus-Borel W,Menzies JG,et al.Silicon and plant disease resistance against pathogenic fungi[J].FEMS Microbiology Letters,2005,249(1):1-6.
[7]郭玉蓉,毕阳,曹孜义.硅剂处理对‘玉金香’甜瓜红霉病的抑制[J].园艺学报,2003,30(5):586-588.GUO Yu-rong,BI Yang,CAO Zi-yi.Inhibiting muskmelon pink mold rot of cantaloupe ‘Yujinxiang’ treated with silicon agents[J].Acta Horticulturae Sinica,2003,30(5):586-588.(in Chinese )
[8]GUO Yu-rong,LIU Lei,ZHAO Jian,et al.Use of silicon oxide and sodium silicate for controlling Trichothecium roseum postharvest rot in Chinese cantaloupe (Cucumis melo L.)[J].International Journal of Food Science and Technology,2007,42:1012-1018.
[9]BI Yang,TIAN Shiping,GUO Yurong,et al.Sodium silicate reduces postharvest decay on Hami melons:induced resistance and fungistatic effects[J].Plant Disease,2006,90(3):279-283.
[10]LI Wen-hao,BI Yang,GE Yong-hong,et al.Effects of postharvest sodium silicate treatment on pink rot disease and oxidative stress-antioxidative system in muskmelon fruit[J].European Food Research and Technology,2012,234(1):137-145.
[11]郭玉蓉,葛永红,毕阳,等.采后硅酸钠处理对苹果梨黑斑病的影响[J].食品科学,2003,24(12):140-142.GUO Yu-rong,GE Yong-hong,BI Yang,et al.Effect of postharvest sodium silicate treatment on alternaria rot of pingguoli[J].Journal of Food Science,2003,24(12):140-142.(in Chinese)
[12]李云华,毕阳,张怀予,等.采后硅酸钠处理对苹果梨青霉病的抑制[J].甘肃农业大学学报,2008,43(6):150-153.LI Yun-hua,BI Yang,ZHANG Huai-yu,et al.Inhibiting effect of postharvest sodium silicate treatment on blue mold of pear(cv.Pingguoli)[J].Journal of Gansu Agricultural University,2008,43(6):150-153.(in Chinese)
[13]盛占武,毕阳,鄯晋晓,等.采后硅酸钠处理对马铃薯干腐病的抑制[J].食品工业科技,2007,28(9):190-191.SHENG Zhan-wu,BI Yang,SHAN Jin-xiao,er al.Effect of postharvest sodium silicate treatment on dry rot of potato[J].Science and Technology of Food Industry,2007,28(9):190-191.(in Chinese)
[14]LI Yong-cai,BI Yang,GE Yong-hong,et al.Antifungal activity of sodium silicate on Fusarium sulphureum and its effect on dry rot of potato tubers[J].Journal of Food Science,2009,74(5):213-218.
[15]LIU Jia,ZONG Yuan-yuan,QIN Guozheng,et al.Plasma membrane damage contributes to antifungal activity of silicon against Penicillium digitatum[J].Current Microbiology,2010,61:274-279.
[16]QIN Guo-zheng,TIAN Shi-ping.Enhancement of biocontrol activity of Cryptococcus laurentii by silicon and the possible mechanisms involved[J].Phytopathology,2005,95:69-75.
[17]毕阳,张维一.感病甜瓜果实的呼吸,乙烯及过氧化物酶变化的研究[J].植物病理学报,1993,23:69-73 BI Yang,ZHANG Wei-yi.On changes of respiratory rate,ethylene evolution and peroxidase activity of the infection melon[J].Acta Phytopathologica Sinica,1993,23:69-73.(in Chinese)
[18]李合生.植物生理生化实验原理和技术[M].高等教育出版社,2000.
[19]CHEN C,Belanger R R,Benhamou N,et al.Defense enzymes induced in cucumber roots by treatment with plant growthpromoting rhizobacteria (PGPR)and Pythium aphanidermatum[J].Physiological and Molecular Plant Pathology,2000,56:13-23.
[20]Pirie A,Mullins M G.Changes in anthocyanin and phenolic content of grapevine leaf and fruit tissue treated with sucrose,nitrate and abscisic acid[J].Plant Physiology,1976,58:468-472.
[21]李红霞,毕阳,伍利芬,等.采后热水处理对苹果青霉病抗性的诱导[J].食品工业科技,2010,11:329-331.LI Hong-xia,BI Yang,WU Li-fen,et al.Post-harvest hot water treatment induces resistance against Penicillium expansum in peat fruit[J].Science and Technology of Food Industry,2010,11:329-331.(in Chinese)
[22]Graham M Y,Graham T L.Rapid accumulation of anionic peroxidases and phenolic polymers in soybean cotyledon tissues following treatment with Phytophthora megasperma f.sp.glycinea wall glucan[J].Plant Physiology,1991,97:1445-1455.
[23]TAKAHARNA U,ONIKI T.Regulation of peroxidase-dependent oxidation of phenolics in the apoplast of spinach leaves by ascorbate[J].Plant and Cell Physiology,1992,33:379-387.
[24]Brownleader M,Ahmed N,Trevan M,et al.Purification and partial characterization of tomato extension peroxidase[J].Plant Physiology,1995,109:1115-1123.
[25]Nicholson R L,Hammerschmidt R.Phenolic compounds and their role in disease resistance[J].Annual Review of Phytopathology,1992,30:369-389.
[26]Shadle G L,Wesley S V,Korth K L,et al.Phenylpropanoid compounds and disease resistance in transgenic tobacco with altered expression of L-phenylalanine ammonialyase[J].Phytochemistry,2003,64:153-161.
[27]赵艳,李昂,徐茂军.前处理刺激采摘后芦笋中类黄酮积累的研究[J].食品研究与开发,2006.27(7):42-44.ZHAO Yan,LI Ang,XU Mao-jun.Study on the flavonoids accumulation in harvested asparagus by pretreatment stimulation[J].Food Research and Development,2006,27(7):42-44.(in Chinese)
