甲醇-乙腈-l-丁基-3-甲基咪唑四氟硼酸盐三组分物系的汽液平衡
2012-11-09李群生王海川冉晓萌付永泉王宝华
李群生, 王海川,冉晓萌,朱 炜,付永泉,王宝华
(1. 北京化工大学 化学工程学院,北京 100029;2. 北京中医药大学 中药学院,北京 100102)
甲醇-乙腈-l-丁基-3-甲基咪唑四氟硼酸盐三组分物系的汽液平衡
李群生1, 王海川1,冉晓萌2,朱 炜1,付永泉1,王宝华2
(1. 北京化工大学 化学工程学院,北京 100029;2. 北京中医药大学 中药学院,北京 100102)
在101.32 kPa下,用CE - 2型Othmer汽液平衡釜测定了甲醇 - 乙腈 - l - 丁基 - 3 - 甲基咪唑四氟硼酸盐([bmim]BF4)三组分物系的等压汽液平衡数据;采用UNIFAC方程对实验数据进行了关联。实验结果表明,与未加入 [bmim]BF4相比,加入[bmim]BF4后甲醇 - 乙腈二组分物系的汽液平衡线产生偏离,[bmim]BF4含量越高,偏离程度越大;[bmim]BF4具有明显的盐析效应,当[bmim]BF4的含量为10%(x)时,甲醇-乙腈物系的共沸点消失;UNIFAC方程可用于预测甲醇 - 乙腈 - [bmim]BF4三组分物系的汽液平衡。
甲醇;乙腈;l-丁基-3-甲基咪唑四氟硼酸盐;汽液平衡;离子液体;UNIFAC方程
萃取精馏被广泛应用于分离共沸物或沸点相近的混合物。传统的萃取剂大多为有机溶剂,萃取精馏过程的能耗较大,与“绿色化学”理念相悖。而无机盐萃取剂,则会腐蚀塔板、堵塞管道和磨损精馏设备。而作为在常温下呈熔盐态的离子液体,由于具有蒸汽压极低、无毒和无腐蚀性等独特性质,因而有望作为萃取剂在特殊精馏中取代传统的萃取剂[1-3]。国内外许多学者已经开始研究将离子液体作为萃取剂应用于萃取精馏[4-6]。
乙腈和甲醇的混合物在精细化学品和药物生产中被广泛用做溶剂,也被用于液相色谱的分离过程[7-11]。由于乙腈和甲醇的混合物在常压下可形成共沸物,采用普通的精馏方法难以分离,萃取精馏则为分离该物系提供了一种可能。
本工作以离子液体为萃取剂,在101.32 kPa下测定了甲醇-乙腈-l-丁基-3-甲基咪唑四氟硼酸盐([bmim]BF4)三组分物系的汽液平衡数据,并采用UNIFAC方程对实验数据进行了关联,讨论了离子液体[bmim]BF4对甲醇-乙腈物系相对挥发度的影响。
1 实验部分
1.1 试剂
甲醇、乙腈:纯度大于99.5%,北京化工厂;[bmim]BF4:纯度大于98%,上海成捷化学有限公司。
1.2 实验方法
采用北洋化工实验设备有限公司CE-2型Othmer汽液平衡釜进行汽液平衡测定[12-14]。
采用称重法配制试样。将70 mL试样加入到平衡釜中加热至沸腾。平衡室温度恒定不变时达到平衡,保持约30 min;然后采用微量进样器分别直接从汽相、液相取样口取样分析,取样间隔约15 min。
1.3 分析方法
采用北京京科瑞达SP6890型气相色谱仪分析试样的组成,10%(w)PEG-20000填充柱(3 m×0.3 mm),载气(氢气)流量45 mL/min,柱温323.15 K,气化室温度423.15 K,TCD检测,检测温度 453.15 K,采用面积归一化法定量。
2 结果与讨论
2.1 实验装置的验证
为了测试实验装置的可靠性,用Othmer汽液平衡釜测定了101.32 kPa下甲醇-乙腈二组分物系的汽液平衡数据,实验值与文献值[15]吻合很好,说明该实验装置是可靠的。
2.2 汽液平衡数据
101.32 kPa下甲醇-乙腈-[bmim]BF4三组分物系的等压汽液平衡数据见表1。
2.3 数据关联
由于离子液体为近些年发展起来的新型溶剂,对于它的一些热力学参数还不是很明确。目前还没有专门的用于关联和预测含离子液体物系汽液平衡数据的过量自由焓的模型,因此使用UNIFAC方程对实验数据进行关联。UNIFAC方程中基团的表面参数(Qk)和体积参数(Rk)取自文献[3]。

表 1 101.32 kPa下甲醇(1)-乙腈(2)-[bmim]BF4 (3)三组分物系的等压汽液平衡数据Fig. 1 Isobaric vapor-liquid equilibrium data for methanol(1)-acetonitrile(2)-[bmim]BF4 (3) ternary system at 101.32 kPa

目标函数ARD达到最小,来确定UNIFAC方程二组分交互作用参数,关联得到的UNIFAC方程二组分交互作用参数见表2。所关联出的活度系数的计算值与实验值的ARD对于二组分中的组分为2.02%,对于三组分中的组分为2.43%。在允许的范围内,说明模型选用合理。

表 2 UNIFAC 方程的二组分交互作用参数ann和amnTable 2 Binary interaction parameters anm and amn in the UNIFAC equation
2.4 讨论
甲醇-乙腈-[bmim]BF4三组分物系的等压汽液平衡曲线见图1。由图1可见,随[bmim]BF4含量的增加,气相组分中甲醇的含量在低浓度区有微小的降低,而在高浓度区甲醇的含量则增加;与未加[bmim]BF4相比,加入[bmim]BF4后甲醇-乙腈二组分物系的汽液平衡线发生偏离,并且随[bmim]BF4含量的增大,汽液平衡线的偏离程度愈大;尤其当[bmim]BF4的含量为10%(x)时,消除了甲醇-乙腈二组分物系的共沸点。这表明[bmim]BF4对甲醇具有盐析效应,在甲醇-乙腈物系的萃取精馏中具有很大的应用潜力。
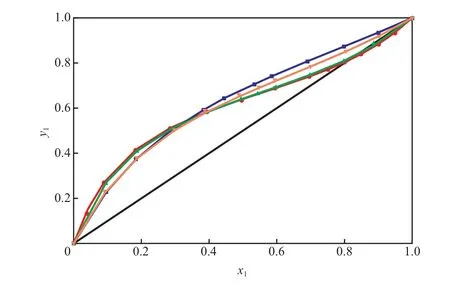
图 1 甲醇(1)-乙腈(2)- [bmim]BF4(3)三组分物系的等压汽液平衡曲线(101.32 kPa)Fig. 1 Isobaric vapor-liquid equilibrium curves of methanol(1)- acetonitrile(2)- [bmim]BF4 (3) ternary system at 101.32 kPa.

[bmim]BF4对甲醇-乙腈相对挥发度的影响见图2。由图2可知,随 [bmim]BF4含量的增加,甲醇与乙腈的相对挥发度在高浓度区逐渐提高,且[bmim]BF4的含量越高,相对挥发度提高的幅度越大,这意味着精馏过程更容易进行。
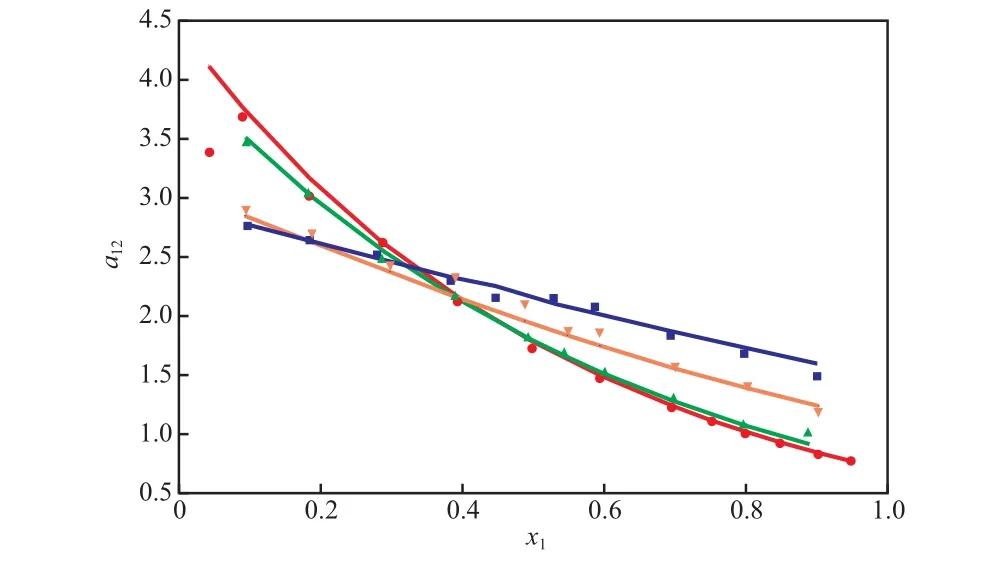
图 2 [bmim]BF4对甲醇(1)-乙腈(2)相对挥发度的影响(101.32 kPa)Fig. 2 The effect of [bmim]BF4 on the relative volatility of methanol(1) to acetonitrile(2) at 101.32 kPa.

对于甲醇-乙腈物系,甲醇和乙腈都属于极性物质,且乙腈的极性要大于甲醇的极性。当极性的离子液体加入该体系后,它会和极性较强的乙腈更容易发生作用,即乙腈分子会受到离子的“绑定”,自由甲醇分子的数量增加,使自由甲醇分子与乙腈分子的比值增大,产生过饱和现象,使得过量的甲醇从乙腈中析出,因而产生了盐析效应。随离子液体含量的增加,离子对乙腈分子的“绑定”作用增强,使甲醇的过饱和程度加重,因而盐析效应越发明显,甲醇与乙腈的相对挥发度即越高,因此气相中甲醇的含量逐渐增加。
由图1和图2还可看出,实验值和UNIFAC方程的预测值大部分吻合,这说明UNIFAC方程可以很好地预测含离子液体物系的汽液平衡,可用于萃取精馏的工艺设计。
3 结论
(1)在101.32 kPa下,测定了[bmim]BF4含量(x)分别为1%, 10%, 20%时的甲醇-乙腈-[bmim]BF4三组分物系的汽液平衡数据。
(2)利用UNIFAC方程对实验数据进行了关联,活度系数的计算值与实验值的偏差为2.43%,UNIFAC方程可用来预测含离子液体物系的汽液平衡。
(3)在甲醇-乙腈物系中加入[bmim]BF4,提高了甲醇与乙腈的相对挥发度,当[bmim]BF4的含量为10%(x)时,该物系的共沸点消失。
[1]Lei Zhigang,Li Chenyue,Chen Biaohua. Extractive Distillation: A Review[J].Separ Purif Rev,2003,32(2):121-213.
[2]Lei Zhigang,Chen Biaohua,Ding Zhongwei. Special Distillation Processes[M]. Amsterdam:Elsevier,2005:59 - 89.
[3]Lei Zhigang,Zhang Jiguo,Li Qunsheng,et al. UNIFAC Model for Ionic Liquids[J].Ind Eng Chem Res,2009,48(5):2697 - 2704.
[4]Yi Li,Wang Lisheng,Li Miyi,et al. Activity Coef fi cients at Infinite Dilution of Organic Solutes in 1-Decyl-3-Methylimidazolium Tetra fl uoroborate Using Gas-Liquid Chromatography[J].J Chem Eng Data,2011,56 (4):1704 - 1708.
[5]Cai Jialin,Cui Xianbao,Zhang Ying,et al. Vapor-Liquid Equilibrium and Liquid-Liquid Equilibrium of Methyl Acetate +Methanol + 1-Butyl-3-Methylimidazolium Acetate[J].J Chem Eng Data,2011,56(2):282 - 287.
[6]Boussaha M,Khimeche K,Dahmani A. Activity Coef fi cients at In fi nite Dilution for Hydrocarbons in Fatty Alcohols Determined by Gas-Liquid Chromatography[J].J Chem Eng Data,2011,56(4):850 - 858.
[7]Klesele H. Puri fi cation of Acetonitrile[J].Anal Chem, 1980,52(13):2230 - 2232.
[8]Reimers J,Hall L. The Solvation of Acetonitrile[J].J Am Chem Soc,1999,121(15):3730 - 3744.
[9]Bishop R, Denton W. Hydrocarbon Azeotropes with Acetonitrile[J].Ind Eng Chem,1950,42(5):883 - 885.
[10]Nikam P,Shirsat L,Hasan M. Density and Viscosity Studies of Binary Mixtures of Acetonitrile with Methanol,Ethanol, Propan-1-ol, Propan-2-ol, Butan-1-ol, 2-M-ethylpropan-1-ol,and 2-Methylpropan-2-ol at(298.15,303.15, 308.15,and 313.15)K[J].J Chem Eng Data,1998,43(5):732 - 737.
[11]Tomashefski J,Barrios R,Sudilovsky O. Acetonitrile-Based Solvents: Their Application in Thin-Layer Chromatography of Cyclic Nucleotides,Nucleosides,Purine,and Pyrimidines[J].Anal Biochem,1974,60(2):589 - 595.
[12]李群生,朱久娟,张继国,等.乙酸乙酯-乙醇-1-乙基-3-甲基四氟硼酸咪唑盐物系等压汽液平衡数据的测定[J].石油化工,2008,37( 8):810 - 814.
[13]李群生,黄小侨,张继国,等.乙酸乙酯-乙醇-1-辛基-3-甲基咪唑四氟硼酸盐物系汽液平衡数据的测定[J].石油化工,2009,38( 11):1211 - 1214.
[14]李群生,Magtuf Zuhir,朱炜,等. 甲醇-苯-l-辛基-3-甲基咪唑四氟硼酸盐物系汽液平衡的测定[J].石油化工,2011,40( 5):541 - 544.
[15]Tamir A,Wisniak J. Liquid-Vapor Equilibria at 760 mmHg in the Systems Methanol-Acetonitrile and Acetonitrile-Propyl Bromide[J].J Chem Eng Data, 1986, 31(3):363 - 364.
Vapor-Liquid Equilibrium for Methanol-Acetonitrile-1-Butyl-3-Methylimidazolium Tetrafluoroborate Ternary System
Li Qunsheng1,Wang Haichuan1,Ran Xiaomeng2,Zhu Wei1,Fu Yongquan1,Wang Baohua2
(1. College of Chemical Engineering,Beijing University of Chemical Technology,Beijing 100029,China;2. College of Chinese Pharmacology,Beijing University of Chinese Medicine and Pharmacology,Beijing 100102,China)
Isobaric vapor-liquid equilibrium for methanol-acetonitrile-1-butyl-3-methylimidazolium tetrafluoroborate ([bmim]BF4) ternary system was measured at 101.32 kPa using CE-2 Othmer vapor-liquid equilibrium still. UNIFAC equations were used to correlate the experimental data. The experimental results indicated that the vapor-liquid equilibrium curves of the methanol-acetonitrile-[bmim]BF4system deviated from that of the [bmim]BF4-free system and the deviation increased with the increase of the [bmim]BF4dosage. The ionic liquid [bmim]BF4exhibited notable salt-out effect which could enhance the relative volatility. When the mole fraction of [bmim]BF4amounted to 10%,the azeotropic point disappeared. UNIFAC equation can be used to predict the equilibrium of methanolacetonitrile- [bmim]BF4system.
methanol;acetonitrile;1-butyl-3-methylimidazolium tetra fl uoroborate;vapor-liquid equilibrium;ionic liquid;UNIFAC equation
1000 - 8144(2012)02 - 0177 - 04
TQ 013.1
A
2011 - 08 - 20;[修改稿日期]2011 - 10 - 24。
李群生(1963—),男,河北省邢台市人,博士,教授。联系人:王宝华,电话 13699292775,电邮 wbaohual@163.com。
国家自然科学基金资助项目(20476005);国家科技支撑计划课题子课题(2006BA109B07-01)。
(编辑 李治泉)
