洛伐他汀诱导人子宫内膜癌JEC细胞G1期同步化的研究*
2012-11-06沈慧敏李小毛杨越波王小韵
沈慧敏, 李小毛, 杨越波, 王小韵
(中山大学附属第三医院妇产科,广东 广州 510630)
1000-4718(2012)05-0791-05
2011-12-08
2012-03-15
国家自然科学基金资助项目(No. 30772332);广东省自然科学基金资助项目(No. 7001568);广东省科技计划(No.2011B031800056)
△通讯作者 Tel: 020-85252259; E-mail: tigerlee777@163.com
洛伐他汀诱导人子宫内膜癌JEC细胞G1期同步化的研究*
沈慧敏, 李小毛△, 杨越波, 王小韵
(中山大学附属第三医院妇产科,广东 广州 510630)
目的探讨洛伐他汀(Lov)诱导人子宫内膜癌JEC细胞G1期同步化的方法及JEC细胞解除G1期同步化后的细胞周期进程。方法CCK-8法测定JEC细胞的倍增时间,采用10 μmol/L、20 μmol/L、30 μmol/L和40 μmol/L的Lov,作用1×细胞倍增时间进行流式细胞术检测G1期细胞的比例,获得G1期同步化的最佳Lov浓度;采用最佳浓度作用JEC细胞,于作用后的0.5×倍增时间~2×倍增时间内,每隔4 h检测同步化程度,获得最佳浓度Lov作用下的最佳同步化时间;解除G1期同步化,每隔4 h检测一次,研究JEC细胞解除G1期同步化后的细胞周期进程。结果CCK-8法检测显示JEC细胞的倍增时间约为24 h;JEC细胞的最佳G1期同步化条件为:20 μmol/L Lov作用24 h,可获取G1期细胞(85.00±0.79)%;JEC细胞于解除G1期同步化后16 h,获得最大量的S期细胞,为(45.28±0.53)%;同时G1期细胞比例达到最低,为(35.93±0.44)%。结论20 μmol/L Lov作用24 h,可获得大量G1期细胞;解除G1期同步化后16 h,S期细胞比例最高,G1期细胞比例达到最低,达到满意的G1期同步化释放后效果。
洛伐他汀; JEC细胞; 细胞周期; G1期同步化
肿瘤被认为是一类细胞周期性疾病[1-2],肿瘤发生的本质可能是细胞周期调节失控,细胞呈自主、不受控、无限制增殖。肿瘤细胞周期的研究是目前肿瘤分子生物学研究中的热点。在进行细胞周期研究时通常需要使用细胞同步化的方法获得大量处于同一细胞周期时相的细胞。而根据研究需要细胞群所处细胞周期时相的不同,细胞同步化又分为G0/G1期同步化、G1期同步化、G2期同步化、M期同步化和S期同步化。各细胞周期时相同步化又有多种方法可供选择,如需将细胞同步化于G0/G1期,可采用血清饥饿法、氨基酸饥饿法;如需将细胞同步化于G1期,多采用洛伐他汀(lovastatin,Lov)或含羞草碱诱导等方法;如需将细胞同步化于S期,多采用胸腺嘧啶核苷阻滞法。
目前,国内外对子宫内膜癌细胞的同步化研究尚不多见,本研究以人子宫内膜癌细胞系JEC细胞为实验细胞株,探讨Lov诱导JEC细胞G1期同步化的效率及获取最佳G1期同步化效果的洛伐他汀作用浓度和作用时间,并进一步探讨JEC细胞解除G1期同步化后的细胞周期进程,为研究子宫内膜癌发生发展中的细胞周期调控机制提供实验依据。
材 料 和 方 法
1材料
人子宫内膜癌细胞JEC为本室保存。细胞培养基低糖DMEM和胎牛血清(fetal bovine serum, FBS)均为Gibco产品。胰酶为吉诺生物产品。洛伐他汀、甲羟戊酸(mevalonic acid, MVA)、碘化丙啶(propidium iodide, PI)和核糖核酸酶A (ribonuclease A, RNase A)均为Sigma产品。Cell Counting Kit-8(CCK-8)为同仁化学研究所产品。FACSCalibur流式细胞仪为Becton Dickinson产品。
2方法
2.1细胞培养 人子宫内膜癌细胞JEC为贴壁生长细胞,接种于含10% FBS的低糖DMEM培养基中,37℃、5% CO2恒温培养箱培养。
2.2CCK-8法测细胞倍增时间 取培养的JEC细胞进行消化、离心、重悬、计数。以含10% FBS的低糖DMEM为培养基,按每孔3 000个细胞接种到96孔细胞培养板,分6组,每组设5个复孔。接种后将96孔板置于37 ℃、5%CO2恒温培养箱培养。在接种后经培养24 h(计为基点0 h)、40 h(计为16 h),之后每隔2~4 h加入CCK-8,置于37 ℃、5%CO2恒温培养箱孵育2 h后上酶标仪检测吸光度(A)值(检测波长:490 nm;参比波长:630 nm),并依据测得的A值调整检测时间间隔,直至A值升至基点时A值的2倍,此时的时间间隔即为该细胞的倍增时间。
2.3Lov诱导G1期同步化处理 参照文献[3]Lov诱导细胞G1期同步化方法,稍加改进,具体操作步骤如下:取培养的JEC细胞进行消化、离心、重悬、计数,以含10% FBS的低糖DMEM为培养基,按每孔5×105个细胞接种到6孔细胞培养板,分为4组,每组设3个复孔,接种后将6孔板置于37℃、5%CO2恒温培养箱培养24 h,4组细胞分别给予10 μmol/L、20 μmol/L、30 μmol/L和40 μmol/L Lov作用1×细胞倍增时间,收集细胞进行流式分析细胞周期情况,选取将JEC细胞同步于G1期百分比最高的Lov浓度,即为G1期同步化最佳Lov浓度;再按上述步骤接种JEC细胞于6孔板中,每组设3个复孔,均加入上述最佳G1期同步化浓度的Lov于培养基中,作用0.5×细胞倍增时间~2×细胞倍增时间,每隔4 h收集细胞进行流式检测分析细胞周期情况,选取在最佳Lov浓度下,将细胞同步于G1期百分比最高的作用时间,即为最佳Lov浓度下G1期同步化的最佳时间。
2.4解除G1期同步化处理 按方法2.3所述步骤接种JEC细胞于6孔板中,每组设3个复孔,均加入上述最佳G1期同步化浓度的Lov于培养基中作用最佳时间后,吸弃上述含Lov的培养液,PBS洗3次,再加入含MVA(浓度为100倍上述最佳Lov浓度)的培养基,置于37 ℃、5% CO2恒温培养箱培养≥1×细胞倍增时间,每隔4 h收集细胞进行流式检测细胞周期。
2.5流式细胞仪检测细胞周期 0.25%胰酶消化细胞,收集于离心管中,1 000 r/min离心4 min,弃上清液,PBS洗涤细胞,1 000 r/min离心4 min,弃上清液,加入70%乙醇1 mL,悬浮细胞,固定过夜,检测时1 000 r/min离心5 min,弃上清液,加入PBS洗涤1次,1 000 r/min离心5 min,弃上清液,加入0.5% RNase A 50 μL,混匀,加入450 μL PI染液,避光处2~8 ℃放置30 min,上流式细胞仪检测。
3统计学处理
结 果
1CCK-8法测JEC细胞倍增时间
JEC细胞经培养0 h(即基点)、16 h、20 h、22 h、24 h和28 h后,其A值分别为:0.3778、0.5829、0.6670、0.6970、0.7423和0.7691。24 h的A值较基点A值增长了1倍,提示JEC细胞的倍增时间约为24 h。
2Lov诱导JEC细胞G1期同步化
2.1G1期同步化最佳Lov浓度 4组JEC细胞分别经10 μmol/L、20 μmol/L、30 μmol/L和40 μmol/L Lov作用24 h后,G1期细胞的比例分别为:(81.13±0.70)%、(85.00±0.79)%、(82.62±0.73)%和(82.93±0.56)%,见图1、2。20 μmol/L Lov作用24 h组G1期细胞达到(85.00±0.79)%,较10 μmol/L、30 μmol/L和40 μmol/L Lov作用24 h组为高,差异有统计学意义(P<0.05),提示Lov诱导JEC细胞G1期同步化的最佳浓度为20 μmol/L。

Figure 1. Effect of different concentrations of lovastatin (Lov) for 24 h on cell cycle of JEC cells. A: 10 μmol/L Lov;B: 20 μmol/L Lov;C: 30 μmol/L Lov;D: 40 μmol/L Lov.
图1不同浓度洛伐他汀作用JEC细胞24h对细胞周期的影响


图2不同浓度洛伐他汀作用JEC细胞24hG1期细胞的比例
2.2最佳Lov浓度下G1期同步化最佳作用时间 JEC细胞分为10组,每组均加入20 μmol/L Lov,作用12 h、16 h、20 h、24 h、28 h、32 h、36 h、40 h、44 h和48 h后G1期细胞的比例分别为:(70.43±1.21)%、(75.46±1.13)%、(82.45±1.09)%、(85.00±0.79)%、(83.02±0.44)%、(80.68±0.45)%、(67.60
±0.62)%、(55.57±0.53)%、(47.78±1.80)%、(50.39±2.12)%,见图3、4。JEC细胞经20 μmol/L Lov作用24 h组达到G1期最大同步化,G1期细胞占(85.00±0.79)%,较20 μmol/L Lov作用12 h、16 h、20 h、28 h、32 h、36 h、40 h、44 h和48 h组为高,差异有统计学意义(P<0.05),提示JEC细胞Lov诱导G1期同步化的最佳条件为:20 μmol/L Lov作用24 h。
3JEC细胞解除G1期同步化后细胞周期进程
JEC细胞分为8组,每组均采用20 μmol/L Lov同步化作用24 h后,再加入2 mmol/L MVA解除G1期同步化,结果显示:JEC细胞解除G1期同步化后16 h G1期细胞占比达到最低,为(35.93±0.44)%,与其它7组(解除G1期同步化后4 h、8 h、12 h、20 h、24 h、28 h和32 h组)比较,差异有统计学意义(P<0.05);解除G1期同步化16 h后,S期细胞占比达到最高,为(45.28±0.53)%,与其它7组(解除G1期同步化后4 h、8 h、12 h、20 h、24 h、28 h和32 h组)比较,差异有统计学意义(P<0.05),见表1和图5、6。

Figure 3. Effect of 20 μmol/L lovastatin for different durations on cell cycle of JEC cells. A: 12 h;B: 16 h;C: 20 h;D: 24 h;E: 28 h;F: 32 h;G: 36 h;H: 40 h;I: 44 h;J: 48 h.
图320μmol/L洛伐他汀作用不同时间后对JEC细胞周期的影响


图420μmol/L洛伐他汀作用JEC细胞不同时间后G1期细胞的比例
表1JEC细胞解除G1期同步化后细胞周期进程
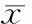

GroupG1SG2/M4h76.09±0.5914.45±0.809.46±0.228h67.96±0.2617.57±0.3714.47±0.2212h51.46±1.2732.21±1.1416.33±0.3716h35.93±0.44*45.28±0.53*18.79±0.8720h37.62±0.9939.72±0.9722.66±0.8724h55.91±0.8922.89±0.7121.20±1.4128h72.83±1.6616.36±1.0610.81±1.4032h76.33±1.0017.73±2.145.94±1.15
*P<0.05vsother groups.

Figure 5. Cell cycle progress of JEC cells desynchronized for different durations after induced by 20 μmol/L lovastatin for 24 h.A: 4 h; B: 8 h; C: 12 h; D: 16 h; E: 20 h; F: 24 h; G: 28 h; H: 32 h.
图520μmol/L洛伐他汀作用24h对JEC细胞解除G1期同步化的影响


图620μmol/L洛伐他汀作用JEC细胞24h后释放不同时间的细胞周期进程
讨 论
洛伐他汀抑制HMG-CoA还原酶,导致甲羟戊酸缺乏,而甲羟戊酸是胆固醇合成的前体物质,也是p21和Ras的底物异戊烯化所必需的[4]。洛伐他汀能阻滞大部分贴壁细胞和悬浮细胞于G1早期且具有如下优点[3,5]:(1)洛伐他汀的同步化作用对细胞无毒性且可逆,通过加入甲羟戊酸即可消除其作用;(2)洛伐他汀同步化时由于不缺乏营养物质与生长因子,不会导致细胞代谢失衡;(3)可以获取大量同步化的G1期细胞;(4)同步化效率与细胞种类、细胞接种密度、培养基的类型无关;(5)可以重复进行同步化。Wu等[6]研究发现用5 μmol/L洛伐他汀作用32 h可使CHO细胞获得90%的G1期细胞;另有学者研究发现分别用10 μmol/L和20 μmol/L的洛伐他汀作用乳腺癌M6和MCF-1细胞24 h和33 h,可分别获得78%和77%~96%的G1期细胞[7-8];用10 μmol/L洛伐他汀分别作用24 h和24~48 h可使前列腺癌Pr14和PC-3-M细胞获得82%和68%~90%的G1期细胞[7,9];用30 μmol/L洛伐他汀干扰膀胱癌T-24细胞可获得80% G1期细胞,对肺癌Calu-1细胞则可获得70%~90%的G1期细胞[10-11];还可作用于HL-60、T47D、HELA和U2-OS细胞,获得较理想的G1期同步化效应[12-17]。在本实验中使用洛伐他汀对子宫内膜癌JEC细胞进行G1期同步化,首先测定JEC细胞的倍增时间为24 h,符合进行细胞周期同步化的条件,参照Keyomarsi等[5]的洛伐他汀诱导细胞G1期同步化方法,改进如下:先测定JEC细胞G1期同步化的最佳洛伐他汀浓度,我们采用4个浓度梯度:10 μmol/L、20 μmol/L、30 μmol/L和40 μmol/L洛伐他汀,作用1×细胞倍增时间即24 h,发现JEC细胞获得最大G1期同步化效率的洛伐他汀作用浓度为20 μmol/L,此时细胞G1期同步化的程度为(85.00±0.79)%,即为最佳G1期同步化浓度;接下来研究获得最佳同步化的洛伐他汀作用时间,采用上述的最佳浓度作用于JEC细胞,于作用后的0.5×倍增时间~2×倍增时间内,每隔4 h检测同步化程度,发现JEC细胞在上述最佳浓度洛伐他汀作用下的最佳同步化时间为24 h,此时G1期同步化的程度为(85.00±0.79)%,得到满意的同步化效率,由此得出JEC细胞的最佳G1期同步化条件为:20 μmol/L Lov作用24 h。与文献比较,本实验采用洛伐他汀不同浓度梯度结合不同时间间隔取样的同步化方法,更有利于精确地确定洛伐他汀对所研究细胞进行G1期同步化所能达到的最大效率。再对JEC细胞进行解除G1期同步化后细胞进程进行研究,发现JEC细胞于释放后16 h,获得最大量的S期细胞,为(45.28±0.53)%;同时G1期细胞比例达到最低,为(35.93±0.44)%,达到满意的G1期同步化释放后效果,可用于开展相关实验研究。
[1] Sherr CJ. Cancer cell cycle [J]. Science, 1996, 274(5293): 1672-1677.
[2] Evan GI, Vouaden KH. Proliferation cell cycle and apoptosis in cancer [J]. Nature, 2001, 411(6835): 342-348.
[3] Javanmoghadam-Kamrani S, Keyomarsi K. Synchronization of the cell cycle using lovastatin [J]. Cell Cycle, 2008, 7(15): 2434-2440.
[4] Wejde J, Carlberg M, Hjertman M, et al. Isoprenoid regulation of cell growth: Identification of mevalonate-labelled compounds inducing DNA synthesis in human breast cancer cells depleted of serum and mevalonate [J]. J Cell Physiol, 1993, 155(3): 539-548.
[5] Keyomarsi K, Sandoval L, Band V, et al. Synchronization of tumor and normal cells from G1to multiple cell cycles by lovastatin [J]. Cancer Res, 1991, 51(13): 3602-3609.
[6] Wu JR, Gilbert DM. Lovastatin arrests CHO cells between the origin decision point and the restriction point [J]. FEBS Lett, 2000, 484(2): 108-112.
[7] Shibata MA, Kavanaugh C, Shibata E, et al. Comparative effects of lovastatin on mammary and prostate oncogenesis in transgenic mouse models [J]. Carcinogenesis, 2003, 24(3): 453-459.
[8] Robertson KD, Keyomarsi K, Gonzales FA, et al. Differential mRNA expression of the human DNA methyltransferases (DNMTs) 1, 3a and 3b during the G0/G1to S phase transition in normal and tumor cells [J]. Nucleic Acids Res, 2000, 28(10): 2108-2113.
[9] Park C, Lee I, Kang WK. Lovastatin-induced E2F-1 modulation and its effect on prostate cancer cell death [J]. Carcinogenesis, 2001, 22(10): 1727-1731.
[10]Vogt A, Sun J, Qian Y, et al. The geranylgeranyltransferase-I inhibitor GGTI-298 arrests human tumor cells in G0/G1and induces p21WAF1/CIP1/SDI1in a p53-independent manner [J]. J Biol Chem, 1997, 272(43): 27224-27229.
[11]Jakobisiak M, Bruno S, Skierski JS, et al. Cell cycle-specific effects of lovastatin [J]. Proc Natl Acad Sci USA, 1991, 88(9): 3628-3632.
[12]Jurchott K, Bergmann S, Stein U, et al. YB-1 as a cell cycle-regulated transcription factor facilitating cyclin A and cyclin B1 gene expression [J]. J Biol Chem, 2003, 278(30): 27988-27996.
[13]Kishi S, Wulf G, Nakamura M, et al. Telomeric protein Pin2/TRF1 induces mitotic entry and apoptosis in cells with short telomeres and is downregulated in human breast tumors [J]. Oncogene, 2001, 20(12): 1497-1508.
[14]Ma HT, Poon RY. Synchronization of HeLa cells[J]. Methods Mol Biol, 2011, 761: 151-161.
[15]Reimers K, Antoine M, Zapatka M, et al. NoBP, a nuclear fibroblast growth factor 3 binding protein, is cell cycle regulated and promotes cell growth [J]. Mol Cell Biol, 2001, 21(15): 4996-5007.
[16]Audic Y, Hartley RS. Post-transcriptional regulation in cancer [J]. Biol Cell, 2004, 96(7): 479-498.
[17]Cooper S. Reappraisal of G1-phase arrest and synchronization by lovastatin[J]. Cell Biol Int, 2002, 26(8): 715-727.
Lovastatin-inducedG1phasesynchronizationinhumanendometrialcancerJECcells
SHEN Hui-min, LI Xiao-mao, YANG Yue-bo, WANG Xiao-yun
(DepartmentofObstetricsandGynecology,TheThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China.E-mail:tigerlee777@163.com)
AIM: To investigate the method of inducing G1phase synchronization in human endometrial cancer JEC Cells by lovastatin and the cell cycle progress of JEC cells after desynchronization.METHODSThe doubling time of JEC cells was detected by Cell Counting Kit-8 (CCK-8) assay. To determine the best lovastatin concentrations for G1synchronization, JEC cells were treated with lovastatin at concentrations of 10, 20, 30 and 40 μmol/L for 1× doubling time, and the cell cycle was detected using flow cytometry (FCM). To determine the best period of lovastatin treatment to achieve G1synchronization, JEC cells were treated with lovastatin at the best concentration for 0.5× to 2× doubling time, and the cell cycle was detected every 4 h using FCM. Furthermore, the cell cycle progress of JEC cells after desynchronization was also observed.RESULTSThe doubling time of JEC cells was almost 24 h. Treatment with lovastatin at the concentration of 20 μmol/L for 24 h achieved maximum G1arrest [(85.00±0.79)%]in JEC cells. Minimum G1phase [(35.93±0.44)%]and maximum S phase [(45.28±0.53)%] were observed after desynchronization for 16 h.CONCLUSIONMaximum G1synchronization of JEC cells is induced by lovastatin at the concentration of 20 μmol/L for 24 h. The JEC cells show minimum G1phase and maximum S phase after desynchronization for 16 h.
Lovastatin; JEC cells; Cell cycle; G1phase synchronization
R363
A
10.3969/j.issn.1000-4718.2012.05.004
