急性心肌缺氧对乳鼠心肌细胞脑钠尿肽表达的影响及其作用机制*
2012-11-06夏文静黄艺仪何建桂陈艺莉
夏文静, 黄艺仪, 何建桂, 陈艺莉
(中山大学附属第一医院 1心内科,2急诊科,广东 广州 510080)
1000-4718(2012)05-0852-06
2011-09-01
2012-03-14
广东省科学技术厅科研项目(No. 2010B031600065)
△通讯作者 Tel: 020-87755766-8140; E-mail: hejiangui19640114@163.com
▲并列第1作者
急性心肌缺氧对乳鼠心肌细胞脑钠尿肽表达的影响及其作用机制*
夏文静1▲, 黄艺仪2▲, 何建桂1△, 陈艺莉1
(中山大学附属第一医院1心内科,2急诊科,广东 广州 510080)
目的观察急性缺氧损伤对乳鼠心肌细胞脑钠尿肽(BNP)表达水平的影响并探讨其可能作用机制。方法原代乳鼠心肌细胞缺氧、无糖、无血清培养以模拟心肌缺血损伤,利用CCK-8法测细胞存活率、ELISA法测白细胞介素-6(IL-6)和BNP的表达;以IL-6直接干预体外培养的心肌细胞, 采用RT-PCR、Western blotting和ELISA方法观察BNP、转化生长因子β1(TGF-β1)、Smad2 mRNA的转录和蛋白的表达。结果缺氧显著上调IL-6和BNP的表达,且两者呈线性正相关;IL-6直接干预可剂量和时间依赖性地上调心肌细胞BNP的mRNA和蛋白表达水平,同时TGF-β1和Smad2的表达水平亦增加;而针对TGF-β1的中和抗体能够部分地抑制由IL-6引起的BNP表达增加。结论急性心肌缺氧可直接上调BNP的表达水平,这种调节效应与TGF-β1/Smad2信号通路上调有关。
缺氧; 钠尿肽,脑; 白细胞介素-6; 转化生长因子β; Smad2通路
由于其重要的生物学效应和标志物价值,脑钠尿肽(brain natriuretic peptide,BNP)近年来受到越来越多的关注。既往研究报道,在充血性心力衰竭等病理经过中,BNP合成受心肌细胞张力影响;细胞张力已被证实是BNP合成和释放的主要调节因子和血流动力学指标[1]。然而,无心力衰竭的心血管疾病患者,如急性心肌缺氧[2]和急性冠脉综合症[3],无论左心室射血功能正常与否,也表现出BNP水平升高,其调节机制不明。
de Bold等[4]证实在心脏移植排斥反应中,被激活的T淋巴细胞产生如肿瘤坏死因子α和白细胞介素-1(interleukin-1,IL-1)的炎症因子,可选择性上调BNP的分泌;多项研究亦报道,急性心肌梗死的患者[5]和接受冠状动脉前降支结扎以重复心肌梗死模型的大鼠[6],血浆中升高的IL-6水平与升高的BNP呈相关性。既往研究已证实心肌缺血、心肌梗死等病理经过有炎症反应和各种炎症因子的参与[7],但炎症反应是否参与心肌缺血时BNP的合成调节尚未见报道。
转化生长因子β1(transforming growth factor β1,TGF-β1)是一种源于血小板的、多种器官表达的炎症因子,参与调节炎症反应、细胞增殖等;Smad蛋白是其下游重要的信号因子[8]。我们的前期研究已证实TGF-β1/Smad2信号通路在BNP改善心肌梗死后心室重塑中发挥重要作用[9],但其是否参与BNP合成过程尚未见相关报道。本研究旨在通过建立缺氧损伤的细胞模型,观察无细胞张力影响缺氧是否直接影响BNP合成水平并且炎症反应是否参与该过程;通过IL-6干预实验探讨急性心肌缺氧时BNP合成的调节机制和相关信号通路。
材 料 和 方 法
1材料
1.1动物 清洁级Sprague-Dawley(SD)大鼠,雌雄不限,1~2 d龄,由中山大学实验动物中心提供,许可证号为SCXK(粤)2004-0011。
1.2主要试剂 Cell Counting Kit-8(CCK-8)试剂盒(Dojindo); BNP ELISA试剂盒(R&D Systems);IL-6 ELISA试剂盒(ExCell Biology);重组大鼠IL-6(PeproTech);TGF-β1中和抗体(Sigma);Trizol reagent(Invitrogen);逆转录试剂盒(TaKaRa Biotechnology) ;One-Step RT-PCR试剂盒(TaKaRa Biotechnology) TGF-β1抗体(Santa Cruz Biotechnology);Smad2抗体(Cell Signal Technology);GAPDH抗体(Cell Signal Technology);其它生化试剂均为进口分装或者国产分析纯。
1.3主要器材 酶标仪(Tecan Sunrise);紫外凝胶检测和成像系统(Bio-Rad);PCR仪(MT Research);NIH图像处理系统。
2方法
2.1原代心肌细胞培养 出生1~2 d的SD乳鼠消毒,取心室肌,以D-Hanks液洗去血污,剪碎为1 mm×1 mm×1 mm大小组织块,清洗;加入5倍组织体积的0.125%胰酶,37 ℃静置消化10 min,清洗后取沉淀;加入5倍组织体积的0.01%Ⅰ型胶原酶,37 ℃振荡消化150 min,以含10%胎牛血清的DMEM-F12培养基终止消化,吹打制细胞悬液直到组织块消失;800 r/min、4℃离心10 min,弃上清,重复2~3次;以含10%胎牛血清的DMEM-F12培养基悬浮细胞,经200目筛网过滤去除杂质。按差速贴壁分离法37 ℃、5%CO2孵育50~60 min,纯化心肌细胞。细胞计数,以1×106密度接种于6孔板或以5×105密度接种于96孔板,37 ℃、5%CO2条件下培养。加入0.1 mmol/L BrdU以抑制成纤维细胞生长,接种4~6 h后细胞开始贴壁,接种18~24 h出现有规律的细胞搏动。
2.2模拟心肌缺氧模型 细胞预先以不含血清的DMEM-F12培养基饥饿24 h。对于缺氧组,参考文献[10],将高纯度氮气通入无糖的平衡盐溶液(118 mmol/L NaCl, 24 mmol/L NaHCO3,16 mmol/L KCl, 1.0 mmol/L KH2PO4, 2.5 mmol/L CaCl2, 1.2 mmol/L MgCl2, 0.5 mmol/L Na-EDTA, 20 mmol/L 乳酸钠, pH 6.4) 30 min,以驱除氧气;将细胞换以氮气饱和的平衡盐溶液,置于可密封的缺氧盒中,先将含95%氮气和5%二氧化碳的混合气通入盒内5~10 min赶走盒内空气,再持续充入混合气15~20 min,密封缺氧盒并置于37 ℃条件下培养模拟缺氧环境。对于对照组,换以无血清的DMEM-F12培养基,置于37 ℃、5%CO2条件下培养。
2.3CCK-8法检测细胞存活率 按照试剂盒说明书处理细胞,450 nm作为检测波长,650 nm作为校正波长。细胞存活率计算公式为:[处理组吸光度(A)值-空白孔A值]/(对照组A值-空白孔A值)。
2.4ELISA法检测BNP和IL-6水平 按照试剂盒说明书处理细胞,450 nm作为检测波长,630 nm作为校正波长。
2.5IL-6干预细胞 细胞预先以不含血清的DMEM-F12培养基饥饿24 h。以不同浓度IL-6(5、25和100 μg/L)干预细胞24 h;以IL-6(5 μg/L)干预细胞不同时间(12、24和48 h);预先以不同浓度中和抗体(10、40和50 mg/L)处理细胞,1 h后再加入IL-6(5 μg/L)干预细胞24 h。
2.6RT-PCR检测BNP、TGF-β1和Smad2 mRNA表达 收集细胞,采用Trizol法抽提总RNA,核酸测定仪测A260/A280,要求在1.8~2.0之间。按照试剂盒说明书采用随机引物进行逆转录合成cDNA。采用One-step RT-PCR(TaKaRa)扩增目的基因,引物的序列见表1。以β-actin为内参照。扩增条件为:BNP和TGF-β1,首次循环95 ℃ 5 min,随后进行33次循环:95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,最后72 ℃ 5 min;Smad2和β-actin, 首次循环95 ℃ 5 min,随后进行32次循环:95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,最后72 ℃ 5min。PCR产物分析:取9 μL产物进行3%琼脂糖凝胶电泳,在凝胶成像系统下拍照,分别用BNP、TGF-β1、Smad2和β-actin扩增条带的面积比评定其mRNA水平。
表1BNP、TGF-β1、Smad2和β-actin的引物序列
Table 1. Primer sequences of BNP,TGF-β1,Smad2 and β-actin used for RT-PCR

GenenamePrimersequenceProduct(bp) BNPForward:5-GGGCTGTGACGGCTGAGGT-3256Reverse:5-AGTTTGTGCTGGAGATAGA-3TGF-β1Forward:5-GATGCCGTTCCGAGGCAGAT-3299Reverse:5-CCTGAGACGTCAGCAAGACAG-3Smad2Forward:5-ACTATACCCACTCCATTCCA-3388Reverse:5-CACTATCACTTAGGCACTCG-3β-actinForward:5-CCTTCCGTGATGGAAGGCT-3207Reverse:5-GCAGCAGATCATCGTGATCT-3
2.7Western blotting检测TGF-β1和Smad2蛋白表达 取处理的心肌细胞,冻PBS液洗涤后加入细胞裂解液,冰上裂解30 min。刮细胞并提取含细胞碎片的裂解液,4 ℃、12 000 r/min离心10 min,取上清液进行蛋白浓度测定。取30μg蛋白,进行15% SDS-PAGE电泳,然后65 V 2.5 h转印至硝酸纤维素膜上。该膜在含10%脱脂奶粉的封闭液中室温封闭1 h,TBST缓冲液洗膜后,加入TGF-β1抗体(1∶500)、Smad2抗体(1∶1 000) 4 ℃孵育过夜。洗膜后加入辣根过氧化物酶标记的IgG抗体(1∶5 000)室温孵育1 h。洗膜后ECL试剂显影。以GAPDH(1∶1 000) 抗体作为内参照。
3统计学处理

结 果
1缺氧处理降低乳鼠心肌细胞存活率
CCK-8法检测结果显示,缺氧2 h、3 h、4 h、5 h和6 h处理的乳鼠心肌细胞活性为95.36% ± 3.61%、74.81% ± 4.43%、52.21% ± 5.34%、41.00% ± 4.92%和26.37% ± 3.56%,缺氧处理后细胞活性随处理时间延长而下降(P<0.01),见图1。这表明所建细胞模型可有效模拟急性心肌缺氧损伤。

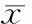
图1缺氧处理降低乳鼠心肌细胞存活率
2缺氧处理增加乳鼠心肌细胞培养上清IL-6和BNP含量
ELISA法检测结果显示,缺氧2 h、3 h、4 h、5 h和6 h处理的乳鼠心肌细胞上清液中IL-6和BNP含量均显著高于对照组,与缺氧处理时间相关,且BNP含量与IL-6表达呈线性正相关(P<0.01),见图2。

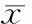
图2缺氧处理增加乳鼠心肌细胞分泌IL-6和BNP
3IL-6干预上调乳鼠心肌细胞BNPmRNA和蛋白表达水平
与对照组相比,IL-6干预组乳鼠心肌细胞BNP mRNA和蛋白的表达水平显著增加(P<0.01),见图3,且这种增加呈现剂量和时间依赖性。


图3Il-6干预上调乳鼠心肌细胞BNPmRNA和蛋白表达水平
4IL-6干预上调乳鼠心肌细胞TGF-β1和Smad2mRNA和蛋白表达水平
与对照组相比,IL-6干预组乳鼠心肌细胞TGF-β1和Smad2 mRNA和蛋白的表达水平亦显著增加(P<0.01),见图4,且这种增加呈现剂量和时间依赖性。
5TGF-β1中和抗体可部分抑制IL-6引起的BNP表达上调
10 mg/L非特异性抑制TGF-β1活性的中和抗体可部分抑制IL-6诱导的BNP mRNA和蛋白表达增加(P<0.01);增加中和抗体浓度并不能完全抑制BNP的增加,抗体浓度在40 mg/L已达到最大抑制效应,见图5。

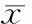
图4IL-6干预上调乳鼠心肌细胞TGF-β1和Smad2mRNA和蛋白表达水平
讨 论
本研究发现,除了影响细胞张力,缺氧亦可使BNP表达增加;由炎症因子IL-6介导的这种调节效应与TGF-β1/Smad2通路上调有关。
炎症反应是许多疾病包括急性心肌缺血的共同病理经过,炎症因子对疾病发生发展的作用不可忽视。在这些炎症因子中,有些促进炎症反应和动脉粥样硬化的发展,如IL-6;有些具有抗炎和保护心肌的效应,如TGF-β1。促炎因子与抗炎因子的生物学效应相互拮抗、相互协调,在生理状态和可逆转的病理经过中维持动态平衡;而不可逆的病理过程中这种平衡被打破,机体即出现功能障碍[11]。
Yamauchi-Takihara等[12]已报道,缺氧、缺氧/复氧刺激均可诱导心肌细胞合成IL-6。Hermonat等[13]研究认为,缺血/再灌注损伤中TGF-β1表达增加是机体减轻组织损伤、提高局部心肌存活率的保护机制。Aukrust等[14]报道充血性心力衰竭的患者,血浆中促炎因子IL-6和肿瘤坏死因子(tumor necrosis factor-α,TNF-α)增加,抗炎因子IL-10和TGF-β1下降,且炎症因子水平的改变程度与患者心功能相关;TGF-β1水平显著下降因而心衰患者失去了抗炎因子介导的心脏保护效应。

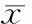
图5中和抗体可部分抑制IL-6干预引起的BNP表达上调
在本研究中,缺氧处理2~6 h,心肌细胞上清液中IL-6和BNP含量显著高于对照组,且与处理时间呈正相关;而IL-6处理的心肌细胞BNP、TGF-β1和Smad2表达呈剂量和时间依赖性增加,与既往研究结果一致。我们认为,缺氧刺激下IL-6的产生是机体应对缺氧损伤的炎症反应的一部分,而由IL-6导致的TGF-β1和BNP水平上调是反馈调节,亦是一种心肌保护机制。众所周知,IL-6作为一种重要的促炎因子,通过与多种因子如IL-1、TNF-α的相互作用,参与冠状动脉粥样硬化的基本病理经过,促进心肌缺血、心肌梗死至充血性心力衰竭的发生和发展[15];而TGF-β1作为一种抗炎因子,参与多种生物学效应的调节,包括炎症反应、脂质代谢、细胞分化和纤维化,并通过拮抗促炎因子的生物学效应减轻缺血/再灌注病理过程中的心肌损伤[16];BNP不仅发挥利钠、利尿、舒张血管、抗纤维化、抑制肾素和醛固酮释放的生物学效应,我们的前期研究亦发现BNP可改善心梗后的心肌肥厚和心室重塑[9]。因而有理由认为急性心肌缺氧时TGF-β1和BNP的增加可拮抗由IL-6介导的炎症反应,减轻缺氧引起的心肌组织损伤。
以往研究认为BNP表达主要受细胞张力调节,故而BNP水平仅作为心力衰竭诊断的标志物[17]。结合本研究,我们相信急性心肌缺氧时,炎症反应中产生的IL-6可直接上调BNP的表达,因而BNP水平增高亦可作为急性心肌缺氧的临床诊断标志物。BNP合成机制的研究为其临床应用的拓展提供了实验依据。
[1] Alter P, Rupp H, Rominger MB, et al. B-type natriuretic peptide and wall stress in dilated human heart[J]. Mol Cell Biochem, 2008, 314(1-2):179-191.
[2] Wiersma JJ, van der Zee PM, van Straalen JP, et al. NT-pro-BNP is associated with inducible myocardial ischemia in mildly symptomatic type 2 diabetic patients[J]. Int J Cardiol, 2010, 145(2):295-296.
[3] Palazzuoli A, Maisel A, Caputo M, et al. B-type natriuretic peptide levels predict extent and severity of coronary disease in non-ST elevation coronary syndromes and normal left ventricular systolic function[J]. Requl Pept, 2011, 167(1):129-133.
[4] de Bold AJ. Cardiac natriuretic peptides gene expression and secretion in inflammation[J]. J Investig Med, 2009, 57(1):29-32.
[5] Kanda T, Inoue M, Kotajima N, et al. Circulating interleukin-6 and interleukin-6 receptors in patients with acute and recent myocardial infarction[J]. Cardiology, 2000, 93(3):191-196.
[6] Guerra MS, Roncon-Albuquerque RJr, Lourenco AP, et al. Remote myocardium gene expression after 30 and 120 min of ischemia in the rat[J]. Exp Physiol, 2006, 91(2):473-480.
[7] Deten A, Volz HC, Briest W, et al. Cardiac cytokine expression is upregulated in acute phase after myocardial infarction.Experimental studies in rats[J]. Cardiovasc Res, 2002, 55(2):329-340.
[8] Bujak M, Frangogiannis NG. The role of TGF-β signaling in myocardial infarction and cardiac remodeling[J]. Cardiovasc Res, 2007, 74(2):184-195.
[9] He J, Chen Y, Huang Y,et al. Effect of long-term B-type natriuretic peptide treatment on left ventricular remodeling and function after myocardial infarction in rats[J]. Eur J Pharmacol, 2009, 602(1):132-137.
[10]Regula KM, Ens K, Kirshenbaum LA. Inducible expression of BNIP3 provokes mitochondrial defects and hypoxia-mediated cell death of ventricular myocytes[J]. Circ Res, 2002, 91(3):226-231.
[11]Tedqui A, Mallat Z. Anti-inflammatory mechanisms in the vascular wall[J]. Circ Res, 2001, 88(9):877-887.
[12]Yamauchi-Takihara K, Ihara Y, Ogata A, et al. Hypoxic stress induces cardiac myocyte-derived interleukin-6[J]. Circulation, 1995, 91(5):1520-1524.
[13]Hermonat PL, Li D, Yang B, et al. Mechanisms of action and delivery possibilities for TGFβ1in the treatment of myocardial ischemia[J]. Cardiovasc Res, 2007, 74(2):235-243.
[14]Aukrust P, Ueland T, Lien E, et al. Cytokine network in congestive heart failure secondary to ischemic or idiopathic dilated cardiomyopathy[J]. Am J Cardiol, 1999, 83(3):376-382.
[15]McGlinchey PG, Spence MS, Patterson CC, et al. Cytokine gene polymorphisms in ischaemic heart disease: investigation using family-based tests of association[J]. J Mol Med, 2004, 82(11):756-761.
[16]Pradier O, Gerard C, Delvaux A, et al. Interluekin-10 inhibits the induction of monocyte coagulant activity by bacterial lipopolysaccharide[J]. Eur J Immunol, 1993, 23(10):2700-2703.
[17]Federico C. Natriuretic peptide system and cardiovascular disease[J]. Heart Views, 2010, 11(1):10-15.
Effectofacutehypoxiaonexpressionofbrainnatriureticpeptideinneonatalratcardiomyocytes
XIA Wen-jing1, HUANG Yi-yi2, HE Jian-gui1, CHEN Yi-li1
(1DepartmentofCardiology,2DepartmentofEmergency,TheFirstAffiliatedHospitalofSunYat-senUniversity,Guangzhou510080,China.E-mail:hejiangui19640114@163.com)
AIM: To explore the influence of acute myocardial hypoxia on the expression of brain natriuretic peptide (BNP) in neonatal rat cardiomyocytes.METHODSTo establish a model of simulated hypoxia injury, the primarily cultured neonatal rat cardiomyocytes were incubated under the condition of hypoxia in glucose-free balanced salt solution plus serum deprivation. The cell survival rate was analyzed by Cell Counting Kit-8 (CCK-8) and the levels of interleukin-6 (IL-6) and BNP were determined by enzyme-linked immunosorbent assay (ELISA). The transcriptional and translational levels of BNP, transforming growth factor β1(TGF-β1) and Smad2 in cardiomyocytes with IL-6 stimulation were determined by RT-PCR, Western blotting and ELISA.RESULTSExposure of the neonatal cardiomyocytes to an oxygen-deficient environment notably increased IL-6 and BNP secretion, and BNP expression was positively correlated with IL-6 expression. Stimulation of the neonatal cardiomyocytes with IL-6 caused time- and dose-dependent up-regulation of transcriptional and translational levels of BNP. This process was accompanied with the up-regulation of TGF-β1/Smad2. Inhibition of TGF-β1activity using a neutralizing antibody partially suppressed the IL-6-stimulated increase in BNP expression.CONCLUSIONAcute myocardial hypoxia directly up-regulates the expression of BNP, which is associated with the up-regulation of TGF-β1/Smad2 signal pathway.
Hypoxia; Natriuretic peptide,brain; Interleukin-6; Transforming growth factor beta; Smad2 pathway
R541.4
A
10.3969/j.issn.1000-4718.2012.05.015
