Rapsyn对正常及实验性自身免疫性重症肌无力小鼠乙酰胆碱受体的作用*
2012-11-06周瑞瑞滕银燕
付 裕, 刘 红, 周瑞瑞, 滕银燕, 张 旭
(温州医学院附属第一医院神经内科,浙江 温州 325000)
1000-4718(2012)03-0533-05
2011-09-13
2012-01-16
浙江省科技厅基金资助项目(No.2006C33008)
△通讯作者 Tel:0577-88841324;E-mail:drzhangxu@gmail.com
Rapsyn对正常及实验性自身免疫性重症肌无力小鼠乙酰胆碱受体的作用*
付 裕, 刘 红, 周瑞瑞, 滕银燕, 张 旭△
(温州医学院附属第一医院神经内科,浙江 温州 325000)
目的探讨突触后膜乙酰胆碱受体缔合蛋白(rapsyn)对正常小鼠及实验性自身免疫性重症肌无力(EAMG)小鼠肌肉组织内乙酰胆碱受体(AChR)的作用。方法将扩增的pcDNA-rapsyn质粒注入小鼠左后肢,右后肢相同部位注射等量生理盐水,2周后将实验小鼠随机分为E组和C组,E组经腹腔注射AchR单克隆抗体35 (mAb35)诱导EAMG动物模型,C组经腹腔注射相同剂量的生理盐水,模型诱导48 h后处死实验动物分离双侧后肢肌肉,注射pcDNA-rapsyn质粒的左后肢肌肉分别为LE组和LC组,注射生理盐水的右后肢肌肉分别为RE组和RC组。免疫荧光染色法观察突触后膜AChR与运动终板的结合情况,RT-PCR和Western blotting法检测AChRα mRNA和蛋白表达情况。结果结果表明,LC组与RC组相比AChRα蛋白表达量增多(P<0.05),LE组与RE组相比AChRα蛋白表达量增多(P<0.05); LC组与RC组相比AChRα mRNA表达变化无统计学意义(P>0.05),LE组与RE组相比AChRα mRNA表达有明显降低(P<0.01)。结论在肌肉组织内上调rapsyn蛋白的表达对正常及EAMG小鼠AChR受体发挥保护性作用。
重症肌无力,实验性自身免疫性; 受体,乙酰胆碱; Rapsyn
重症肌无力(myasthenia gravis, MG)是由乙酰胆碱受体抗体(acetylcholine receptor antibody,AChRAb)破坏突触后膜运动终板上的乙酰胆碱受体(AChR),导致AChR分子大量丢失,出现肌无力症状的自身免疫性疾病,位于神经肌肉接头处的N型乙酰胆碱受体(nAChR)作为自身抗原诱发了这一病理反应[1]。通过被动输注AChRAb可建立实验性自身免疫性重症肌无力(experimental autoimmune myasghenia gravis, EAMG)动物模型,该模型起病迅速,发病率高且易于评估,免疫病理学显示AChR被特异性破坏,是进一步研究人类MG的理想工具。mAb35是AChR 的一种单克隆抗体,成分为大鼠IgG1,可直接作用于多种品系AChR α亚单位主要免疫区肽段,是建立EAMG被动转移模型的理想抗体[2]。乙酰胆碱受体相关蛋白(acetylcholine receptor-associated protein at synapse,rapsyn)是一种分子量大小为43 kD的细胞骨架蛋白,对AChR起簇集和锚定作用,将AChR聚集在神经肌肉接头局部[3]。本实验通过预先给小鼠体外注射表达rapsyn蛋白的质粒,然后用被动转移法诱导EAMG小鼠模型,通过对相应指标的评价,探讨上调rapsyn蛋白的表达对正常小鼠及EAMG小鼠AChR的作用。
材 料 和 方 法
1材料
1.1动物 雌性C57BL/6小鼠,36只,6~8周龄,14~16 g,由上海斯莱克实验动物有限公司提供,健康清洁级环境下饲养。
1.2主要试剂 TIB-175杂交瘤细胞(ATCC),质粒大量抽提试剂盒、Trizol试剂(Invitrogen),DMEM培养基、胎牛血清(Gibco),四甲基罗丹明标记的α银环蛇毒(TMR-α-BTX,Sigma),抗-rapsyn mAb 1234(Abcam),GAPDH抗体、异硫氰酸荧光素(FITC)标记的山羊抗小鼠IgG、辣根过氧化物酶(HRP)标记山羊抗大鼠IgG(碧云天公司), 逆转录试剂盒、蛋白质分子量标准(Formentas), DNA标准分子量(Tiangen)。
1.3主要仪器 培养细菌用摇床(Forma Scientific),台式高速离心机(Beckman),低温高速离心机(Eppendorf),荧光显微镜(Olympus), 超净工作台(苏州安泰),培养细胞用温箱(Thermo forma),方波刺激器(Grass),电泳仪、PCR基因扩增仪(Bio-Rad)。
2方法
2.1质粒的制备 将本实验室保存的pcDNA-rapsyn质粒转化的保种菌液冰上复苏,取10 μL铺氨苄青霉素抗性的LB平板,37 ℃温箱培养过夜,挑取单克隆菌落接种到2 mL LB液体培养基中,37 ℃振摇16 h(37 ℃,250 r/min)。取100 μL过夜振摇菌液接种到300 mL LB液体培养基中,37 ℃振摇16 h(37 ℃,250 r/min)扩大培养质粒。按Invitrogen质粒大量抽提试剂盒说明书抽提纯化质粒,紫外分光分度计测质粒浓度(2 g/L),-80 ℃冻存备用。
2.2抗体的制备 TIB-175杂交瘤细胞株可分泌mAb35,在含10%胎牛血清的DMEM培养基中培养,收集细胞培养上清液,45%的硫酸铵盐析,4 ℃冰箱中PBS透析过夜,制成40倍浓缩抗体,-20 ℃冻存备用。
2.3pcDNA-rapsyn质粒的转移 36只小鼠,于左后肢胫骨前肌和腓肠肌分8~10点注射pcDNA-rapsyn质粒10 μL(2 g/L),右后肢相应部位注射等量生理盐水。注射5 min后用方波刺激器刺激注射部位肌肉,电压为200 V/cm肌肉厚度,频率1 Hz,刺激4次,每次20 ms,交换电极后以相同的频率、强度、时间刺激。
2.4EAMG动物模型的建立及评估 质粒转移2周后,36只小鼠随机分为E组和C组,每组18只,E组小鼠腹腔注射0.5 mL经40倍浓缩杂交瘤细胞培养上清液,C组小鼠腹腔注射等量生理盐水。模型诱导后每8 h测量小鼠体质量,并观察动物毛色、步态及摄食情况。通过体重减低、临床症状的严重程度及30 s抓握和悬吊实验后肌力减低进行临床评分:0级:无临床症状,正常肌力;1级:3~5次抓握和悬吊实验后肌力减弱,叫声低,易疲劳;2级:头部下垂,弓背姿势,前爪屈曲,步态蹒跚,后肢不完全瘫痪;3级:后肢瘫痪无法站立,哭叫无声;4级:濒死状态。症状居中间者分别评为0.5、1.5、2.5和3.5级。模型诱导48 h后处死各组实验动物,分离双侧后肢胫骨前肌和腓肠肌,注射pcDNA-rapsyn质粒的左后肢肌肉组织分别为LE组和LC组,注射生理盐水的右后肢肌肉组织分别为RE组和RC组。
2.5免疫荧光染色 分离各组小鼠胫骨前肌,4%多聚甲醛4 ℃冰箱固定过夜,常规脱水、浸蜡、包埋,做4 μm石蜡切片。切片常规二甲苯脱蜡,梯度乙醇脱水,甲醇新鲜配制的0.3%H2O2中灭活内源性过氧化物酶15 min,0.01 mol/L枸橼酸盐缓冲液(pH=6.0)中煮沸15~20 min进行抗原修复,PBS洗10 min×3次,1%BSA封闭液37 ℃温浴30 min;切片滴加Ⅰ抗anti-rapsyn mAb 1234(1∶500)4 ℃孵育过夜,含0.3%Triton X-100的PBS振荡洗涤10 min×3次,滴加TMR标记α-BTX(10 mg/L),FITC标记山羊抗小鼠IgG(1∶200),37 ℃孵育1 h,PBS洗10 min×3次,缓冲甘油封片,荧光显微镜下观察。
2.6RT-PCR Trizol试剂提取各组肌肉组织总RNA,紫外分光光度计定量后,取2 μg RNA反转录合成cDNA,以cDNA为模板进行PCR扩增。设计和合成引物:应用Primer 5.0软件分别设计上、下游引物,并由上海生工生物工程有限公司合成。AChRα上游引物5’-CCTCCACCTATGGGCTTTC-3’,下游引物5’-TCCTCAGCGGCGTTATTG-3’,产物长度125 bp;内参照GAPDH上游引物5’-GGTGAAGGTCGGTGAACG-3’,下游引物5’-CTCGCTCCTGGAAGATGGTG-3’,产物长度233 bp。 PCR扩增循环条件:先94 ℃预变性5 min,94 ℃变性30 s,退火30 s(AChRα退火温度为53 ℃,GAPDH退火温度为56 ℃),72 ℃延伸1 min,共35个循环,最后72 ℃终末延伸10 min,4 ℃保持。取PCR扩增产物各5 μL进行2%琼脂糖凝胶电泳,Bio-Rad凝胶成像系统扫描,Quantity One软件分析各条带吸光度值,以同一标本扩增的GAPDH为内参照,测定PCR产物条带和GAPDH内参照条带的密度比值作为目的基因相对表达量。
2.7Western blotting 取各组肌肉组织,液氮研磨,加入冰预冷蛋白裂解液匀浆,冰上放置30 min,4 ℃、12 000 r/min离心20 min,取上清液,BCA法检测蛋白浓度,取100 μg总蛋白变性,120 g/L聚丙烯酰胺凝胶电泳,300 mA恒湿法电转移55 min至0.2 μm PVDF膜,5%脱脂牛奶室温封闭2 h,用杂交瘤细胞培养上清液作为Ⅰ抗4 ℃摇床过夜,TBST洗膜10 min×3次,Ⅱ抗为HRP标记山羊抗大鼠IgG(1∶1 000)室温孵育2 h,TBST洗膜10 min×3次,ECL显色液显色5 min,暗室中曝光、显影和定影。Quantity One 软件分析各条带光密度值,GAPDH(1∶1 000)作为内参照蛋白,结果以目的条带光密度与同一标本GAPDH蛋白光密度比值表示。
3统计学处理

结 果
1EAMG模型的评估
E组小鼠于注射mAb35 8 h后表现为精神差和活动减少,48 h 时有13只小鼠出现不同程度的临床症状,疲劳、低头、弓背姿势、活动后无力等,5只小鼠无任何临床症状;C组小鼠无一只出现任何临床症状,两组小鼠临床评分见图1。
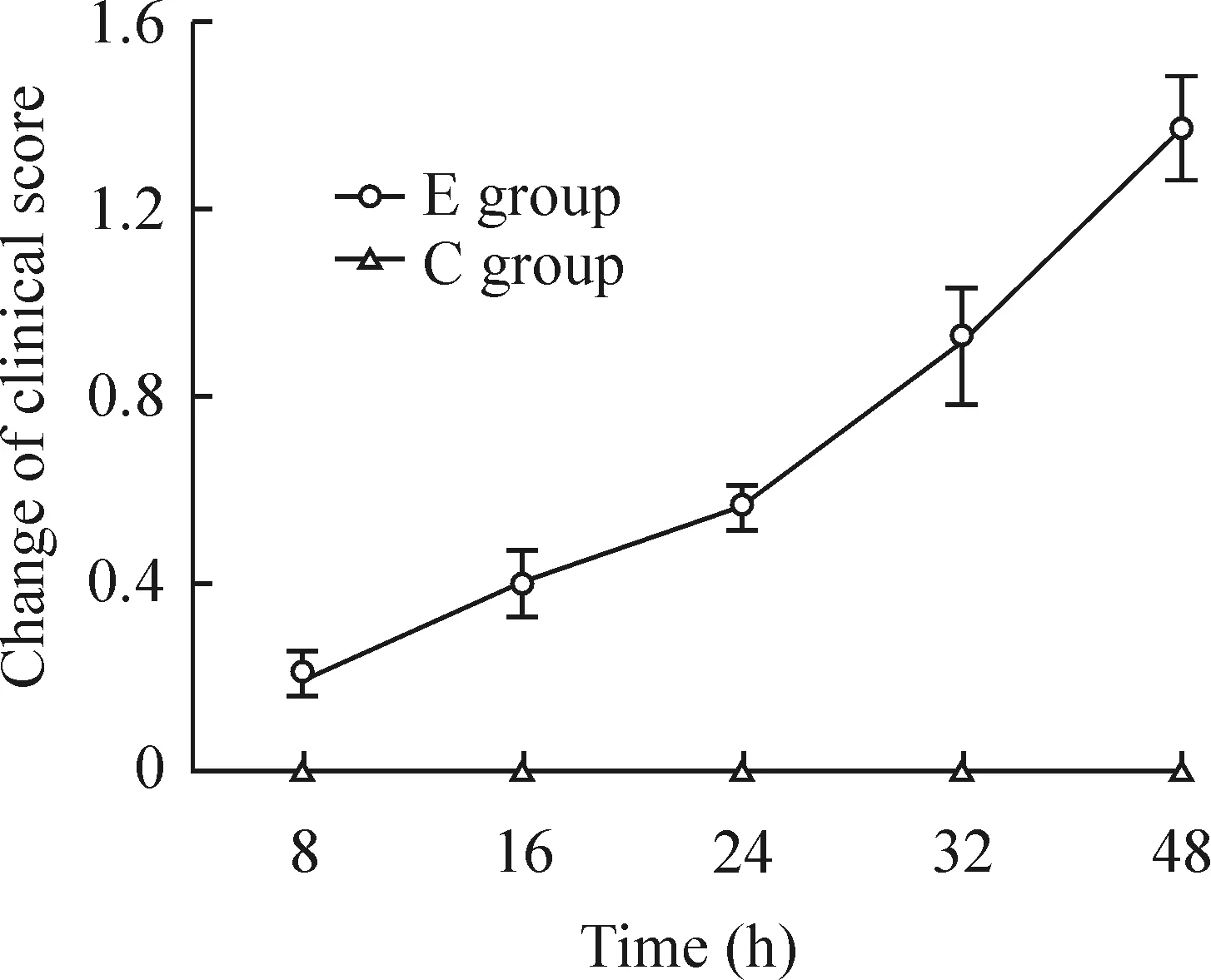

图1mAb35或生理盐水诱导后C57BL/6小鼠的临床评分变化
2免疫荧光染色结果
RE组与RC组相比,AChR和rapsyn在骨骼肌的运动终板处荧光着色均减少;LC组与RC组相比,AChR和rapsyn荧光着色均增多;LE组与RE组相比,AChR和rapsyn荧光着色均增多,其表达量接近RC组,见图2。
3RT-PCR基因扩增结果
AChRα电泳结果显示扩增片段为125 bp,GAPDH为233 bp,与预期设计的目的片段大小相同,见图3。与RC组相比,RE组和LE组AChRα mRNA的表达量明显增多(P<0.01);LE组与RE组相比,AChRα mRNA表达量明显减少(P<0.01); LC组与RC组相比,AChRα mRNA表达量差异无统计学意义(P>0.05),见表1。
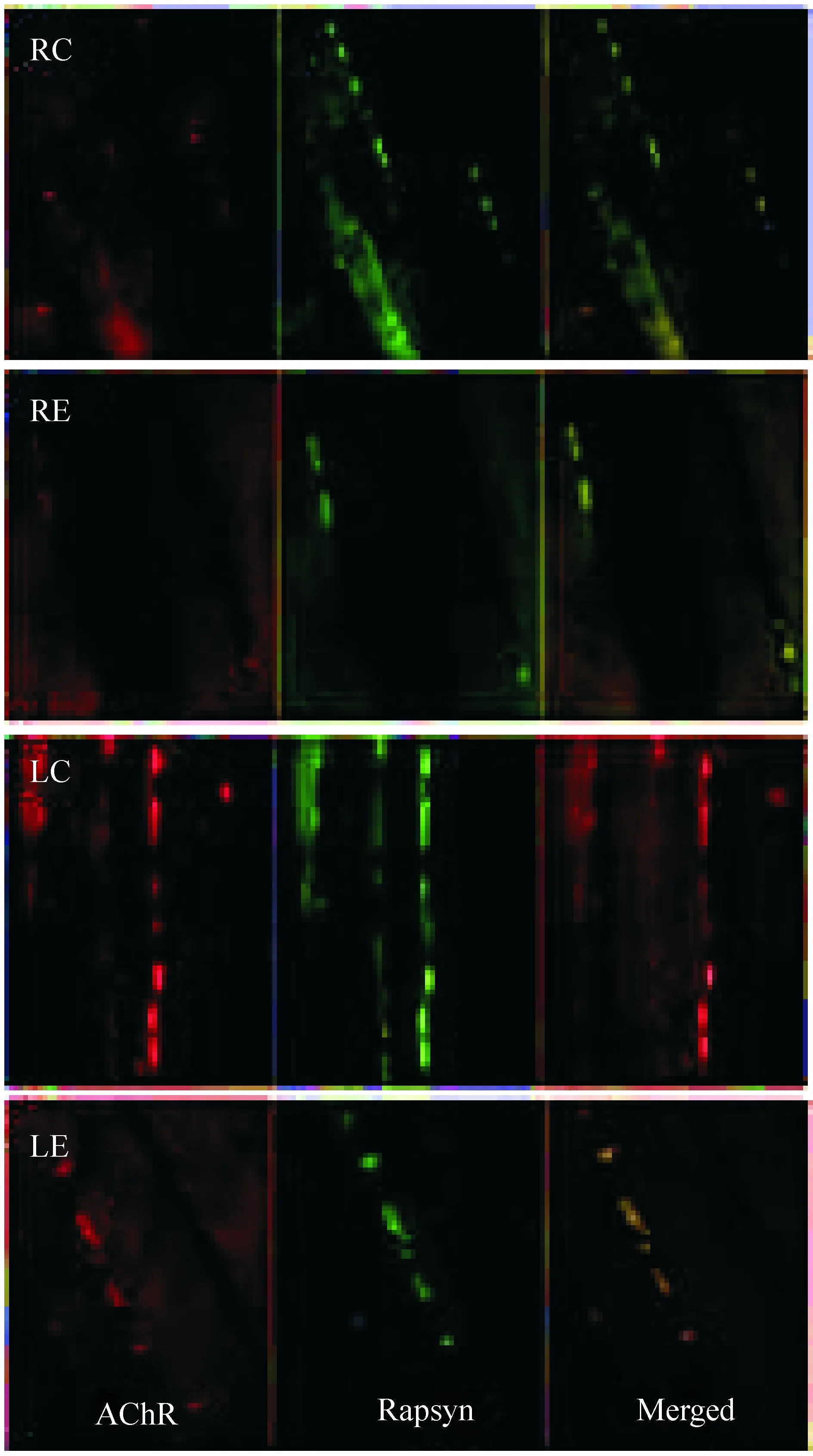
Figure 2. Immunofluorescent staining detection of AChR and rapsyn expression at the mouse muscle endplate(×400). Paraffin sections of tibialis anterior muscles were double-stained with TMR-conjugated α-BTX(left) and anti-rapsyn mAb1234(middle).The merged images are on the right.RC:right hind limb muscles in control group;RE:right hind limb muscles in experimental group;LC:left hind limb muscles in control group;LE:left hind limb muscles in experimental group.
图2免疫荧光染色分析AChR和rapsyn在运动终板处的表达
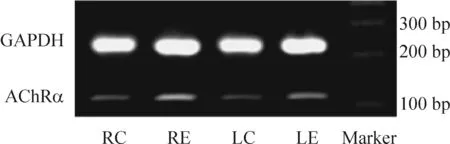
Figure 3. The expression of AChRα mRNA determined by RT-PCR.
图3AChRαmRNA的表达
表1AChRαmRNA和蛋白检测结果的定量分析
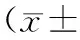

GroupmRNA(AAChRα/AGAPDH)Protein(AAChRα/AGAPDH)RC0.122±0.0130.135±0.038RE0.333±0.049**0.079±0.035*LC0.119±0.0110.175±0.029*LE0.211±0.035**△△0.117±0.012*△
*P<0.05,**P<0.01vsRC group;△P<0.05,△△P<0.01vsRE group.
4Westernblotting蛋白表达结果
小鼠AChRα蛋白分子量为28 kD,内参照GAPDH蛋白为36 kD,见图4。与RC组相比,RE组和LE组AChRα蛋白表达水平均降低(P<0.05);LC组与RC组相比,AChRα蛋白表达水平升高;LE组与RE组相比,AChRα蛋白表达水平升高(P<0.05),见表1。

Figure 4. The expression of AChRα protein determined by Western blotting.
图4AChRα蛋白的表达
讨 论
nAChR是穿过膜脂质双分子层的糖蛋白多聚体,是集受体与通道于一个大蛋白分子内的递质门控通道的一种[4]。nAChR由4类共5个亚基构成(α2βγδ),α亚基约占nAChR分子的40%,在功能上起着决定性作用。α亚基上不但有胆碱能配体结合部位,AChRab的主要结合靶点也位于α亚基上的主要免疫原区第67~76位氨基酸残基上,βγδ为结构性亚单位[5]。
Rapsyn主要由肌肉组织合成,是一种分子量大小为43 kD的细胞骨架蛋白,对AChR起簇集和锚定作用。在神经肌肉接头形成以前,AChRβ亚基和rapsyn以1∶1自发相连,成簇散布于肌细胞膜表面,当神经轴突与肌膜接触的瞬间,轴突释放神经源性信号分子(agrin)结合并激活突触后膜的肌肉特异性酪氨酸激酶(MuSK),进一步激活下游转导通路,通过rapsyn相关跨膜配体连接蛋白(rapsyn-associated transmenbrane ligand,RATL)与 rapsyn相连接,将AChR聚集在神经肌肉接头局部[6]。
本实验将pcDNA-rapsyn质粒通过方波刺激导入实验小鼠的左后肢,2周后被动输注mAb35建立EAMG小鼠模型。通过荧光双标染色显示EAMG小鼠rapsyn和AChR蛋白含量减少,Western blotting检测结果发现,EAMG小鼠AChRA蛋白含量明显较少(P<0.05) 。MG的主要病理损害在突触后膜,体液免疫和细胞免疫均参与MG的发病过程,AChRAb是主要的致病抗体[7],依赖抗体的补体溶解作用使rapsyn和AChR分子被大量破坏,同时抗体介导的抗原调变作用也加速了AChR分子的内化和溶酶体的降解作用,使乙酰胆碱受体分子的半衰期由7 d降至2 d,使体内神经肌肉突触后膜上功能性AChR分子的数量急剧减少[8]。经rapsyn预处理的EAMG小鼠AChR蛋白含量增加(P<0.05),说明上调rapsyn的表达减少了EAMG小鼠AChR的损失, 对AChR发挥保护性作用。经rapsyn预处理的正常小鼠AChR蛋白的表达量也有增加(P<0.05),说明上调rapsyn的表达能稳定未在突触后膜聚集的AChR,或能稳定AChR在体内的代谢。有实验证明小鼠rapsyn基因剔除后AChR集聚受阻,出现突触形成障碍[9],且rapsyn在突触后膜的表达量不同,建立EAMG动物模型的易感性也不同[10]。
Sheng等[11]研究表明,EAMG小鼠的骨骼肌中AChR α亚基的mRNA表达量是增加的,在病情严重的小鼠中表达量更高,AChR功能蛋白丢失越多,mRNA表达越多并且疾病越严重。这可能是因为功能性AChR蛋白的丢失致使AChRα mRNA表达代偿性增加引起的。EAMG小鼠AChRα mRNA表达量增加,但AChRα蛋白表达并未增加的原因可能是由于补体介导的突触后膜溶解使内质网结构受损,AChRα蛋白装配障碍,或是蛋白翻译过程异常造成的。本实验RT-PCR结果显示,经rapsyn预处理的EAMG小鼠AChRα mRNA的表达量明显降低(P<0.01),说明上调rapsyn表达抑制了突触后膜的溶解,减轻了肌肉组织受损的严重程度,减少了突触后膜AChR功能蛋白的丢失。经rapsyn预处理的正常小鼠与未经处理的正常小鼠相比,AChRα mRNA的表达量变化无统计学意义(P>0.05),说明AChRα基因的表达是非rapsyn基因依赖性的,两者的基因表达是相互独立的过程。
综上所述,在肌肉组织内,上调rapsyn蛋白表达可以增加正常小鼠AChR蛋白的含量, 减少EAMG小鼠AChR蛋白的损失量, 减低EAMG小鼠由于AChR蛋白减少而代偿性增加的AChR mRNA表达量,对AChR受体发挥保护性作用。未来的研究方向是如何通过其它方法上调肌肉组织中rapsyn蛋白表达,发挥预防和治疗重症肌无力的作用。
[1] Hoedemaekers A, Graus Y, van Breda Vriesman P, et al. Age- and sex-related resistance to chronic experimental autoimmune myasthenia gravis (EAMG) in Brown Norway rats[J]. Clin Exp Immunol, 1997,107(1): 189-197.
[2] Poulas K, Tsouloufis T, Tzartos SJ.Treatment of passively transferred experimental autoimmune myasthenia gravis using papain[J].Clin Exp Immunol, 2000,120(2): 363-368.
[3] Frail DE, Mclaughlin LL, Mudd J, et al. Identification of the mouse muscle 43 000-delton acetylcholine receptor-associated protein (RAPsyn) by cDNA cloning[J]. J Biol Chem, 1988, 263(30): 15602-15607.
[4] McNerney ME, Pardi D, Pugh PC, et al. Expression and channel properties of α-bungarotoxin-sensitive acetylcholine receptors on chick ciliary and choroid neurons[J]. J Neurophysiol, 2000, 84(3): 1314-1329.
[5] Graus YM, van Breda Vriesman PJ, de Baets MH. Characterization of anti-acetylcholine receptor (AChR) antibodies from mice differing in susceptibility for experimental autoimmune myasthenia gravis (EAMG)[J]. Clin Exp Immunol, 1993, 92(3): 506-513.
[6] Bruneau E, Akaaboune M. The dynamics of the rapsyn scaffolding protein at individual acetylcholine receptor clusters[J]. J Biol Chem, 2007, 282(13): 9932-9940.
[7] 赖详青, 杨明山, 徐金枝, 等. 重症肌无力患者免疫发病机理的研究[J]. 中国病理生理杂志, 2001,17(7):662-664.
[8] Luo J, Kuryatov A, Lindstrom JM. Specific immunotherapy of experimental myasthenia gravis by a novel mechanism[J]. Ann Neurol, 2010, 67(4): 441-451.
[9] Gautam M, Noakes PG, Mudd J, et al. Failure of postsynaptic specialization to develop at neuromuscular junctions of rapsyn-deficient mice[J]. Nature, 1995, 377(6546): 232-236.
[10]Losen M, Stassen MH, Martínez-Martínez P, et al. Increased expression of rapsyn in muscles prevents acetylcholine receptor loss in experimental autoimmune myasthenia gravis[J]. Brain,2005, 128(10): 2327-2337.
[11]Sheng JR, Li LC, Prabhakar BS, et al. Acetylcholine receptor-α subunit expression in myasthenia gravis: a role for the autoantigen in pathogenesis?[J].Muscle Nerve, 2009, 40(2): 279-286.
Effectofrapsynonacetylcholinereceptorinnormalandexperimentalautoimmunemyastheniagravismice
FU Yu, LIU Hong, ZHOU Rui-rui, TENG Yin-yan, ZHANG Xu
(DeparmentofNeurology,TheFirstAffiliatedHospitalofWenzhouMedicalCollege,Wenzhou325000,China.E-mail:drzhangxu@gmail.com)
AIM: To investigate the effect of acetylcholine receptor-associated protein at synapse (rapsyn) on acetylcholine receptor (AChR) in normal mice and mice with experimental autoimmune myasthenia gravis (EAMG).METHODSThe left hind limb of each mouse was injected with pcDNA-rapsyn at 8~10 sites equally spread over the muscle, and the right hind limb was injected with the same volume of 0.9% NaCl. Two weeks after electropermeabilization, 36 mice were divided into 2 groups: the mice in group E were intraperitoneally injected with 0.5 mL 40-fold concentrated cell culture supernatant of mAb35, and the mice in group C were intraperitoneally injected with the same volume of 0.9% NaCl. The animals were killed 48 h after injection. The tibialis anterior muscles and calf muscles of bilateral hind limbs were isolated.The muscles of left hind limb
rapsyn plasmid were LE group and LC group, and the muscles of right hind limb muscles pcDNA-received 0.9% NaCl were RE group and RC group. The expression of AChR and rapsyn at the mouse muscle endplate was detected by immunofluorescence staining. The expression of AChRα at mRNA and protein levels was detected by RT-PCR and Western blotting,respectively.RESULTSThe protein expression of AChRα was higher in LC group than that in RC group (P<0.05). The protein expression of AChRα was higher in LE group than that in RE group (P<0.05). No statistical difference of the AChRα mRNA expression between LC group and RC group was observed (P> 0.05). The mRNA expression of AChRα was significantly lower in LE group than that in RE group (P<0.01).CONCLUSIONProtein overexpression of rapsyn by plasmid transfection protects the AChRs in the muscles of both nomal and EAMG mice.
Myasthenia gravis,experimental autoimmune; Receptors,acetylcholine; Rapsyn
R746.1
A
10.3969/j.issn.1000-4718.2012.03.026
