高糖作用的肾小球系膜细胞SnoN/Ski蛋白表达及泛素化降解*
2012-11-06南庆玲
南庆玲, 阳 诚, 徐 勇
(泸州医学院附属医院内分泌科, 四川 泸州 646000)
1000-4718(2012)03-0506-06
2011-07-14
2011-12-15
四川省杰出青年基金资助项目(No.2008-26-366);国家自然科学基金资助项目(No.30670980)
△通讯作者 Tel:0830-3165360 ;E-mail:xywyll@yahoo.com.cn
#现工作单位:湖南省马王堆医院 ##现工作单位:龙泉驿区第一人民医院
高糖作用的肾小球系膜细胞SnoN/Ski蛋白表达及泛素化降解*
南庆玲#, 阳 诚##, 徐 勇△
(泸州医学院附属医院内分泌科, 四川 泸州 646000)
目的观察高糖作用的大鼠肾小球系膜细胞内核转录共抑制因子SnoN/Ski及泛素连接酶Arkadia的表达变化,初步探讨SnoN/Ski泛素化降解在糖尿病肾病中的作用。方法将体外培养的大鼠肾小球系膜细胞分别设正常对照组 、高糖甲组(培养基含20 mmol/L葡萄糖)、高糖乙组(培养基含30 mmol/L葡萄糖)、高糖+MG132组(30 mmol/L葡萄糖培养基中预先加入0.5 μmol/L特异性泛素蛋白酶体抑制剂MG132)和甘露醇组。用蛋白免疫印迹技术和免疫荧光染色-激光共聚焦显微镜检测各组细胞SnoN/Ski及Arkadia蛋白的表达。结果(1)正常系膜细胞中SnoN/Ski蛋白大量表达,Arkadia蛋白表达较弱。(2)高糖作用后SnoN/Ski蛋白表达减弱,Arkadia蛋白表达增强(P<0.05)。(3)与高糖组比较,高糖加入MG132后SnoN/Ski蛋白表达增加,Arkadia蛋白表达减弱(P<0.01)。(4)甘露醇组与正常组比较SnoN/Ski及Arkadia蛋白表达均无明显差异(P>0.05)。结论(1)高糖可通过泛素蛋白酶体途径降解SnoN/Ski蛋白致其低表达。(2)E3连接酶Arkadia参与了高糖诱导的SnoN/Ski的泛素化降解 。
SnoN/Ski; 泛素-蛋白酶体通路; Arkadia; 糖尿病肾病
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetic mellitus,DM)特有而常见的微血管并发症,发病机制不清,高血糖所致各种生长因子可造成肾脏损害。在被激活的各种生长因子中, 转化生长因子β(transforming growth factor beta,TGF-β)是目前已知的致纤维化作用最强的多肽因子,它能诱导肾脏固有细胞表型转化及促进细胞外基质积聚,在肾小球硬化和肾小管-肾间质纤维化进行性发展中起关键作用[1-2]。SnoN/Ski是TGF-β通路的负性调节因子,通过各种不同的方式来拮抗Smad的作用从而阻断Smad介导的基因转录,它所介导的Smads转录活性的抑制是唯一发生于核内的,且恰恰位于TGF-β靶基因转录之前,这决定了SnoN/Ski在调控TGF-β信号通路中的重要地位。SnoN/Ski在DN中的改变及机制目前尚不清楚。我们的前期研究发现,在高糖作用的肾小球系膜细胞(glomerular mesangial cells,GMCs)和糖尿病大鼠模型中,泛素蛋白酶体途径活化,部分蛋白泛素化作用明显增强,TGF-β/Smad信号上调[3]。为此,本研究将泛素蛋白酶体对蛋白质的降解机制应用到DN信号通路的研究中。首先将大鼠正常GMC进行体外培养,用高糖作为刺激因子,MG132作为泛素蛋白酶体通路阻断剂,用蛋白免疫印迹(Western blotting)技术和免疫荧光染色-激光共聚焦显微镜检测各组系膜细胞SnoN、Ski及Arkadia蛋白的表达,旨在从细胞信号角度探讨泛素-蛋白酶体通路(ubiquitin-proteasome pathway,UPP)在高糖诱导系膜细胞TGF-β/Smad通路中的作用,为进一步阐明DN发生机制及其防治提供理论依据。
材 料 和 方 法
1材料和试剂
大鼠GMCs(HBZY-1细胞)购自中国典型培养物保藏中心。兔抗大鼠SnoN多克隆抗体(ab58846)购自Abcam。小鼠抗大鼠Ski单克隆抗体(sc-33693)及山羊抗大鼠Arkadia多克隆抗体(sc-19242)购自Santa Cruz。MG132(proteasome抑制剂)购自Calbiochem。
2方法
2.1细胞培养及分组 GMC用含10%胎牛血清的低糖DMEM培养基培养。取对数生长期细胞用于实验。将细胞分为5组:(1)正常对照组:培养基含5.6 mmol/L葡萄糖;(2)高糖甲组:培养基含20 mmol/L葡萄糖;(3)高糖乙组:培养基含30 mmol/L葡萄糖;(4)高糖+MG132组:30 mmol/L葡萄糖培养基中预先加入0.5 μmol/L特异性泛素蛋白酶体抑制剂MG132;(5)甘露醇组:培养基含5.6 mmol/L的葡萄糖+24.4 mmol/L甘露醇,作为高糖乙组的渗透压对照。
2.2Western blotting 以细胞裂解液提取各组干预后的细胞总蛋白,BCA法测定各组蛋白浓度。每泳道25 g蛋白上样,行SDS-PAGE垂直电泳,电转移至PVDF膜。TBST洗涤,5%脱脂奶粉封闭。然后将膜放入稀释的Ⅰ抗(SnoN 1∶400、β-actin 1∶4 000),4 ℃孵育过夜。第2 d TBST冲洗后,加辣根过氧化物酶标记山羊抗兔Ⅱ抗(稀释倍数为1∶4 000),37 ℃孵育1 h,TBST冲洗后ECL显影曝光。Bio-Rad凝胶成像系统扫描,Quantity One软件分析各阳性条带的积分灰度值,设内参照β-actin,计算各目标蛋白的相对含量。
2.3细胞免疫荧光染色(激光共聚焦显微镜观察) 将各组干预后的细胞爬片用多聚甲醛固定,Triton打孔,血清封闭,然后加入Ⅰ抗(SnoN、Ski及Arkadia Ⅰ抗浓度均为1∶50),作用60 min, 4 ℃冰箱过夜(至少16 h)。用PBS代替Ⅰ抗作为阴性对照。PBS洗涤后加入FITC标记的Ⅱ抗(稀释比1∶50),37 ℃水浴作用60 min,注意避光操作。再次洗涤后封片镜检,使用Leica DMIRE2型激光扫描共聚焦显微镜系统对细胞的荧光分布及强度进行观察。最后用Image-Pro Plus 6.0软件对荧光强度进行半定量分析。
3统计学处理
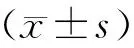
结 果
1高糖对肾小球系膜细胞SnoN表达的影响
1.1Western blotting检测结果
1.1.1高糖作用不同时间后SnoN的表达 免疫印迹发光显影后显示,见图1,各条泳道均在60 kD和36 kD处各出现1条带,与预期的SnoN蛋白和内参照GAPDH相吻合,说明两者均为特异性蛋白条带,其中各组GAPDH条带的亮度基本一致。目的条带中,高糖组的亮度较正常组减弱,且随着时间的延长条带的亮度逐渐减弱。

Figure 1. Western blotting detection of the expression of SnoN protein in GMCs of 30 mmol/L glucose group for different time.
图130mmol/L葡萄糖作用不同时间GMCsSnoN蛋白的表达
在高糖作用的48 h内,高糖可促进SnoN蛋白的表达下降,且随着作用时间的延长,SnoN蛋白表达下降愈加明显。与正常对照组相比,30 mmol/L葡萄糖浓度作用12 h SnoN蛋白表达下降12%,作用24 h SnoN蛋白表达下降42%,作用48 h SnoN蛋白表达下降53%,差异有统计学意义(P<0.05),见表1。这提示高糖促进SnoN蛋白的表达下降具有时间依赖性,且在48 h时下降效果尤为明显。

表1 30 mmol/L葡萄糖作用不同时间后SnoN蛋白的表达
▲P<0.05vsnormal control group;**P<0.01vs30 mmol/L glucose group(12 h);△P<0.05vs30 mmol/L glucose group(24 h).
1.1.2各组干预48 h SnoN的表达 免疫印迹发光显影后显示,见图2,高糖组SnoN条带的亮度较弱,且随着浓度的增加亮度逐渐减弱。甘露醇组和高糖+MG132组亮度和正常组相似,均较高。

Figure 2. The expression of SnoN protein in GMCs of each group analysed by Western blotting(48 h).
图2各组GMCsSnoN蛋白的表达(48h)
与正常组相比,20 mmol/L高糖甲组SnoN蛋白表达下降34%(P<0.01),30 mmol/L高糖乙组SnoN蛋白表达下降54%(P<0.01)。提示高糖可促进SnoN蛋白的表达下降,且具有浓度依赖性。甘露醇组与正常组比较,SnoN蛋白的表达差异无统计学意义(P>0.05)。与高糖乙组比较,高糖加入MG132后,系膜细胞SnoN蛋白的表达增加46%(P<0.01)。
甘露醇组与正常组比较,SnoN蛋白的表达差异无统计学意义(P>0.05),见表2。
表2免疫印迹检测各组作用48hSnoN蛋白的表达


GroupSnoNproteinNormalcontrol1.858±0.17320mmol/Lglucose1.218±0.107▲▲30mmol/Lglucose0.850±0.141▲▲**30mmol/Lgluclose+MG1321.585±0.206△△Mannitol1.818±0.266△△
▲▲P<0.01vsnormal control group;**P<0.01vs20 mmol/L glucose group;△△P<0.01vs30 mmol/L glucose group.
1.2免疫荧光技术检测结果 共聚焦显微镜下图像可见,SnoN蛋白在正常对照组细胞中有大量表达,主要定位于胞浆,胞核中表达较少,见图3A;高糖刺激后SnoN表达明显减弱,见图3B;加入MG132作用后,高糖组表达增强,见图3C;甘露醇组表达较强,见图3D。
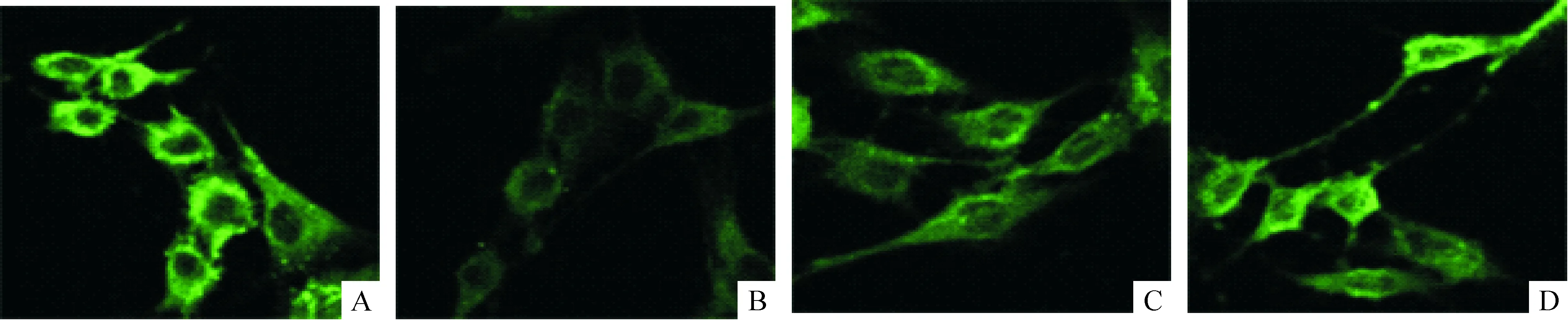
Figure 3. Expression of SnoN protein in GMCs of each group (immunohistochemical staining,×600). A: normal control;B:30 mmol/L glucose;C: 30 mmol/L glucose and MG132;D: mannitol.
图3各组系膜细胞中SnoN蛋白的表达
对荧光强度进行半定量分析的结果显示,与正常对照组相比,30 mmol/L葡萄糖作用GMCs 48 h后SnoN蛋白表达下降54%,差异有统计学意义(P<0.01)。与高糖乙组比较,高糖加入MG132后,SnoN蛋白的表达增加83%,差异有统计学意义(P<0.01)。甘露醇组与正常组比较,SnoN蛋白的表达差异无统计学意义(P>0.05),见表3。
表3免疫荧光技术检测各组GMCs中SnoN蛋白的表达量

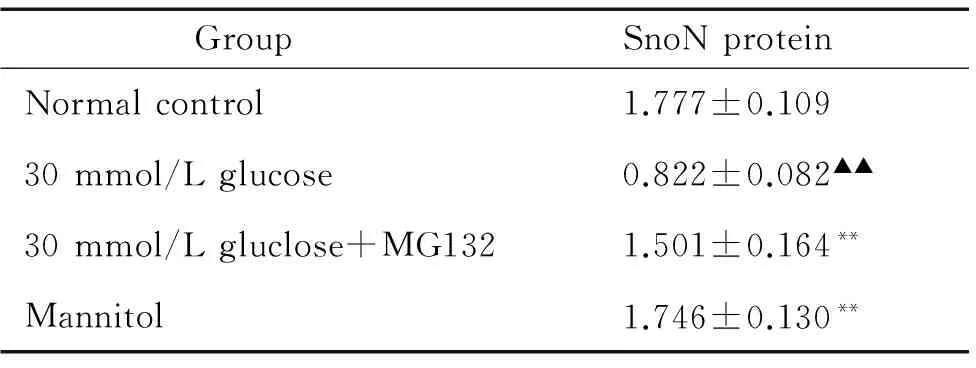
GroupSnoNproteinNormalcontrol1.777±0.10930mmol/Lglucose0.822±0.082▲▲30mmol/Lgluclose+MG1321.501±0.164**Mannitol1.746±0.130**
▲▲P<0.01vsnormal control group;**P<0.01vs30 mmol/L glucose group.
2高糖对肾小球系膜细胞Ski的表达影响
共聚焦显微镜图像可见,正常系膜细胞中Ski主要在胞浆表达,胞核中表达很少,见图4。荧光强度半定量分析结果显示,在高糖作用的48 h内,高糖可促进Ski蛋白的表达下降,且随着作用时间的延长,Ski蛋白表达下降愈明显。与正常对照组相比,30 mmol/L葡萄糖作用GMCs 12 h,细胞内Ski蛋白表达降低37%,作用24 h Ski蛋白表达降低50%,作用48 h Ski蛋白表达降低56%,差异有统计学意义(P<0.01),见表4。
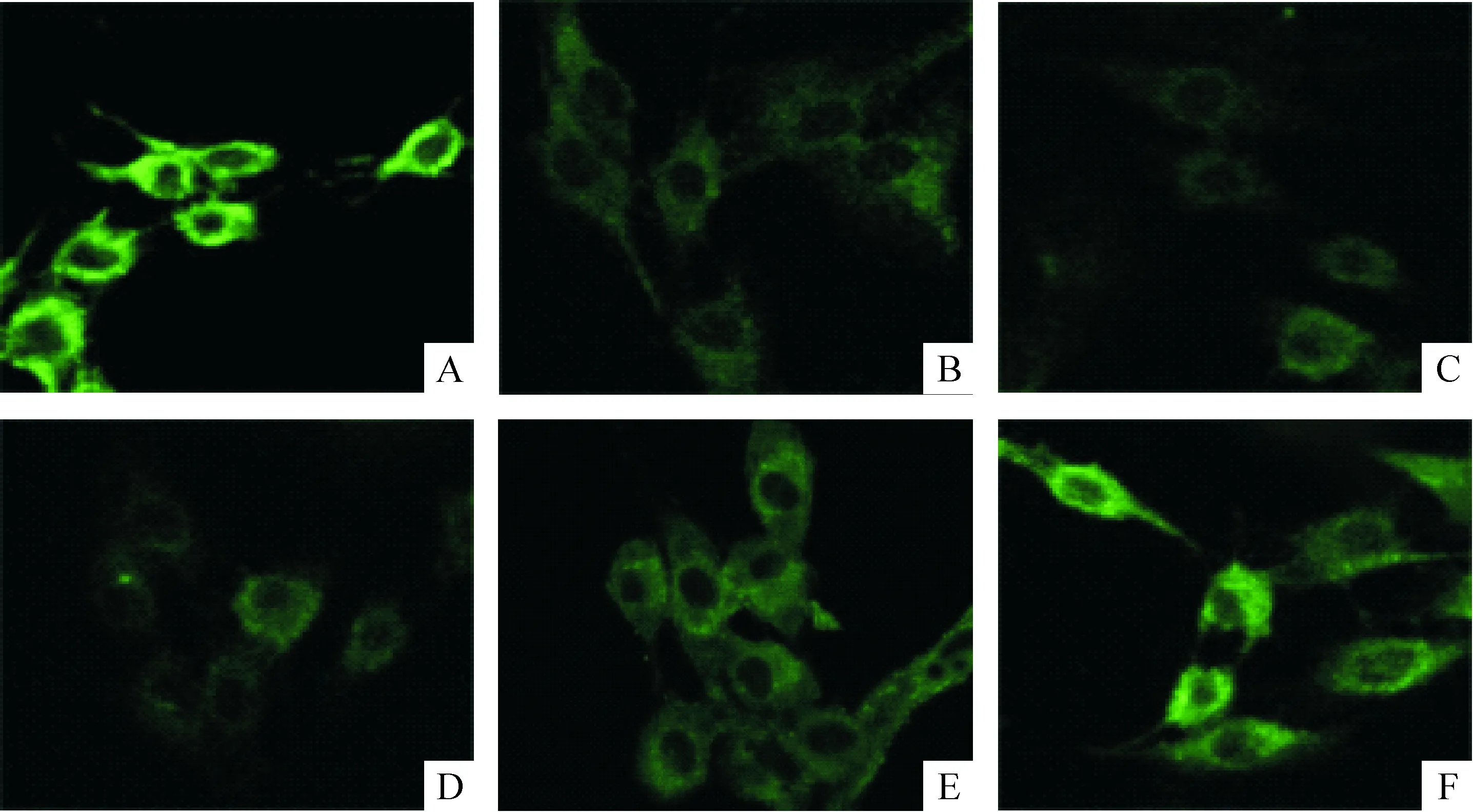
Figure 4. Expression of Ski protein in GMCs of each group (immunohistochemical staining,×600).A: normal control; B:20 mmol/L gluclose;C: 30 mmol/L gluclose (24 h); D: 30 mmol/L gluclose (48 h);E: 30 mmol/L gluclose and MG132; F: mannitol.
图4各组系膜细胞中Ski蛋白的表达

表4 免疫荧光检测30 mmol/L葡萄糖作用不同时间Ski蛋白的表达
▲▲P<0.01vsnormal control group;*P<0.05vs30 mmol/L glucose group (12 h).
作用48 h后各组荧光图像进行半定量分析结果见表5。与正常对照组相比, 20 mmol/L高糖甲组Ski表达下降41%,30 mmol/L高糖乙组Ski表达下降55%,差异有统计学意义(P<0.01)。提示高糖对促进Ski蛋白的表达下降作用具有一定的时间、浓度依赖性。甘露醇组与正常组比较,Ski蛋白的表达差异无统计意义(P>0.05)。与高糖乙组比较,高糖加入MG132后,系膜细胞内Ski表达增加51%,差异有统计学意义(P<0.01)。
3高糖对肾小球系膜细胞Arkadia表达的影响
正常对照组Arkadia蛋白表达较弱,主要定位于胞浆,见图5A。高糖刺激后Arkadia表达明显增强,见图5B,加入MG132后,其表达较高糖组减弱,见图5C。甘露醇组表达较弱,见图5D。
表5免疫荧光检测各组GMCs中Ski蛋白的表达量


GroupSkiproteinNormalcontrol1.494±0.12820mmol/Lglucose0.876±0.132▲▲30mmol/Lglucose0.671±0.127▲▲**30mmol/Lgluclose+MG1321.365±0.282△△Mannitol1.446±0.147△△
▲▲P<0.01vsnormal control group;**P<0.01vs20 mmol/L glucose group;△△P<0.01vs30 mmol/L glucose group.
与正常对照组相比,30 mmol/L葡萄糖浓度作用GMC 48 h Arkadia蛋白表达增加55%,差异有统计学意义(P<0.01)。与高糖组比较,高糖加入MG132后,Arkadia蛋白的表达降低27%(P<0.01)。甘露醇组与正常组比较,Arkadia蛋白的表达差异无统计学意义(P>0.05),见表6。

Figure 5. Expression of Arkadia protein in GMCs of each group (immunohistochemical staining,×600). A: normal control;B:30 mmol/L gluclose;C: 30 mmol/L gluclose and MG132;D: mannitol.
图5各组系膜细胞中Arkadia蛋白的表达
表6免疫荧光技术检测各组GMCsArkadia蛋白的表达

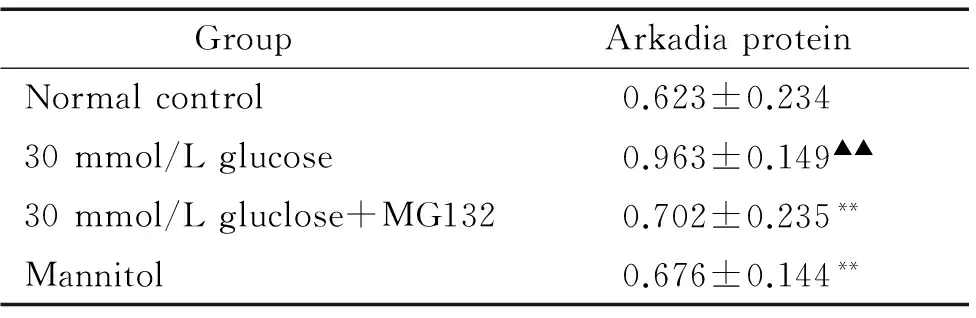
GroupArkadiaproteinNormalcontrol0.623±0.23430mmol/Lglucose0.963±0.149▲▲30mmol/Lgluclose+MG1320.702±0.235**Mannitol0.676±0.144**
▲▲P<0.01vsnormal control group;**P<0.01vs30 mmol/L glucose group.
讨 论
SnoN/Ski作为Smad转录拮抗剂,它的表达水平在很大程度上影响TGF-β的生物学效应。多个研究表明[4-5],在纤维化肾组织中, TGF-β的表达水平进行性显著增加,而SnoN和Ski的蛋白水平进行性显著减少。本实验结果也显示:在高糖培养的48h以内,与正常对照组相比,高糖可促进SnoN/Ski蛋白表达下降,呈一定的时间、浓度依赖性,差异有统计学意义。与高糖组比较,高糖加入特异性蛋白酶体抑制剂MG132后, SnoN/Ski蛋白表达明显增加。甘露醇组与正常组比较,SnoN/Ski蛋白的表达无明显差异,说明高糖对SnoN/Ski的作用与渗透压无关。提示高糖所致的SnoN/Ski蛋白泛素化降解可能是糖尿病肾病TGF-β/Smads通路激活的新机制。
UPP对细胞内蛋白质进行高效并高度选择性、能量依赖性降解,能精确调控细胞内各种蛋白质,进而影响细胞周期调控、细胞凋亡、抗原呈递、炎症反应及基因转录表达等[6-7]。尤其是通过降解细胞内各信号通路的抑制因子或/和激活因子发挥着上调或下调作用[8]。而Arkadia作为泛素蛋白酶体系统中的一种E3泛素连接酶,对蛋白的泛素化降解具有相对的特异性和唯一性,它仅与抑制型Smads(如Smad7)及负性因子SnoN、Ski等发生强烈相互作用,对其它信号分子不产生降解作用,也不与TGF-β受体作用,对TGF-β/Smad信号通路的生物学效应只起增强作用[9-10]。Liu等[11]的研究表明,Arkadia通过诱导Smad7的降解使在肾小管上皮-间质转化中发挥重要作用。李晓照[12-13]的研究也发现,在UUO大鼠肾小管间质纤维化发病过程中,Arkadia-Smad7相互作用介导的TGF-β/Smad信号通路正向调控作用可能促使肾小管间质纤维化病变的发生和加重;在哮喘大鼠模型中,Arkadia可分别与SnoN、Ski和Smad7发生相互作用,在放大TGF-β信号促进气道重塑形成中起关键作用。
目前对于Arkadia在DN中的研究较少,为了进一步明确Arkadia与SnoN/Ski泛素化的关系及在DN中的作用,本实验首先用不同浓度高糖作用GMC,观察高糖对SnoN/Ski及Arkadia蛋白表达的影响;然后用蛋白酶体抑制剂MG132特异性阻断泛素蛋白酶体途径,以观察泛素化在高糖刺激的GMC中的变化。结果显示:高糖刺激时Arkadia蛋白表达增加,SnoN/Ski蛋白表达下降;加入MG132后,Arkadia蛋白表达减弱,与此同时,SnoN/Ski蛋白的表达明显增强。提示高糖时SnoN/Ski可能通过连接酶Arkadia进行泛素化降解。
鉴于SnoN/Ski对TGF-β信号通路负性调控的重要性,Arkadia介导的泛素化修饰对SnoN/Ski调控的有效性,以及MG132阻断泛素化途径的客观性,我们认为:糖尿病时,高糖等致病因子可能通过Arkadia等的介导致SnoN/Ski蛋白泛素化降解增强、表达降低,不能有效抑制TGF-β的纤维化信号,使该通路持久活化,可能是糖尿病肾病发生的新机制。
[1] Wynn TA.Cellular and molecular mechanisms of fibrosis[J].J Pathol,2008,214(2):199-210.
[2] Yang JW, Liu YH. Blockage of tubular epithelial to myofibroblast transition by hepatocyte growth factor prevents renal interstitial fibrosis[J]. J Am Soc Nephrol, 2002, 13(1): 96-107.
[3] 徐 玲,杨 军,欧阳芳,等.高糖对大鼠肾系膜细胞泛素及泛素化蛋白表达的影响[J].中华肾脏病杂志,2009,25(11):853-855.
[4] Yang JW, Zhang XH, Li YJ , et al. Downregulation of smad transcriptional corepressors SnoN and Ski in the fibrotic kidney: an amplification mechanism for TGF-β1 signaling[J]. J Am Soc Nephrol, 2003, 14(12):3167-3177.
[5] Fukasawa H, Yamamoto T, Togawa A, et al. Ubiquitin-dependent degradation of SnoN and Ski is increased in renal fibrosis induced by obstructive injury[J]. Kidney Int, 2006,69(10):1733-1740.
[6] Myung J, Kim KB, Crews CM.The ubiquitin-proteasome inhibitors[J]. Med Res Rev,2001,21(4):245-273.
[7] Lecker SH, Goldberg AL, Mitch WE. Protein degradation by the ubiquitin- proteasome pathway in normal and disease states[J]. J Am Soc Nephrol, 2006,17(7):1807-1819.
[8] Lu ZM, Hunter T. Degradation of activated protein kinases by ubiquitination[J]. Annu Rev Biochem,2009,78:435-475.
[9] Koinuma D,Shinozaki M, Komuro A,et al.Arkadia amplifies TGF-beta superfamily signalling through degradation of Smad7[J].EMBO J,2003,22(24):6458-6470.
[10]Yoshiko N,Konstantinos JM, Kian LL,et al. Arkadia induces degradation of SnoN and c-Ski to enhance transforming growth factor-β signaling[J]. J Biol Chem,2007,282(28):20492-20501.
[11]Liu FY, Li XZ, Peng YM,et al. Arkadia regulates TGF-β signaling during renal tubular epithelial to mesenchymal cell transition[J]. Kidney Int, 2008,73(5):588-594.
[12]李晓照. Arkadia-Smad7介导TGF-β信号通路的正向调控与肾纤维化的关系[D].长沙:中南大学,2007.5.
[13]李晓照.Arkadia上调TGF-β信号通路促进哮喘大鼠气道重塑[C].∥中华医学会呼吸病学分会.中华医学会第六届全国哮喘学术会议暨中国哮喘联盟第二次大会论文集.苏州:[出版者不详],2008:333-337.
Ubiquitin-dependentdegradationofSnoN/Skiproteininglomerularmesangialcellsinducedbyhighglucose
NAN Qing-ling, YANG Cheng, XU Yong
(DepartmentofEndocrinology,TheAffiliatedHospital,LuzhouMedicalCollege,Luzhou646000,China.E-mail:xywyll@yahoo.com.cn)
AIM: To observe the protein expression of SnoN/Ski and ubiqutin ligase Arkadia in rat glomerular mesangial cells (GMCs) exposed to the high glucose.METHODSCultured rat glomerular mesangial HBZY-1 cells were divided into control group, 20 mmol/L glucose group, 30 mmol/L glucose group, 30 mmol/L glucose+MG132 group (culture medium containing 30 mmol/L glucose and 0.5 μmol/L specific proteasome inhibitor MG132), and mannitol group. The expression levels of SnoN, Ski and Arkadia were measured by Western blotting analysis, immunofluorescence and laser scanning confocal microscopy.RESULTSIn control GMCs, the expression of SnoN/Ski was rich and Arkadia was weak. After stimulated with high glucose, the expression of SnoN/Ski was decreased and Arkadia was gradually increased (P<0.05). Compared with high glucose group, the levels of SnoN/Ski and Arkadia were mostly reverted by adding the proteasome inhibitor MG132 at concentration of 0.5 μmol/L (P<0.01). The expression levels of SnoN/Ski and Arkadia were not significantly changed in mannitol group in comparison with control group (P>0.05).CONCLUSIONHigh glucose decreases the expression of SnoN/Ski through ubiquitin-dependent degradation of SnoN/Ski. The degradation of SnoN/Ski mediated by Arkadia may play an important role in the pathogenesis of diabetic nephropathy.
SnoN/Ski; Ubiquitin-proteasome pathway; Arkadia; Diabetic nephropathies
R587.1
A
10.3969/j.issn.1000-4718.2012.03.021
