凉血活血胶囊对咪喹莫特诱导小鼠银屑病样皮损的干预作用*
2012-11-06底婷婷赵京霞梁代英
底婷婷, 赵京霞, 王 燕, 刘 欣, 梁代英, 李 萍
(首都医科大学附属北京中医医院, 北京市中医研究所病理生理室,北京 100010)
1000-4718(2012)04-0718-05
2011-08-29
2012-01-06
国家自然科学基金资助项目(No.81072810)
△通讯作者 Tel:010-52176679 ;E-mail:liping411@yahoo.com.cn
·短篇论著·
凉血活血胶囊对咪喹莫特诱导小鼠银屑病样皮损的干预作用*
底婷婷, 赵京霞, 王 燕, 刘 欣, 梁代英, 李 萍△
(首都医科大学附属北京中医医院, 北京市中医研究所病理生理室,北京 100010)
目的观察凉血活血胶囊对咪喹莫特诱导银屑病样小鼠模型中免疫异常的干预作用。方法BALB/c雌性小鼠48只,随机分为正常对照组,模型组,凉血活血胶囊高、中、低剂量组和雷公藤多苷组。采用银屑病皮损面积和疾病严重程度(psoriasis area and severity index,PASI)评分标准观察银屑病样小鼠模型皮损变化情况。光镜下观察皮损组织形态学变化,测量表皮层厚度。免疫组织化学法检测皮损中增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)反映表皮角质形成细胞增殖程度;检测CD3、CD11c、F4/80和Gr-1反映炎症浸润程度;检测CD31以反映血管增生情况。结果模型组小鼠皮肤出现鳞屑红斑,皮损增厚;皮损组织表现为表皮棘层增厚,角化不全和微脓肿;真皮大量炎症细胞浸润,血管增生明显。与模型组比较,凉血活血胶囊组小鼠银屑病样皮损症状缓解,PASI分数降低,表皮角化不全减轻,角质形成增殖减少,T淋巴细胞、树突状细胞、巨噬细胞、中性粒细胞和单核细胞的浸润减弱,新生血管减少。结论凉血活血胶囊可通过影响表皮细胞过度增殖、角化不全、炎症细胞浸润及血管增生而改善咪喹莫特诱导的小鼠银屑病样皮损变化。
银屑病; 咪喹莫特; 凉血活血胶囊
银屑病是一种常见的炎性增殖性皮肤疾病,属于自身免疫性疾病。咪喹莫特(imiquimod,IMQ)为免疫激活剂,可通过激发Toll样受体致免疫激活,诱发小鼠皮肤类似银屑病样的皮损改变[1]。清热解毒、凉血活血是中医治疗血热证银屑
病的基本法则,凉血活血胶囊则由首都医科大学附属北京中医医院临床有效经验方制成,疗效肯定[2]。本实验在咪喹莫特诱导小鼠皮肤银屑病样皮损模型的基础上,观察凉血活血胶囊的免疫干预作用,为其临床应用提供理论依据。
材 料 和 方 法
1动物
BALB/c雌性小鼠48只[由北京华阜康生物科技股份有限公司提供,动物许可证编号SCXK(京)20090007],体重18~20 g。
2试剂和药物
凉血活血胶囊(北京中医医院制剂室);咪喹莫特乳膏(四川明欣药业有限责任公司产品);雷公藤多苷片(浙江得恩德制药有限公司产品);凡士林(河北兰炼飞天石化有限公司产品);兔和鼠二步法检测试剂盒、3%H2O2去离子水、DAB显色液(中杉金桥生物技术有限公司);增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)抗体、CD3单克隆抗体、CD11c单克隆抗体(Abcam);CD31单克隆抗体、Gr-1单克隆抗体(BD);F4/80单克隆抗体(Biolegend);Vectastain ABC KitⅡ抗、 NovaRED显色液(Vector Laboratories)。
3造模制备及分组
参考Leslie等模型制备方法。实验前48只BALB/c雌性小鼠戊巴比妥钠腹腔注射麻醉(80 mg/kg),背部去毛后单笼饲养。随机分为正常对照组(normal),模型组(model),凉血活血胶囊(Liang Xue Huo Xue capsules,LXHX)高、中、低剂量组和雷公藤多苷(glycosides ofTripterygiumwilfordii,GTW)阳性药物对照组。各组小鼠(除正常对照组小鼠涂抹适量凡士林)背部每日涂抹4%咪喹莫特乳膏42 mg,同时灌胃给药,每天1次,每次4 mL,连续8 d:正常对照组与模型组给予生理盐水;凉血活血胶囊高、中、低剂量组分别给予凉血活血胶囊溶液2 mg/kg、1 mg/kg、0.5 mg/kg;雷公藤多苷组给予10 mg/kg雷公藤多苷片溶液。
4检测指标与方法
4.1各组小鼠银屑病样皮损面积和疾病严重程度(psoriasis area and severity index,PASI)评分 依据PASI评分标准给予小鼠相应红斑、鳞屑及浸润增厚程度的积分,将三者积分相加得到总积分,观察小鼠皮损的变化情况。
4.2各组小鼠皮损病理改变 采用苏木精-伊红(HE)染色观察。剪取各组小鼠裸露皮肤,经HE染色观察皮肤组织学改变,并测量表皮厚度以反应表皮增厚情况。
4.3各组小鼠皮损PCNA、CD3、CD11c、F4/80、Gr-1及CD31的表达
4.3.1各组小鼠皮肤中PCNA和CD3的表达 石蜡切片经抗原热修复、抗体孵育、DAB显色,苏木精复染。同步设立阴性对照。
4.3.2各组小鼠皮肤中CD11c、F4/80、Gr-1和CD31的表达 小鼠皮损经OCT包埋做冰冻切片,冰丙酮固定、抗体孵育、NovaRED显色,苏木精复染。同步设立阴性对照。切片采用Image-Pro Plus 6.0图像分析系统进行半定量分析,各指标以累积吸光度(IA)总和吸光度值(A)表示。
5统计学处理
结 果
1各组小鼠皮损部红斑、鳞屑、浸润增厚及皮损积分的变化
图1可见,与对照组相比,IMQ涂抹1 d后模型组皮肤即出现红斑;2~3 d出现鳞屑,7~8 d最严重;皮肤持续增厚,类似银屑病样皮损。随着药物作用积蓄,模型组皮损日益严重,红斑由淡粉色斑点变为大面积深红色斑块、鳞屑增多增厚、皮肤增厚浸润明显。雷公藤多苷组、凉血活血胶囊高、中、低剂量组皮损与模型组相比皮损症状明显减轻,皮肤较光滑,鳞屑稀少,红斑色浅,浸润增厚较轻,见图2。
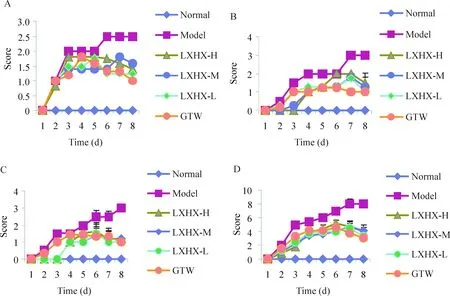
Figure 1. Scores of mouse skin lesions induced by IMQ. Erythema (A), scaling (B), and thickness (C) were scored daily. Additionally, the cumulative scores (D) were calculated.
图1各组小鼠皮损积分趋势
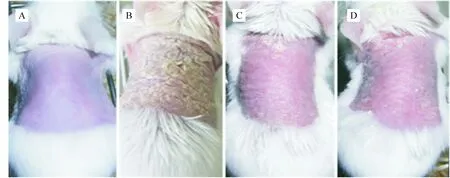
Figure 2. Gross observation of mice at day 8 of treatment. A: normal group, skin was smooth, rosy and thin; B: model group, hypertrophic lesions with heavy scales over, skin lesion was dark red; C: LXHX group, scattered scales, skin lesion was not so thick as model group, the color was less red; D: GTW group, less scales, skin lesions was significantly thinner than model, the color was less red.
图2各组小鼠治疗8d皮损大体表现
2凉血活血胶囊对咪喹莫特诱导小鼠银屑病样皮损动物模型组织学变化的影响
HE染色显示:治疗8 d后,对照组皮肤表皮层菲薄,仅2~3层。模型组表皮突延长,角化不全,表皮棘细胞层增厚,基底细胞核分裂像较多,可见Munro微脓肿,类似银屑病样的皮损形成。凉血活血胶囊组皮损中表皮层较平整,角化不全的细胞明显减少,表皮层厚度明显低于模型组。作用结果与雷公藤多苷组相似,见图3。通过测量表皮层的垂直厚度发现:模型组表皮层增厚明显,约为正常对照组小鼠表皮厚度的9~10倍,凉血活血胶囊组表皮增厚程度低,与模型组比较有显著差异(P<0.01),其中中剂量组抑制表皮增厚效果最为明显,见表1。
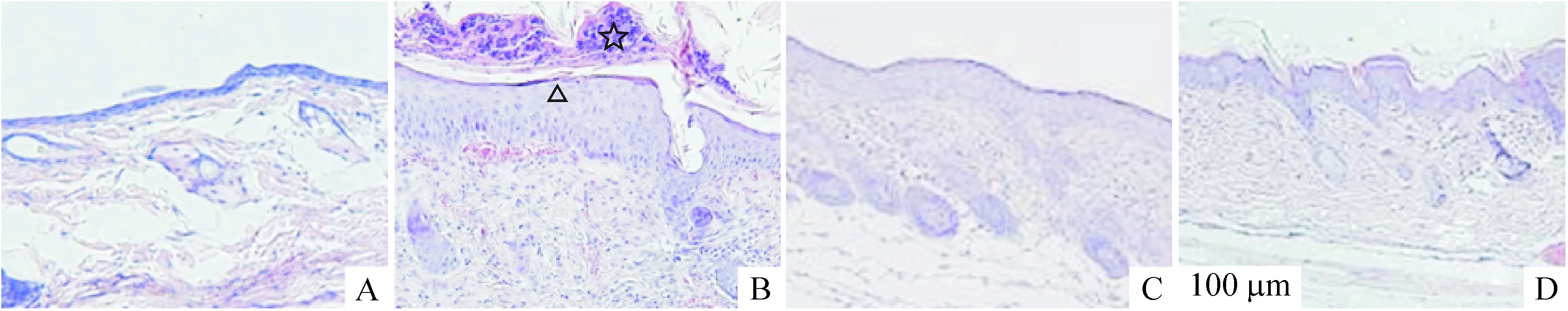
Figure 3. Histological changes of skin lesions of mice at day 8 of treatment (HE staining, ×200). A: normal group; B: model group; C: LXHX-M group; D: GTW group. ☆ indicates Munro microabscesses and △indicates parakeratosis.
图3各组小鼠治疗8d皮损组织学改变
表1各组治疗8d小鼠皮损表皮层厚度比较

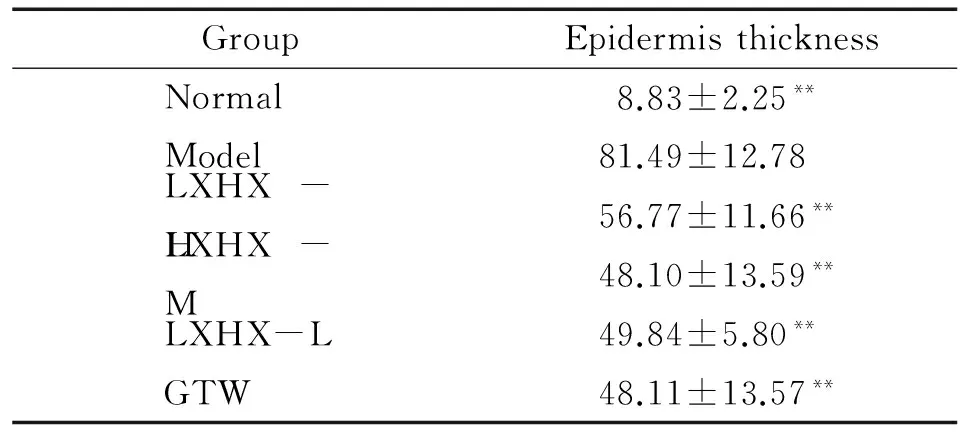
GroupEpidermisthicknessNormal8.83±2.25**Model81.49±12.78LXHX-H56.77±11.66**LXHX-M48.10±13.59**LXHX-L49.84±5.80**GTW48.11±13.57**
**P<0.01vsmodel.
3凉血活血胶囊对咪喹莫特诱导小鼠银屑病样皮损PCNA表达的影响
正常小鼠皮肤仅基底层细胞增殖明显,PCNA显色呈线状排列;模型组表皮着色细胞层数及数量明显增多,凉血活血胶囊组与雷公藤多苷组相似,着色细胞层数较模型组少,见图4。图像分析结果显示,凉血活血胶囊组PCNA的表达与模型组显著差异(P<0.01),见表2。
4凉血活血胶囊对咪喹莫特诱导小鼠银屑病样皮损炎症细胞浸润的影响
(1)模型组小鼠较对照组真皮层褐色沉淀颗粒(CD3、CD11c)明显增多,凉血活血胶囊组表达量显著低于模型组,其中中剂量组最为明显。雷公藤多苷组与凉血活血胶囊组结果相似,见图5。(2)与对照组相比,模型组的红色沉淀颗粒(F4/80、Gr-1)明显增多,而凉血活血胶囊组及雷公藤多苷组表达量要明显少于模型组,见图5。经图像分析结果表明,凉血活血胶囊组各检测指标表达量分别与模型组具有显著差异(P<0.01),见表2。
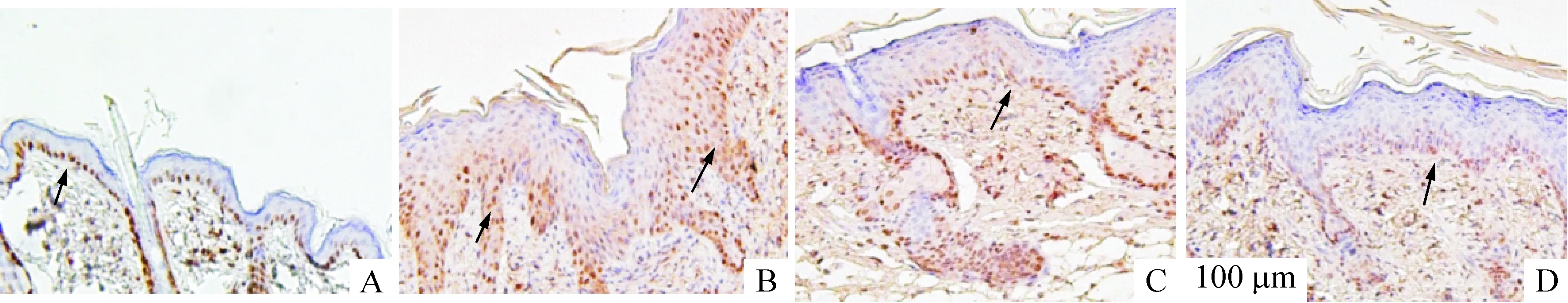
Figure 4. PCNA expression of skin lesions at day 8 of treatment (immunohistochemical staining, ×200). A: normal group; B: model group; C: LXHX-M group; D: GTW group. Arrow indicates PCNA positive expression.
图4各组小鼠治疗8d皮损PCNA表达
Figure 5. The expression of CD3,CD11c,F4/80 and Gr-1 in skin lesions at day 8 of treatment (immunohistochemical staining,×200). A: normal group; B: model group; C: LXHX-M group; D: GTW group. Arrows indicate positive expression.
图5各组小鼠治疗8d皮损CD3、CD11c、F4/80及Gr-1的表达
5凉血活血胶囊对咪喹莫特诱导小鼠银屑病样皮损血管内皮细胞增生的影响
与对照组相比,模型组皮损真皮中红色沉淀颗粒(CD31)明显增多,凉血活血胶囊组与雷公藤多苷组皮损沉淀少,见图6。图像分析结果表明,凉血活血胶囊组中CD31表达与模型组比较有显著差异(P<0.01),见表2。

Figure 6. CD3 expression in skin lesions at day 8 treatment (immunohistochemical staining, ×200). A: normal group; B: model group; C: LXHX-M group; D: GTW group. Arrows indicate positive expression.
图6各组治疗8d小鼠皮损CD31表达

表2 各组小鼠治疗8 d皮损PCNA、CD3、CD11c、F4/80、CD31及Gr-1的表达
**P<0.01vsmodel.
讨 论
银屑病为常见的以鳞屑性红斑为临床特点的慢性复发性炎症性皮肤病,现代医学定义其为免疫介导的器官特异性自身免疫性疾病[3]。虽然银屑病以表皮过度增殖为特征,但T淋巴细胞异常活化和浸润才是其发病的主要环节[4]。活化T细胞可通过多种途径诱导正常角质形成细胞过度增殖,并促释放细胞因子,进而增加强T细胞活性状态,同时细胞因子还影响表皮增生及凋亡调控基因的表达,最终导致银屑病皮损表现。
咪喹莫特是Toll样受体激动剂,主要通过活化先天性免疫系统和诱导多种细胞因子来增强细胞免疫,刺激机体发生免疫应答[5],在治疗合并有银屑病的光化性角化病和皮肤基底细胞癌时,可加重原以得到良好控制的银屑病症状。Leslie等将咪喹莫特外用于小鼠皮肤造成银屑病样的皮损变化[1],我们也证实了咪喹莫特可诱导制备银屑病样皮损模型:模型鼠皮肤在涂药后第2 d即出现淡红色斑点及少量细屑。随着药物作用,红斑色深增大,6 d达高峰,持续至8 d后缓慢消退(数据未显示);鳞屑变厚成层,8 d几乎覆盖全部暴露皮肤。皮损在4 d左右增厚明显,8 d达高峰。故本实验选择8 d作为疗效观察点,研究凉血活血胶囊的作用环节。
银屑病主要病理特征为表皮增殖活跃、角化不全、炎症细胞浸润、血管增生等。检测PCNA反映细胞增殖程度,CD3、CD11c、F4/80、Gr-1分别是T淋巴细胞、树突状细胞、巨噬细胞、中性粒细胞及单核细胞的标志物,可反映炎性细胞的浸润,CD31主要存在于内皮细胞表面,可反映血管增殖变化。通过分析发现,应用凉血活血胶囊治疗咪喹莫特诱导的银屑病样皮损,皮肤症状得以明显缓解,PASI积分显著降低;组织形态变化趋于正常,表皮角质形成细胞增殖减缓,角化不全的细胞减少;炎症浸润程度降低;新生血管数量减少。因此研究提示凉血活血胶囊有明显的抗炎作用,可能通过抑制树突细胞及淋巴细胞的激活,减轻皮损表皮和血管的变化,从而改善病理改变。此项研究为临床使用凉血活血胶囊治疗银屑病提供理论依据,而在治疗银屑病过程中凉血活血胶囊干预作用的靶点及通路则是我们今后继续研究的方向及重点。
[1] van der Fits L, Mourits S, Voerman JS, et al. Imiquimod-induced psoriasis-like skin inflammation in mice is mediated via the IL-23/IL-17 axis [J]. J Immunol, 2009, 182(9): 5836-5845.
[2] 孙丽蕴, 陈 凯, 邓丙戌, 等. 凉血活血胶囊治疗血热型银屑病的临床研究 [J]. 中国中西医结合皮肤性病学杂志, 2002, 1(1):16-18.
[3] Gaspari AA. Innate and adaptive immunity and the pathophysiology of psoriasis [J]. J Am Acad Dermatol, 2006, 54(3 Suppl 2):S67-S80.
[4] Nickoloff BJ, Schröder JM, von den Driesch P, et al. Is psoriasis a T-cell disease? [J]. Exp Dermatol, 2000, 9(5):359-375.
[5] Valins W, Amini S, Berman B. The expression of Toll-like receptors in dermatological diseases and the therapeutic effect of current and newer topical Toll-like receptor modulators [J]. J Clin Aesthet Dermatol, 2010, 3(9):20-29.
EffectofLiangXueHuoXuecapsulesonmousepsoriasis-likelesionsinducedbyimiquimod
DI Ting-ting, ZHAO Jing-xia, WANG Yan, LIU Xin, LIANG Dai-ying, LI Ping
(DepartmentofPathophysiology,BeijingInstituteofTraditionalChineseMedicine,BeijingHospitalofTraditionalChineseMedicineAffiliatedtoCapitalMedicalUniversity,Beijing100010,China.E-mail:liping411@yahoo.com.cn)
AIM: To observe the effects of Liang Xue Huo Xue (LXHX) capsules on mouse psoriasis-like lesions induced by imiquimod (IMQ).METHODSBALB/c female mice (n=48) were randomly divided into 6 groups: normal group, model group, LXHX capsules groups with high, medium or low doses, and glycosides ofTripterygiumwilfordii(GTW) group. On day 8, skin lesions were determined by pathological examination. The lesions were evaluated according to the psoriasis area and severity index (PASI). The histology and epidermal thicknesses were observed under light microscope. The expression of proliferating cell nuclear antigen (PCNA) was detected by immunohistochemical staining. Meanwhile, the positive expression of CD3, CD11c, F4/80, CD31 and Gr-1 was counted by immunohistochemical staining.RESULTSCompared with model group, the cutaneous symptoms in LXHX capsules groups were alleviated, with PASI scores decreased, epidermal parakeratosis and epidermal over-proliferation relived, the numbers of dermal T lymphocytes, dendritic cells, macrophages, neutrophils and monocytes reduced significantly.CONCLUSIONLXHX capsules improve imiquimod-induced mouse psoriasis-like lesions by inhibiting over-proliferation of keratinocytes, parakeratosis, inflammatory infiltration and angiogenisis.
Psoriasis; Imiquimod; Liang Xue Huo Xue capsules
R363
A
10.3969/j.issn.1000-4718.2012.04.024
