新西兰兔糖尿病肾病模型的建立方法*
2012-11-06陈小明黄丹丹李自成
陈小明, 黄丹丹, 李自成
(暨南大学附属第一医院心内科,广东 广州 510632)
1000-4718(2012)04-0765-04
2011-12-22
2012-02-24
广东省医学科学技术研究基金资助项目(No. WSTJJ20081120420111197405185045);暨南大学第一临床医学院重点学科基金项目(No.暨一临[2010]4);广东省科技计划项目(No.2010-1096-136)
△通讯作者 Tel: 020-38688620; E-mail:zichengli@163.net
新西兰兔糖尿病肾病模型的建立方法*
陈小明, 黄丹丹, 李自成△
(暨南大学附属第一医院心内科,广东 广州 510632)
目的探讨小剂量四氧嘧啶(ALX)建立新西兰兔糖尿病肾病(diabetic nephropathy,DN)模型的可行性。方法雄性新西兰兔20只,8只为对照组,给予常规饲料,12只为糖尿病组,给予高糖高脂饮食(常规饲料加5%蔗糖、5%猪油和1%胆固醇)喂养2周,再加用小剂量ALX耳缘静脉注射,分别检测造模前与造模12周后兔血糖、血脂、尿蛋白和肾功能指标,并于12周后进行组织形态学观察。结果建模成功动物具有“多饮、多食、多尿、体重减轻”的特点,并出现DN相应的形态及功能改变。结论高脂高糖饮食加ALX药物诱导的方法,12 周时可成功制备新西兰兔2型DN模型。
新西兰兔; 糖尿病肾病; 四氧嘧啶; 模型,动物
糖尿病肾病(diabetic nephropathy,DN)是糖尿病常见的慢性并发症之一,在糖尿病人群中的发生率为20%~40%。在西方国家人群中,DN已成为终末期肾功能衰竭(end-stage renal disease, ESRD)的主要原因,也是糖尿病致命的主要原因。我国DN发病率也呈逐年增多趋势,越来越成为亟待解决的肾脏病。然而,糖尿病肾病的病因和发病机制极为复杂,迄今尚未完全明了[1-2]。在对DN进行机制研究时,比较生物学的方法是很重要的研究手段,因此,建立适当的动物模型,不仅为研究糖尿病肾病的病因、发病机制和病理生理改变提供重要线索,而且能促进药物作用机制的研究和临床药物的开发。目前国内多用鼠类DN模型进行研究,而新西兰兔较鼠类存活率高,模型稳定,重复性好,且抗病性强,利于反复采血,方便灌胃及静脉注射药物干预、便于进行组织器官影像学检查。本实验旨在应用高糖高脂饮食诱发胰岛素抵抗,再以小剂量四氧嘧啶(alloxan, ALX)破坏兔胰岛细胞形成糖尿病,探讨新西兰兔2型DN模型的建立方法。
材 料 和 方 法
1动物
清洁级雄性新西兰兔20只(由广东省实验动物中心提供),许可证号为SCXK(粤)2008-0002。体重2.0~2.5 kg。随机分成糖尿病组(A组,12只)和对照组(B组,8只)。
2主要试剂
ALX和胆固醇均购自Sigma,血糖测定采用强生公司One TouchⅡ血糖仪和试纸条。基础饲料购自广东省实验动物中心,高脂饲料由广东省暨南大学实验动物中心加工形成。生化检测由暨南大学附属第一医院检验科完成。
3方法
3.1饮食诱发胰岛素抵抗 B组(对照组)喂以常规饲料(蛋白质31.10%,脂肪7.79%,其它61.11%),A组(糖尿病组)喂以高糖高脂饲料(常规饲料加5%蔗糖、5%猪油和1%胆固醇)。适应性饲养2周后,测空腹血糖(fasting blood glucose,FBG)及血脂、超敏C反应蛋白(high-sensitivity C-reactive protein, hs-CRP)、肌酐水平,血标本在耳缘静脉采取。胆固醇和甘油三酯水平较空白组升高者考虑诱发胰岛素抵抗[3]。在预实验中兔进食含2%胆固醇、10%猪油和5%蔗糖的高脂饲料后有猝死或中风瘫痪,考虑到兔为草食性动物,且ALX造成胰腺损伤,不能适应高脂饲料,遂调整高脂配方为常规饲料加5%蔗糖、5%猪油和1%胆固醇。
3.2小剂量ALX注射诱导糖尿病 适应性喂养2周后,A组动物禁食水12 h后,耳缘静脉注射ALX 50 mg/kg,隔天禁食水12 h后再耳缘静脉注射ALX 100 mg/kg(均以注射用水配成5%浓度),注药后24 h内因胰岛细胞破坏,大量胰岛素入血,动物会出现严重低血糖,注药后48 h内给予10%葡萄糖水自由摄取,帮助其渡过低血糖期,注药48~72 h后血糖即升高,第1周需要密切监测血糖,若有超过30 mmol/L者给予普通胰岛素(1~2U/kg)皮下注射以帮助其渡过血糖紊乱期(视血糖波动情况调整用量)。B组动物仅注射等量注射用水。注射ALX 1周后,随机血糖大于16.7 mmol/L者入选为糖尿病组,继续原饲料喂养。
4指标与测定方法
分别于注射ALX前及注射ALX 12周后收集血尿标本,用自动生化仪检测血糖、血甘油三酯、胆固醇、高密度脂蛋白、低密度脂蛋白、血肌酐(serum creatinine, SCr)、尿微量白蛋白等指标。注射ALX 12周后,处死动物,立即打开腹腔游离肾脏,于10%中性甲醛液中固定,脱水、包埋、切片。行HE染色,光镜下观察其形态学改变。
5判断标准
2型DN兔需具备以下条件:(1)有“多饮、多食、多尿、体重减轻”症状,随机血糖≥16.7 mmol/L;(2) 出现蛋白尿、肾功能异常及相应肾脏组织病理学特征。
6统计学处理
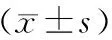
结 果
1新西兰兔糖尿病模型建模
与空白组对比,糖尿病组兔注射ALX后出现三多一少、脱毛、活动减少等症状;其中1只兔在ALX注射后12 h死于低血糖,1只兔在实验结束前死于感染;部份动物在注射ALX 1个月后血糖逐渐下降,可能与胰岛细胞修复有关。全程给予5~10%葡萄糖水(浓度依个体血糖而定)自由饮用有利于保持模型稳定,2只兔在实验结束时血糖低于16.7 mmol/L。实验期间动物低血糖死亡率为8.3% (1/12),糖尿病模型建模率为91.7% (11/12),糖尿病成模后的死亡率为9%(1/11)。
2对比实验中兔各项指标
可见糖尿病组兔在成模12周后血糖明显升高(P<0.05),出现肾功能损害,尿蛋白异常,见表1。

表1 两组兔子血生化及尿蛋白测定结果
DM: diabetes mellitus; hs-CRP: high-sensitivity C-reactive protein; BUN: blood urea nitrogen; SCr: serum creatinine; UMA: urine microalbumin.*P<0.05vscontrol group (12 weeks);#P<0.05vsDM group (2 weeks).
3肾脏形态学改变
成模后12周空白组肾脏均未见病理改变;DM组肾小球毛细血管袢呈分叶状,基底膜及系膜基质增生;肾小管部分基底膜增厚,上皮细胞肿胀、颗粒变性,见图1。10只成模新西兰兔肾组织均有病理改变,糖尿病肾病成模率为83.3% (10/12)。
讨 论
目前DN建模方式[4]有:(1)化学药物诱导的糖尿病肾病模型:STZ用于SD大鼠[5-7],或联合高脂高糖饮食诱导胰岛素抵抗[8],造模周期4~24周,期间模型的保持较难,动物容易死于血糖波动及感染。亦可单侧肾脏切除后加重对侧肾脏负担,多因素综合作用加速糖尿病肾病形成,但动物在术后死亡率较高,且术后使用到抗生素等药物,可能对肾脏有额外影响。(2)自发性糖尿病肾病模型:NOD(non-obesity diabetes)小鼠和LETL大鼠均可作为1型DM的动物模型使用。2型DM自发性动物模型有db/db小鼠、KKAy小鼠、OLETF大鼠、Zucker鼠[9],db/db小鼠[10-11],此类动物种类有限,饲养条件要求高,发病率低,病程长,价格昂贵,但在一定程度上减少了人为因素,更接近自然的人类疾病。(3)基因工程糖尿病肾病模型:Smad3敲除小鼠[12]、eNOS敲除鼠,转基因RAGE小鼠、转基因OVE26小鼠等,制备该动物模型对技术要求高、价格昂贵等,限制了该类模型的应用,但用基因工程方法建立动物模型仍然是未来各种动物模型研究的方向。
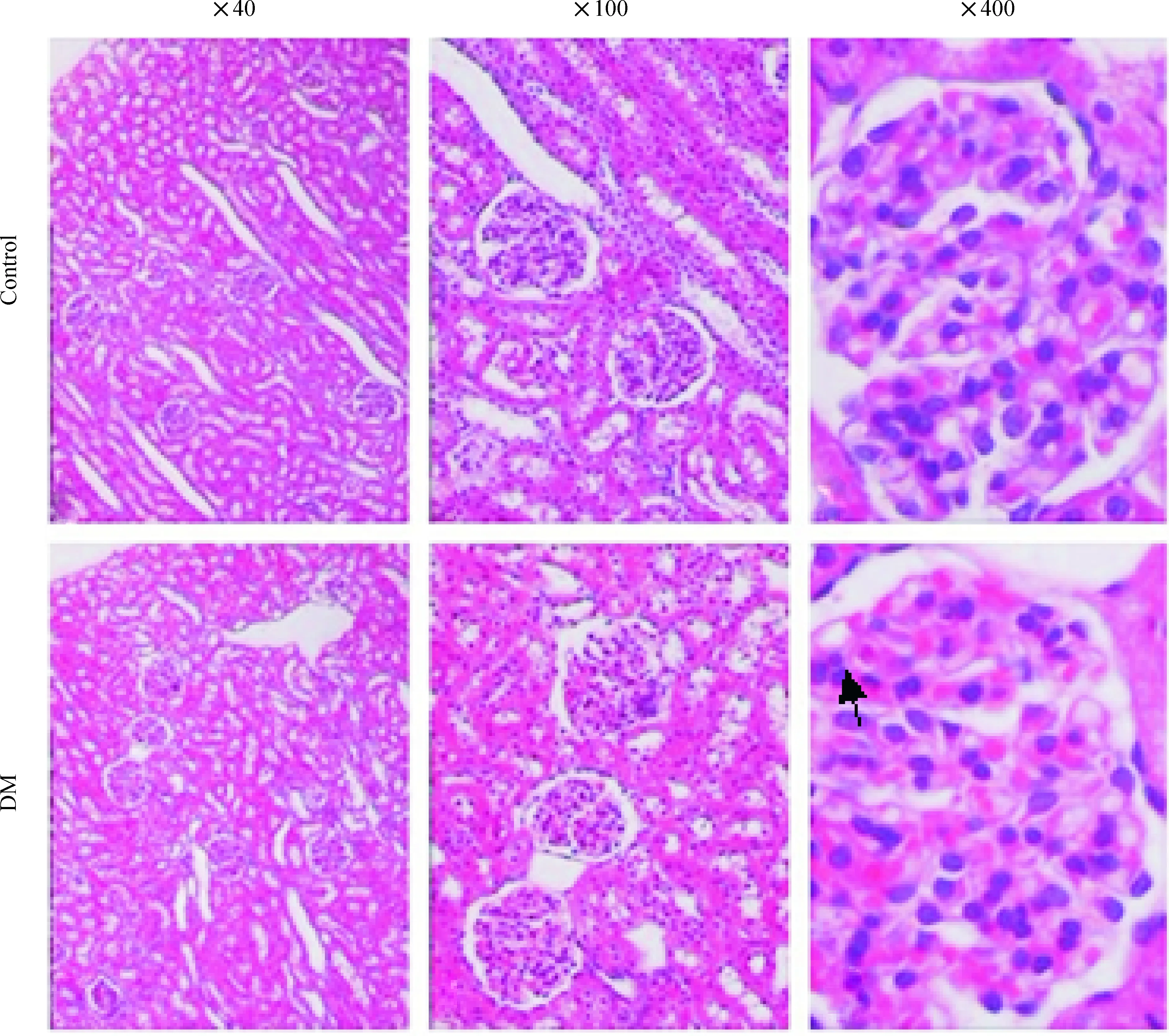
Figure 1. Photomicrographs of renal tissues of New Zealand rabbits in the two groups (HE staing).The arrow indicates the dilation of renal tube.
图1两组兔肾脏病理HE染色结果
鼠类抗病性较差,不利于反复采血、灌胃及静脉注射等干预手段,体积小不利于影像学检查如脏器超声检查、血管介入检查及干预等,部分模型造价极高,故如何科学简便地制备糖尿病肾病动物模型就显得越发重要。兔DN模型的建立方法值得探讨。朱昆等[13]曾使用ALX 100 mg/kg诱发兔糖尿病模型并联系胰岛素管理8周建立糖尿病肾病模型,其低血糖率为20%,死亡率为10%,血糖升高率为83.3%,糖尿病成模后的死亡率为10%,糖尿病肾病成模率为63.3%。本文参考文献报道,在此基础上进行改进,先喂以高糖高脂饮食,诱发出胰岛素抵抗,再继以适量ALX注射,从而产生高血糖、形成肾脏病变。实验期间动物低血糖死亡率为8.3%,血糖升高率为100%,糖尿病成模后的死亡率为9%,糖尿病肾病成模率为66.7%。本实验改进点为:(1)注射ALX后24~48 h给予葡萄糖饮用,严重低血糖者需要静脉注射50%葡萄糖液,避免低血糖引起死亡。(2)只在注射ALX后1周内使用胰岛素管理。过多地使用胰岛素对高血糖水平保持不利,血糖维持不到12周即下降。(3)糖尿病模型成立后根据个体血糖水平给予5%~10%葡萄糖水自由饮用,维持高糖高脂饮食,有利于高血糖的保持。(4)ALX分2次(ALX 50 mg/kg及隔日ALX 100 mg/kg)注射可以增加动物的适应性,保证血糖升高率。
尽管本实验所建立的模型极力模仿2型糖尿病患者的病程及临床特征,但作为一种尚处于实验研究阶段的新的动物模型,该模型肾脏形态学变化与人类2型DN对比未见典型肾小球结节,系膜基质增加及外周毛细血管渗出不明显,有一定的差异。总体来说,该模型较好地模拟了2型糖尿病的发病过程,并出现了明显糖尿病肾脏病变。作为一种较经济的2型DN模型,可用于DN发病机制及其药物治疗学方面的研究。
[1] 孙爱丽,胡晓燕,关广聚,等.尿胞外体亮氨酸氨基肽酶及二肽基肽酶在糖尿病肾病中的变化[J].中国病理生理杂志,2011,27(4):775-778.
[2] 李志杰,张 悦,刘煜敏,等.黄芪多糖对早期糖尿病肾病大鼠足细胞nephrin和podocin表达的影响[J].中国病理生理杂志,2011,27(9):1772-1776.
[3] 陆泽元,林怿昊,邵 豪,等.反映胰岛素抵抗的最佳血脂指标探讨[J].中国实用内科杂志,2005,25(6):512-513.
[4] 李志杰,张 悦. 糖尿病肾病动物模型的研究进展[J]. 生命科学, 2011,23(1):90-95.
[5] 杨亦彬,张 翥,苏克亮.链脲佐菌素诱导大鼠糖尿病肾病模型的方法学探讨[J].华西医学,2005,20(2):299-300.
[6] 李 伟,张 红,殷松楼.不同剂量链脲佐菌素诱导SD大鼠糖尿病肾病模型的研究[J].徐州医学院学报,2006,26(1):52-55.
[7] Sun SZ,Wang Y,Li Q,et al.Effects of benazepril on renal function and kidney expression of matrix metalloproteinase-2 and tissue inhibitor of metalloproteinase-2 in diabetic rats[J].Chin Med J (Engl),2006,119(10):814-821.
[8] 李桂云,吴正治.STZ建立2型糖尿病大鼠模型的剂量探讨[J].深圳中西医结合杂志,2007,17(2):74-77.
[9] Reisin E,Ebenezer PJ,Liao J,et al.Effect of the HMG-CoA reductase inhibitor rosuvastatin on early chronic kidney injury in obese Zucker rats fed with an atherogenic diet[J].Med Sci,2009,338(4):301-309.
[10]Sharma K,McCue P,Dunn SR.Diabetic kidney disease in the db/db mouse[J].Am J Physiol Renal Physiol,2003,284(6):F1138-F1144.
[11]Huang Y,Border WA,Yu L,et al.A PAI-1 mutant,PAI-1R,slows progression of diabetic nephropathy[J]. Soc Nephrol, 2008,19(2):329-338.
[12]Wang A,Ziyadeh FN,Lee EY,et al.Interference with TGF-β signaling by Smad3-knockout in mice limits diabetic glom-erulosclerosis without affecting albuminuria[J].Am J Physiol Renal Physiol,2007,293(5):F1657-F1665.
[13]朱 昆, 潘洪涛, 罗 萍,等. 四氧嘧啶诱发兔糖尿病模型的胰岛素管理及糖尿病肾病模型建立[J]. 吉林医学,2006,27(9):1010-1011.
ConstructionofaNewZealandrabbitmodelofdiabeticnephropathy
CHEN Xiao-ming, HUANG Dan-dan, LI Zhi-cheng
(DepartmentofCardiology,TheFirstAffiliatedHospitalofJinanUniversity,Guangzhou510632,China.E-mail:zichengli@163.net)
AIM: To establish a method to produce animal model of diabetic nephropathy (DN) in New Zealand rabbits using alloxan (ALX).METHODSTwenty male New Zealand rabbits were randomly divided into 2 groups: 8 rabbits in control group were fed with conventional feed such as buffer solution;12 in diabetes milleuts (DM) group were fed with high-sugar and high-fat diet (conventional feed plus 5% sucrose, 5% pork fat and 1% cholesterol) for 2 weeks, then intravenous injection of ALX at 50 mg/kg was given, and another dosage of 100 mg/kg ALX was intravenously injected after 48 h. The levels of blood glucose, blood cholesterol, triglyceride, urine microalbumin, and serum creatinine were detected before and 12 weeks after the processes of modeling. After 12 weeks, the rabbits were sacrificed,and the kidneys were taken for pathological examination.RESULTSThe successful model of DN in the rabbits had the characteristics of high blood glucose, abundant urine microalbumin (P<0.01), and corresponding morphological and functional changes of the kidneys.CONCLUSIONRabbits with high-sugar and high-fat diet plus twice intravenous injection of ALX at a total dose of 150 mg/kg (50 mg/kg and 100 mg/kg, respectively) shows low mortality and stable diabetes mellitus state. This method induces a typical DN model in 12 weeks.
New Zealand rabbits; Diabetic nephropathies; Alloxan; Models,animal
R332
A
10.3969/j.issn.1000-4718.2012.04.035
