辛伐他汀对香烟烟雾提取物诱导的人脐静脉内皮细胞表达sEPCR和mEPCR的影响*
2012-11-06樊芳芳胡晓芸扈丽娟韩葆芬赵瑛娟
樊芳芳, 胡晓芸, 扈丽娟, 韩葆芬, 赵瑛娟
(山西医科大学第一医院呼吸内科,山西 太原 030001)
1000-4718(2012)04-0727-03
2011-10-17
2011-12-31
山西省卫生厅科技攻关计划项目(No.20100201)
△通讯作者 Tel:0351-4639901;E-mail:huxiaoyunly@sina.com
辛伐他汀对香烟烟雾提取物诱导的人脐静脉内皮细胞表达sEPCR和mEPCR的影响*
樊芳芳, 胡晓芸△, 扈丽娟, 韩葆芬, 赵瑛娟
(山西医科大学第一医院呼吸内科,山西 太原 030001)
目的研究辛伐他汀对香烟烟雾提取物(CSE)诱导的人脐静脉内皮细胞(HUVECs) 表达可溶性内皮细胞蛋白C受体(sEPCR)和膜联内皮细胞蛋白C受体(mEPCR)的干预作用。方法体外培养的4~6代HUVECs 随机分为对照组、5%CSE组、不同浓度辛伐他汀组及辛伐他汀干预组,辛伐他汀组分别加入50、100、200 μmol/L辛伐他汀液孵育24 h,辛伐他汀干预组先以50、100、200 μmol/L辛伐他汀预处理细胞2 h,再与5%CSE孵育24 h。收集各组细胞及上清液,ELISA法检测上清液中sEPCR蛋白含量,实时定量PCR法检测各组细胞中mEPCR mRNA的表达。结果(1)5%CSE组sEPCR蛋白含量高于对照组,mEPCR mRNA表达低于对照组,差异均有统计学意义(均P<0.05);(2)100 μmol/L与200 μmol/L辛伐他汀组sEPCR蛋白含量均高于对照组,低于5%CSE组,其mEPCR mRNA表达均低于对照组,高于5%CSE组,差异均有统计学意义(均P<0.05);(3)各辛伐他汀干预组sEPCR蛋白含量均低于5%CSE组,但高于对照组及相应浓度的辛伐他汀组;相反,各辛伐他汀干预组mEPCR mRNA表达均高于5%CSE组,低于对照组及相应浓度的辛伐他汀组,差异均有统计学意义(均P<0.05)。结论在体外,辛伐他汀通过上调HUVECs mEPCR mRNA的表达,降低sEPCR的分泌,对CSE介导的内皮细胞凝血功能障碍可能具有一定的改善作用。
香烟烟雾提取物; 内皮细胞蛋白C受体; 人脐静脉内皮细胞
近年来,内皮细胞蛋白C受体(endothelial cell protein C receptor,EPCR)与血栓形成的关系引起学术界的高度重视。当各种因素导致内皮细胞受损时,膜联EPCR(membrane-associated EPCR,mEPCR)从内皮细胞脱落,致使可溶性EPCR(soluble EPCR,sEPCR)浓度升高,使血栓形成的风险显著增加。 因此,测定sEPCR成为反映血栓形成的敏感指标之一[1]。辛伐他汀除其调脂作用之外,还具有内皮保护、抗凝、抑制血小板聚集与抗炎等作用[2]。本实验通过观察不同浓度辛伐他汀对香烟烟雾提取物(cigarette smoke extract,CSE)诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)sEPCR蛋白及mEPCR mRNA表达的影响,探讨其对CSE介导的HUVECs凝血功能的干预作用。
材 料 和 方 法
1材料
HUVECs株购自上海门谍塔生物科技发展有限公司,为ATCC来源细胞株。RPMI-1640培养基、胰蛋白酶、HEPES均购自Gibco,胎牛血清(fetal bovine serum,FBS)购自杭州四季青公司,青霉素、链霉素均购自华北制药股份有限公司,辛伐他汀为默沙东公司产品。人sEPCR ELISA试剂盒购自上海西唐公司,PCR引物、Trizol RNA提取试剂盒、内参照β-actin引物均由上海生工生物工程公司合成,SYBR Green 购自Roche。
2方法
2.1CSE的制备 参照Nakamura等[3]方法,将2支过滤嘴香烟用一个注射器驱动装置连续抽吸而燃着,每支烟吸5 min,以-5 cmH2O(1 cmH2O=0.098 kPa)的负压持续吸引,产生的烟雾经三通管的另一负压驱动出口溶于50 mL无血清培养液中制成悬液,用1 mol/L的NaOH调pH至7.4,经0.22 μm微孔滤膜过滤,于30 min之内用于实验。
2.2辛伐他汀干预药物的制备 将脂溶性辛伐他汀片4.3259 mg(40 mg/片,默沙东中国有限公司,相对分子质量432.59)溶于100 μL无水乙醇,加入150 μL NaOH(1 mol/L)50 ℃温育2 h,用0.1mol/L HCl调pH至7.2,加双蒸水至10 mL,即制得终浓度为1 mmol/L的储存液。经0.22 μm微孔滤器过滤,4 ℃保存,备用。
2.3HUVECs的培养与分组 用含10%FBS的RPMI-1640培养液,在37 ℃、5%CO2培养箱中孵育细胞,隔日换液1次,当细胞生长至亚融合状态时,用0.25%胰蛋白酶消化液以1∶2传代,接种于25 cm2培养瓶中,待细胞达80%融合后,换无血清培养基继续孵育24 h,使细胞同步化。贴壁细胞随机分为8组:(1)CSE组:培养瓶中加入150 μL的CSE,加RPMI-1640培养液至3 mL,使其终浓度为5%CSE;(2)对照组(阴性对照):培养液中加入与CSE组相同体积的无菌PBS液;(3)辛伐他汀组(阳性对照):培养液中分别加入50、100、200 μmol/L 辛伐他汀液;(4)辛伐他汀干预组:先分别于培养液中加入50、 100、 200 μmol/L辛伐他汀预孵育2 h,再加入5% CSE孵育。以上各组共同培养24 h,分别收集细胞及上清液用于实验。
2.4酶联免疫吸附双抗体夹心分析法(enzyme linked-immunosorbent assay,ELISA)检测sEPCR的含量 实验操作严格按试剂盒说明步骤进行。sEPCR标准品浓度分别为4 000、2 000、1 000、500、250、125、62.5 ng/L。
2.5Real-time RT-PCR检测mEPCR mRNA的表达 按Trizol试剂盒说明提取细胞总RNA。取6 μL的总RNA按转录试剂盒说明逆转录为相应的cDNA,PCR扩增mEPCR和β-actin(作为内参照)。mEPCR上游引物5’-GGTGTGGCTGTAGGCATCTT-3’,下游引物5’-CTCCCCTCCCTCAAATCTTC-3’。β-actin上游引物5’-GGACTTCGAGCAAGAGATGG-3’,下游引物5’-AGCACTGTGTTGGCGTACAG-3’。反应体系为10×buffer 5 μL,dNTP(10 mmol/L)1 μL,正反向引物各0.5 μL,Taq 酶 0.5 μL,SYBR Green 25 μL,DEPC-H2O 19.0 μL混匀。PCR反应条件为:94 ℃预变性180 s,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,共反应35个循环。ABI Prism 7300SDS软件记录数据并分析,将目的基因的Ct用β-actin的Ct值进行标准化,根据比较法计算基因表达相对量,采用2-ΔΔCt计算基因表达的相对倍数变化。
3统计学处理
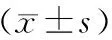
结 果
1HUVECs形态观察
倒置相差显微镜下HUVECs可见细胞由均匀悬浮状态逐渐贴壁,细胞形态不规则,呈扁平、椭圆形、梭形或多角形,为单层鹅卵石镶嵌样排列,细胞单层融合时呈典型的“铺路石”样外观。
25%CSE对HUVECs表达sEPCR蛋白与mEPCRmRNA的影响
对照组HUVECs可表达一定量的mEPCR mRNA,上清液中存在少量sEPCR,5%CSE干预后其mEPCR mRNA表达明显减少,sEPCR蛋白含量增多,各组比较见表1。
3辛伐他汀对HUVECs表达sEPCR蛋白与mEPCRmRNA的影响
一定浓度的辛伐他汀可影响HUVECs表达sEPCR蛋白与mEPCR mRNA,其与对照组及5%CSE组的比较结果见表1。两两比较提示, 50 μmol/L辛伐他汀组mEPCR mRNA表达与对照组相比差异无统计学意义(P>0.05);100、200 μmol/L辛伐他汀组mEPCR mRNA表达高于对照组,差异有统计学意义,200 μmol/L辛伐他汀组mEPCR mRNA表达高于100 μmol/L辛伐他汀组,差异有统计学意义(均P<0.05)。各辛伐他汀组mEPCR mRNA表达均高于5%CSE组,差异均有统计学意义(均P<0.05)。sEPCR蛋白表达与mEPCR mRNA呈相反变化。
表1各组HUVECssEPCR蛋白和mEPCRmRNA含量的比较


GroupsEPCRprotein(ng/L)mEPCRmRNAControl1071.197±54.3031.185±0.0725%CSE2239.153±52.271*0.206±0.073*50μmol/Lsimvastatin1133.247±39.412△1.061±0.048*△100μmol/Lsimvastatin1243.353±52.308*△0.956±0.011*△200μmol/Lsimvastatin1355.143±48.820*△0.861±0.052*△5%CSE+50μmol/Lsimvastatin1825.540±116.535*△0.484±0.029*△5%CSE+100μmol/Lsimvastatin1377.197±51.083*△#0.718±0.037*△#5%CSE+200μmol/Lsimvastatin1553.810±46.911*△#0.843±0.026*△#
*P<0.05vscontrol;△P<0.05vs5%CSE;#P<0.05vs5%CSE+50 μmol/L simvastatin.
4辛伐他汀对CSE介导HUVECs表达sEPCR蛋白与mEPCRmRNA的干预作用
各浓度辛伐他汀干预组sEPCR蛋白含量均低于5%CSE组,但仍高于对照组及相对应浓度的辛伐他汀组;相反,各浓度辛伐他汀干预组mEPCR mRNA表达均高于5%CSE组,但仍低于对照组及相对应浓度的辛伐他汀组,差异均有统计学意义(均P<0.05)。辛伐他汀对CSE介导HUVECs 表达mEPCR mRNA的干预作用在一定范围内呈浓度依赖性。而对其表达sEPCR蛋白的干预作用虽在一定范围内呈浓度依赖性,但以100 μmol/L辛伐他汀干预组作用最明显,见表1。
讨 论
蛋白C(protein C,PC)是在抗凝过程中发挥重要作用的一种维生素K依赖性丝氨酸蛋白酶原[4]。在凝血酶-血栓调节蛋白复合物激活下,蛋白C转化为活化蛋白C(activated protein C,APC),与辅因子蛋白S结合,从而灭活凝血因子Va和VIIIa,发挥抗凝作用[5]。EPCR是最近被发现并获得成功克隆表达的一个新的内皮细胞受体,是体内蛋白C系统发现的新成员[6]。EPCR有mEPCR和sEPCR两种存在形式,mEPCR无直接抗凝活性,通过与蛋白C结合并将其呈递给凝血酶-血栓调节蛋白复合物,增加PC/APC的活性,从而提高PC的活化率[7]。sEPCR具有抑制PC/APC活性的作用[8],通过抑制PC的活化,抑制APC对凝血因子Va和VIIIa的灭活作用[8]。sEPCR与mEPCR是一对在凝血过程中作用相反的物质,血浆中sEPCR升高或mEPCR减少均可导致抗凝机制受抑。
我们曾对CSE介导HUVECs纤溶活性的变化及其作用机制进行研究[9-10],发现5%CSE具有纤溶抑制作用。CSE是否对内皮细胞的凝血功能也有影响,目前报道不多。因EPCR表达具有组织特异性,在胎盘、肺、肝和心肌组织呈高表达[11],故本实验选用HUVECs作为细胞模型,研究CSE对内皮细胞sEPCR与mEPCR表达的影响。结果表明,CSE干预HUVECs后, 其mEPCR mRNA表达降低, sEPCR蛋白分泌增高,提示CSE可引起内皮细胞凝血功能障碍。与Menschikowski等[12]研究结果一致。
目前认为,辛伐他汀除其调脂作用之外,还具有内皮保护、抗凝、抑制血小板聚集与抗炎等作用。辛伐他汀是否可以改善CSE介导的内皮细胞凝血功能障碍,尚未见报道。本实验结果显示,辛伐他汀干预组内皮细胞mEPCR mRNA的表达较5%CSE组升高,而sEPCR的含量则降低,提示辛伐他汀可能从基因与蛋白水平影响CSE介导的内皮细胞凝血功能。
[1] Navarro S, Bonet E, Estelles A, et al. The endothelial cell protein C receptor: Its role in thrombosis[J]. Thromb Res,2011, 128(5):410-416.
[2] 周 娟, 朱健华, 潘 闽.辛伐他汀对大鼠心肌组织中低氧诱导因子1α表达的影响[J]. 中国病理生理杂志, 2007, 23(4):813-817.
[3] Nakamura Y, Romberger DJ, Tate L, et al.Cigarette smoke inhibits lung fibroblast proliferation and chemotaxis[J]. Am J Respir Crit Care Med, 1995, 151(5):1497-1503.
[4] Dahlbäck B, Stenflo J. Inhibitory effect of activated protein C on activation of prothrombin by platelet-bound factor Xa[J]. Eur J Biochem,1980,107(2):331-335.
[5] Rezaie AR. Regulation of the protein C anticoagulant and antiinflammatory pathways[J]. Curr Med Chem,2010,17(19):2059-2069.
[6] Esmon CT.The discovery of the endothelial cell protein C receptor[J].J Thromb Haemost,2010,8(1):2-5.
[7] Taylor FB Jr, Peer GT, Lockhart MS, et al. EPCR plays an important role in protein C activationinvivo[J]. Blood, 2001, 97 (6): 1685-1688.
[8] Liaw PC, Neuenschwander PF,Smirnov MD, et al. Mechanisms by which soluble endothelial cell protein C receptor modulates protein C and activated protein C function[J]. J Biol Chem,2000,275(8):5447-5452.
[9] Hu XY, Ma YH, Wang C, et al. Effects of simvastatin on cigarette smoke extract induced t-PA and PAI-1 expression in human umbilical vein endothelial cells[J]. Chin Med J(Engl), 2009,122(19): 2380-2385.
[10]扈丽娟, 胡晓芸, 杜 艳,等.辛伐他汀对尼古丁诱导脐静脉内皮细胞分泌t-PA和PAI-1的影响[J].中国病理生理杂志, 2011, 27(3): 460-463.
[11]Gu JM, Katsuura Y, Ferrell GL, et al. Endotoxin and thrombin elevate rodent endothelial cell protein C receptor mRNA levels and increase receptor sheddinginvivo[J].Blood, 2000, 95(5):1687-1693.
[12]Menschikowski M, Hagelgans A, Eisenhofer G, et al.Regulation of endothelial protein C receptor shedding by cytokines is mediated through differential activation of MAP kinase signaling pathways[J].Exp Cell Res, 2009, 315(15): 2673-2682.
Effectsofsimvastatinoncigarettesmokeextract-inducedsEPCRandEPCRexpressioninhumanumbilicalveinendothelialcells
FAN Fang-fang, HU Xiao-yun, HU Li-juan, HAN Bao-fen, ZHAO Ying-juan
(DepartmentofRespiratoryMedicine,TheFirstAffiliatedHospital,ShanxiMedicineUniversity,Taiyuan030001,China.E-mail:huxiaoyunly@sina.com)
AIM: To investigate the effects of simvastatin on cigarette smoke extract (CSE)-induced expression levels of soluble endothelial cell protein C receptor (sEPCR) and membrane-associated endothelial cell protein C receptor (mEPCR ) in human umbilical vein endothelial cells (HUVECs).METHODSCultured HUVECs at passage 4 to 6 were randomly divided into control group, 5% CSE group, simvastatin groups and simvastatin+CSE groups. In simvastatin groups, HUVECs were incubated with simvastatin at the concentrations of 50, 100 and 200 μmol/L for 24 h. In simvastatin+CSE groups, the cells were treated with simvastatin at the concentrations of 50, 100 and 200 μmol/L for 2 h, and then exposed to CSE for 24 h. The protein level of sEPCR in the culture supernatants was measured by ELISA. The cells were collected for determining the mRNA expression of mEPCR by real-time PCR.RESULTSCompared with control group, the protein level of sEPCR was significantly increased, and the mRNA expression of mEPCR was significantly decreased in 5% CSE group (bothP<0.05) . The protein levels of sEPCR were significantly increased, and the mRNA expression of mEPCR was significantly decreased in 100 μmol/L and 200 μmol/L simvastatin groups. However, the protein levels of sEPCR were lower, and the mRNA expression of mEPCR was significantly higher in 100 μmol/L and 200 μmol/L simvastatin groups than those in 5% CSE group. Compared with 5% CSE group, the protein levels of sEPCR in simvastatin+CSE groups were significantly decreased, but higher than those in control group and simvastatin group with corresponding concentration. On the contrary, the mRNA expression of mEPCR in simvastatin+CSE groups was significantly increased, but lower than that in control group and simvastatin group with corresponding concentration (allP<0.05).CONCLUSIONSimvastatin obviously increases the mRNA expression of mEPCR, decreases the protein level of sEPCR, and attenuates the CSE-induced endothelial injuryinvitro.
Cigarette smoke extract; Endothelial cell protein C receptor; Human umbilical vein endothelial cells
R363
A
10.3969/j.issn.1000-4718.2012.04.026
