乙型肝炎病毒X蛋白通过降低P4启动子甲基化水平上调人IGF-II基因的转录*
2012-11-06汤绍辉张良鹏吴小娟张嫚嫚王旷靖周鸿科罗羽宏曹明溶
汤绍辉, 张良鹏, 吴小娟, 张嫚嫚, 王旷靖, 周鸿科, 罗羽宏, 曹明溶△
(暨南大学附属第一医院 1消化科,2普通外科,广东 广州 510632)
1000-4718(2012)09-1633-06
2012-03-22
2012-05-11
广东省自然科学基金资助项目(No.9151008901000001);广东省医学科学技术研究基金资助项目(No.A2009367);中央高校基本科研业务费专项资金资助(No.11610407)
△通讯作者 Tel:020-38688039; E-mail:xiger66666@163.com
乙型肝炎病毒X蛋白通过降低P4启动子甲基化水平上调人IGF-II基因的转录*
汤绍辉1, 张良鹏1, 吴小娟1, 张嫚嫚1, 王旷靖1, 周鸿科1, 罗羽宏2, 曹明溶2△
(暨南大学附属第一医院1消化科,2普通外科,广东 广州 510632)
目的构建稳定表达乙型肝炎病毒X蛋白(HBx)的肝癌细胞株HepG2-HBx,探讨HBx对胰岛素样生长因子 II(IGF-II)基因P4启动子甲基化水平及转录表达的影响。方法应用基因重组技术,构建含HBx基因的重组逆转录病毒载体pBABE-puro-HBx,采用磷酸钙共沉淀法将其转染293FT包装细胞产生逆转录病毒,感染HepG2肝癌细胞,采用嘌呤霉素进行阳性克隆筛选,Western blotting鉴定表达HBx蛋白的肝癌细胞株HepG2-HBx。采用亚硫酸氢盐测序法及实时荧光定量RT-PCR检测HepG2-HBx细胞中P4启动子甲基化水平及P4 mRNA表达水平变化。进一步将体外甲基化的人IGF-II基因P4启动子驱动的荧光素酶报告载体pGL3-P4及含HBx基因的pCMV-tag2B-X质粒共转染HepG2肝癌细胞,采用亚硫酸氢盐测序法及双萤光素酶实验检测pGL3-P4载体上P4启动子甲基化水平及转录调控活性变化。结果(1)经Western blotting鉴定,成功构建了稳定表达HBx蛋白的肝癌细胞株HepG2-HBx;(2)表达HBx蛋白的HepG2-HBx细胞中P4启动子甲基化CpG位点的比例(9.0%)明显低于对照细胞HepG2-control(25.0%)(P<0.01),而其P4 mRNA表达水平则为对照细胞HepG2-control的2.8倍;(3)共转染pCMV-tag2B-X质粒的HepG2细胞中pGL3-P4载体上P4启动子甲基化CpG位点的比例(60.8%)明显低于共转染对照质粒pCMV-tag2B的HepG2细胞(84.1%)(P<0.01),而前者P4启动子相对萤光素酶活性(14.12±0.89)则明显高于后者(4.61±0.76)(P<0.01)。结论HBx蛋白可降低IGF-II基因P4启动子甲基化水平,进而上调其转录表达。
乙型肝炎病毒X蛋白; 胰岛素样生长因子II; 启动子; DNA甲基化
人胰岛素样生长因子II(insulin-like growth factor II,IGF-II)是一种由67个氨基酸残基组成的多肽,其基因含9个外显子和4个启动子(P1~P4)。近年我们与其他学者研究发现,由于P3和P4启动子再激活而导致的IGF-II基因过表达与肝细胞癌的发生发展密切相关[1-2]。P4启动子再激活的机制可能涉及几个方面,其中,我们前期的研究显示肝癌组织中P4启动子低甲基化可能是其再激活而致IGF-II大量表达的机制之一[3]。但是,引起P4启动子低甲基化的原因及机制尚不明确。
乙型肝炎病毒X蛋白(hepatitis B virus X protein,HBx)在肝细胞癌的发生中具有重要作用[4],但其致癌机制尚未完全明确。在我国,乙型肝炎病毒(hepatitis B virus,HBV)感染是肝细胞癌的主要病因,而我们前期的研究显示绝大多数肝癌组织IGF-II基因P4启动子甲基化水平明显降低[3],此现象是否提示HBx蛋白表达与P4启动子低甲基化存在相关性?目前国内外尚未见相关的研究报道。鉴于此,本研究拟探讨HBx蛋白对IGF-II基因P4启动子甲基化水平及转录表达的影响,为阐明肝癌发生中P4启动子低甲基化的原因及机制奠定基础。
材 料 和 方 法
1材料
PrimeSTAR HS DNA聚合酶为TaKaRa产品,抗HBx抗体为Abcam产品,Trizol 试剂为Invitrogen产品,双萤光素酶报告实验系统为Promega产品,pBABE-puro逆转录病毒载体为Addgene产品,pCMV-tag2B-X质粒(含HBx基因)及对照质粒pCMV-tag2B由广州南方医科大学肝病中心梁敏锋博士惠赠,人IGF-II基因P4启动子驱动的萤光素酶报告载体pGL3-P4(含P4启动子-1 129~+117片段)为本研究团队构建,HepG2肝癌细胞株购买于ATCC,293FT细胞购自Invitrogen。
2方法
2.1稳定表达HBx蛋白的肝癌细胞株HepG2-HBx构建
2.1.1含HBx基因的重组逆转录病毒载体pBABE-puro-HBx构建 根据pCMV-tag2B-X质粒上HBx基因序列设计引物扩增HBx基因,上游引物5’-CCG CTC GAG ATG GCT GCT AGG CTG TGC TG-3’(含XhoI位点),下游引物5’-CG GAA TTC TTA GGC AGA GGT GAA AAA GTT G-3’(含EcoR I位点),扩增片段长度465 bp。将HBx基因的PCR产物纯化,纯化后的产物及pBABE-puro载体分别经XhoI和EcoR I双酶切,T4 DNA连接酶连接过夜,转化大肠杆菌DH5α,用菌落PCR及双酶切鉴定后送上海英骏生物公司测序分析。
2.1.2磷酸钙共沉淀法转染293FT包装细胞产生逆转录病毒 将293FT包装细胞接种于10 cm细胞培养皿,培养过夜。将20 μg PIK包装质粒分别与20 μg pBABE-puro-HBx载体及对照载体pBABE-puro混合,再依次加入适量CaCl2、H2O及HBS溶液,混匀,加入待转染的293FT细胞中,置37 ℃培养箱孵育5 h,弃去培养基,用PBS洗涤细胞2次,加入培养基继续培养过夜。收集含病毒的上清液,过滤,分装置-80 ℃保存备用。
2.1.3病毒上清液感染HepG2肝癌细胞及阳性克隆筛选 将含聚凝胺(4 mg/L)的病毒上清液加入对数生长期的HepG2肝癌细胞中,37 ℃培养3 h,吸弃培养基,换新病毒上清液,如此重复感染3次,完毕后换正常培养基。感染结束后48 h加入嘌呤霉素(0.5 mg/L)筛选阳性克隆(包括含pBABE-puro-HBx载体及对照载体pBABE-puro的HepG2细胞克隆)。
2.1.4Western blotting鉴定表达HBx蛋白的肝癌细胞株HepG2-HBx 制备HepG2-HBx肝癌细胞及对照肝癌细胞HepG2-control(含对照载体pBABE-puro)总蛋白,行SDS-PAGE凝胶电泳,转膜,用脱脂奶粉封闭。加入稀释的Ⅰ抗(抗HBx及抗β-actin)、辣根过氧化物酶(HRP)标记的羊抗鼠Ⅱ抗,增强化学发光显影,凝胶成像系统摄像及分析结果。
2.2表达HBx蛋白的肝癌细胞HepG2-HBx及对照肝癌细胞HepG2-control中P4启动子甲基化状态及P4 mRNA表达水平分析
2.2.1亚硫酸氢盐测序 制备HepG2-HBx细胞及对照细胞HepG2-control基因组DNA,取2 μg DNA,按CpGenomeTMDNA Modification 试剂盒(BioLabs产品)说明进行DNA修饰,纯化回收修饰后的DNA用于PCR扩增。扩增引物根据P4启动子序列(GenBank进入号NT_009308)设计,上游引物5’-GTA GAA GTT TAT TTT GGT ATG TTG A-3’,下游引物5’-AAT CTC CTT CCC ACC TCC TTA TAT A-3’,片段长度307 bp,扩增区-555~-248。PCR产物亚克隆入pMD19-T载体,挑选阳性克隆进行测序分析,共测序8个克隆。
2.2.2实时荧光定量RT-PCR 根据文献[5]设计IGF-II基因P4启动子特异的转录子(以下简称P4转录子),上游引物5’-TCT CCT GTG AAA GAG ACT TCC AG-3’,下游引物5’- CAA GAA GGT GAG AAG CAC CAG -3’,片段长度137 bp。以β-actin为对照。采用Trizol试剂制备HepG2-HBx细胞及对照细胞HepG2-control总RNA,用MMLV逆转录酶合成cDNA,实时荧光定量PCR扩增与检测IGF-II基因P4 mRNA表达水平。实验过程中,每个样本同时扩增3复管,并连续进行2次实验。采用相对定量法(2-ΔΔCt)表示目的基因表达量。
2.3双萤光素酶报告实验系统及亚硫酸氢盐测序检测HBx蛋白对P4启动子转录调控的影响
2.3.1pGL3-P4载体体外甲基化、细胞转染及瞬时表达 将pGL3-P4载体在体外用SssI CpG甲基转移酶(BioLabs产品) 孵育,然后将纯化后的反应产物用HpaⅡ内切酶消化,以证实完全甲基化。将完全甲基化pGL3-P4载体与pCMV-tag2B-X或其对照空质粒pCMV-tag2B用脂质体法共转染HepG2肝癌细胞。操作完毕,继续培养细胞48 h。实验过程中,每个共转染实验同时做3复孔,并连续进行2次实验。
2.3.2双萤光素酶实验 转染48 h后,制备上述细胞裂解物,按双萤光素酶报告实验系统说明检测细胞裂解物的荧光素酶活性。
2.3.3亚硫酸氢盐测序 转染48 h后,制备上述细胞基因组DNA,取2μg DNA,按CpGenomeTMDNA Modification 试剂盒说明进行DNA修饰,纯化回收修饰后的DNA用于巢式PCR扩增。扩增引物根据pGL3-Basic载体(GenBank进入号U47295.2)及P4启动子序列设计,上、下游外侧引物分别为5’-AAT AGG TTG TTT TTA GTG TAA GTG-3’及5’-TCC TCC CCC CCA AAC TCA AC-3’;上、下游内侧引物分别为5’-AGT GTA AGT G TA GGT GTT AG-3’及5’-CAC ACC ACT TAC CTA AAA AC-3’,片段长度241 bp,扩增区为pGL3-P4载体上P4启动子-1 129~-926片段。PCR产物亚克隆入pMD19-T载体,挑选阳性克隆进行测序分析,共测序8个克隆。
3统计学处理
结 果
1重组逆转录病毒载体pBABE-puro-HBx的构建鉴定
以pCMV-tag2B-X载体为模板,扩增出HBx基因,克隆入pBABE-puro载体,转化大肠杆菌DH5α后抽提重组质粒,经XhoI和EcoR I双酶切得到1条约465 bp的HBx目的片段及载体大片段,见图1A、B。目的片段测序分析结果与GenBank中AF223955.1HBx基因相符。

Figure 1. Construction and identification of HepG2-HBx cell lines expressing hepatitis B virus X protein (HBx). A: electrophoresis analysis of PCR product forHBxgene;B:electrophoresis analysis of dual enzyme digestion of pBABE-puro-HBx recombinant retroviral vector;C: Western blot analysis of HBx protein expression in HepG2-HBx cell line.M:DL2000 DNA marker.
图1表达HBx蛋白的肝癌细胞株HepG2-HBx的构建与鉴定
2表达HBx蛋白的肝癌细胞株HepG2-HBx的鉴定
应用Western blotting检测HepG2-HBx及对照细胞HepG2-control的HBx蛋白表达情况,结果显示,前者有明显的HBx表达,后者则为阴性,表明表达HBx蛋白的肝癌细胞株HepG2-HBx构建成功,见图1C。
3HBx蛋白对HepG2-HBx肝癌细胞P4启动子甲基化水平及P4mRNA表达水平的影响
根据人IGF-II基因P4启动子序列设计引物扩增了P4启动子的-555~-248片段,该片段共含有18个CpG位点。亚硫酸氢盐测序结果显示,HepG2-HBx细胞中甲基化CpG位点的比例(9.0%)明显低于其对照细胞HepG2-control(25.0%),P<0.01,见图2。荧光定量RT-PCR结果显示,HepG2-HBx细胞P4 mRNA表达水平约为其对照细胞HepG2-control的2.8倍,见图2。
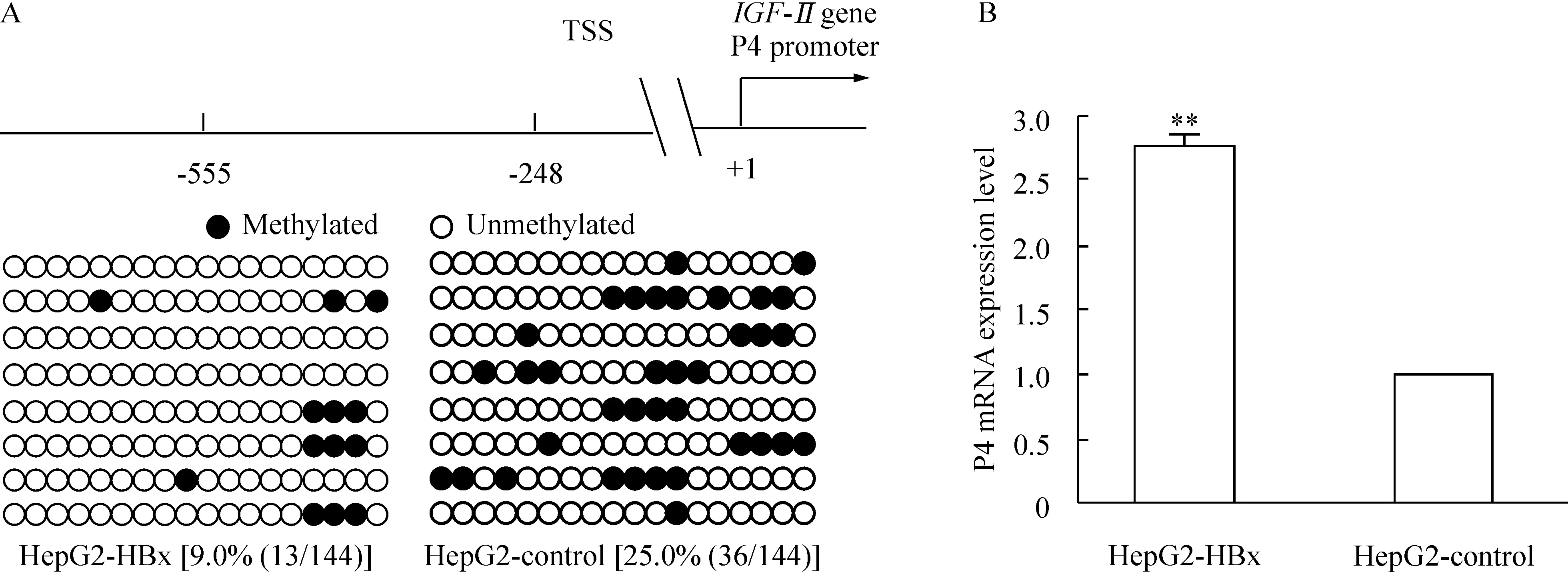
Figure 2. Analysis of the P4 promoter methylation status (A;2=13.009,P<0.01) and P4 mRNA expression (B) ofICF-IIgene in HepG2-HBx cell line and HepG2-control cell line.Each row of circles represented sequencing results of a clone; TSS: transcription start site±s.n=6.**P<0.01vsHepG2-control..
图2HepG2-HBx及对照细胞HepG2-control中P4启动子甲基化水平及P4mRNA表达水平分析
4HBx蛋白对体外甲基化pGL3-P4质粒上P4启动子甲基化水平及转录活性的影响
根据pGL3-P4重组质粒上pGL3-Basic载体及P4启动子序列设计2对引物(2条上游引物序列位于pGL3-Basic载体上),采用巢式PCR技术扩增pGL3-P4质粒上P4启动子的-1 129~-924片段,该片段共含有22个CpG位点。亚硫酸氢盐测序结果显示,共转染pCMV-tag2B-X质粒的HepG2细胞中P4启动子-1 129~-924片段甲基化CpG位点的比例(60.8%)明显低于共转染对照质粒pCMV-tag2B的HepG2细胞(84.1%),P<0.01,见图3。另一方面,双萤光素酶实验结果显示,前者P4启动子相对荧光素酶活性(14.12±0.89)明显高于后者(4.61±0.76),P<0.01,见图3。
讨 论
HBx是一种多功能调节蛋白,在HBV感染相关肝细胞癌的发生发展过程中起重要作用,但其致癌机制复杂,许多环节尚未明确。目前的资料显示,其作用机制可能涉及以下几个方面。(1)HBx可反式激活各种病毒和细胞启动子[6]。(2)HBx参与细胞凋亡过程。在肝细胞感染HBV早期,HBx抑制凋亡,使基因突变得以积累;在晚期,HBx诱导肝细胞凋亡,促进HBV复制及感染扩散,逃避宿主细胞免疫功能,使癌前肝细胞得以存活,并进一步恶性转化[7-9]。(3)通过表观遗传机制导致肿瘤抑制基因等DNA序列的甲基化状态异常等[10-11]。
人IGF-II是一种重要的胎儿生长因子及有丝分裂原,在胚胎生长发育、细胞增殖与分化等方面均有重要作用。IGF-II的表达具有组织和发育阶段特异性。在胎儿的肝脏、肾脏、小肠、肺脏、大脑皮层等组织具有高浓度的IGF-II mRNA表达,出生后急剧减少,但成人肝脏仍有一定水平的IGF-II mRNA表达[12-13]。IGF-II基因的这种表达特征与其复杂的基因结构,即含有9个外显子和4个启动子有关。在个体不同组织及不同生长发育阶段,4个启动子呈现出动态活性,总共编码5种5′端非翻译区不同的IGF-II mRNA,但其成熟蛋白产物相同。例如,在胎肝和新生儿肝中,启动子P2-P4被激活,P1失活,其中P3活性最大而致IGF-II mRNA大量表达;在出生2个月后,肝脏IGF-II mRNA表达量则显著下调,约为新生儿峰值的1/10,一直至成人期都维持于此低水平状态,其表达主要受控于P1启动子,P2和P4启动子活性弱,而P3启动子在大多数成人肝脏呈关闭状态[13]。
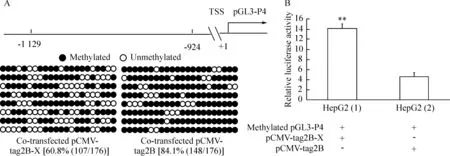
Figure 3. Analysis of methylation levels (A:2=23.922,P<0.01) and the relative luciferase activity (B) of P4 promoter 48 h after co-transfection ofinvitromethylated pGL3-P4 vector and pCMV-tag2B-X or control empty plasmid pCMV-tag2B into HepG2 cells.Each row of circles represented sequencing results of a clone; TSS: transcription start site±s.n=6.**P<0.01vsHepG2 (2).
图3体外甲基化pGL3-P4载体与pCMV-tag2B-X或对照空质粒pCMV-tag2B共转染HepG2肝癌细胞48h后P4启动子甲基化水平及相对荧光素酶活性分析
研究发现,DNA甲基化状态异常与人类肿瘤的发生密切相关。在许多肿瘤中基因组DNA存在广泛低甲基化和局部区域高甲基化共存现象。一般说来,真核基因启动子高甲基化可抑制该基因表达,而低甲基化则促进其表达[14]。 近年发现,IGF-II在动物模型和人类肝脏的癌前病变及肝癌组织中呈过量表达,且IGF-II过表达与P3、P4启动子的再激活密切相关[1, 2, 15]。P4启动子再激活的机制可能有多个方面。我们前期发现:与正常成人肝组织相比,肝癌组织中P4启动子甲基化水平明显降低,且DNA低甲基化是P4启动子再激活的机制之一[3]。但是,引起P4启动子低甲基化的原因及发生机制尚不明确。Su等[16]检测了419例肝癌组织,结果显示绝大多数标本同时存在IGF-II和HBx蛋白表达;我们前期的研究显示:在HBV相关的肝癌患者中,绝大多数肝癌组织存在P4启动子低甲基化及P4 mRNA高表达[2-3]。这些结果提示,HBx蛋白表达或HBV感染可能促进肝癌组织IGF-II基因过表达。但二者之间确切的关系及其作用机制尚未明确。
在本研究中,我们构建了表达HBx蛋白的肝癌细胞株HepG2-HBx,结果显示,HepG2-HBx细胞P4启动子-555~-248片段甲基化CpG位点的比例明显低于其对照细胞HepG2-control,而其P4 mRNA表达水平则为其对照细胞HepG2-control的2.8倍,提示HBx蛋白可降低P4启动子甲基化水平,进而促进IGF-II基因转录表达。为了进一步验证上述研究结果,我们构建了P4启动子驱动的萤光素酶报告载体pGL3-P4,将其体外甲基化后与含HBx基因的pCMV-tag2B-X质粒共转染HepG2肝癌细胞,结果显示,共转染pCMV-tag2B-X质粒的HepG2细胞中pGL3-P4载体上P4启动子-1 129~-924片段甲基化CpG位点的比例明显低于共转染其对照空质粒pCMV-tag2B的HepG2细胞,而其P4启动子相对萤光素酶活性则明显高于后者。上述两部分实验结果表明,HBx蛋白可诱导肝癌细胞IGF-II基因P4启动子甲基化水平降低,进而上调P4启动子转录活性,从而促进IGF-II基因表达。本结果与Zheng等[10]报道相似,他们发现HBx蛋白可部分或完全阻止DNA 甲基转移酶3A(DNA methyltransferases 3A,DNMT3A)与CDH6基因的启动子结合,引起其低甲基化从而激活转录。Park等[17]也发现,HBx蛋白可下调DNMT3B表达,进而诱导肝癌细胞基因组DNA卫星2重复序列低甲基化。
本研究结果将与肝癌发生有关的两个重要因素——HBx蛋白与IGF-II基因过表达联系起来,一方面为全面深入认识HBx蛋白致肝细胞癌分子机制补充了新资料,另一方面为进一步阐明肝癌发生中P4启动子低甲基化的原因及机制奠定了基础。
[1] Breuhahn K, Schirmacher P. Reactivation of theinsulin-likegrowthfactor-IIsignaling pathway in human hepatocellular carcinoma[J]. World J Gastroenterol, 2008, 14(11):1690 -1698.
[2] Tang SH, Yang DH, Huang W, et al. Differential promoter usage for insulin-like growth factor-II gene in Chinese hepatocellular carcinoma with hepatitis B virus infection[J]. Cancer Detect Prev, 2006, 30(2):192-203.
[3] Tang SH, Yang DH, Huang W, et al. Hypomethylated P4 promoter induces expression of the insulin-like growth factor-II gene in hepatocellular carcinoma in a Chinese population[J]. Clin Cancer Res, 2006, 12(14): 4171-4177.
[4] Shon JK, Shon BH, Park IY, et al. Hepatitis B virus-X protein recruits histone deacetylase 1 to repress insulin-like growth factor binding protein 3 transcription[J]. Virus Res, 2009, 139(1):14-21.
[5] Liao B, Hu Y, Herrick DJ, et al. The RNA-binding protein IMP-3 is a translational activator of insulin-like growth factor II leader-3 mRNA during proliferation of human K562 leukemia cells[J]. J Biol Chem, 2005, 280(18):18517-18524.
[6] Ng SA, Lee C. Hepatitis B virus X gene and hepatocarcinogenesis[J]. J Gastroenterol, 2011, 46(8):974-990.
[7] Kew MC. Hepatitis B virus x protein in the pathogenesis of hepatitis B virus-induced hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2011, 26(Suppl 1):144-152.
[8] Lau JY, Xie X, Lai MM, et al. Apoptosis and viral hepatitis[J]. Semin Liver Dis, 1998, 18(7): 169-176.
[9] Assrir N, Soussan P, Kremsdorf D, et al. Role of the hepatitis B virus proteins in pro- and anti-apoptotic processes[J]. Front Biosci, 2010, 15:12-24.
[10]Zheng DL, Zhang L, Cheng N, et al. Epigenetic modification induced by hepatitis B virus X protein via interaction withdenovoDNA methyltransferase DNMT3A[J]. J Hepatol, 2009, 50(2):377-387.
[11]Zhu YZ, Zhu R, Fan J, et al. Hepatitis B virus x protein induces hypermethylation of p16INK4Apromoter via DNA methyl transferases in the early stage of HBV-associated hepatocarcinogenesis[J]. J Viral Hepat, 2010, 17(2): 98-107.
[12]Birnbacher R, Amann G, Breitschopf H,et al. Cellular localization of insulin-like growth factor II mRNA in the human fetus and the placenta: detection with a digoxigenin-labeled cRNA probe and immunocytochemistry[J]. Pediatr Res, 1998, 43(5):614-620.
[13]Li X, Cui H, Sandstedt B, et al. Expression levels of the insulin-like growth factor-II gene (IGF2) in the human liver: developmental relationships of the four promoters[J]. J Endocrinol, 1996, 149(1):117-124.
[14]Costello JF, Fruhwald MC. Aberrant CpG-island methylation has nonrandom and tumor-type-specific patterns[J]. Nat Genet, 2000, 24(7):132-138.
[15]Nussbaum T, Samarin J, Ehemann V, et al. Autocrine insulin-like growth factor-II stimulation of tumor cell migration is a progression step in human hepatocarcinogenesis[J]. Hepatology, 2008, 48(1):146-156.
[16]Su Q, Liu YF, Zhang JF, et al. Expression of insulin-like growth factor-II in hepatitis B cirrhosis and hepatocellular carcinoma: its relationship with hepatitis B virus antigen expression[J]. Hepatology, 1994, 19(4 pt 1): 788-799.
[17]Park IY, Sohn BH, Yu E, et al. Aberrant epigenetic modifications in hepatocarcinogenesis induced by hepatitis B virus X protein[J]. Gastroenterology, 2007, 132(4):1476-1494.
HBxreducesmethylationlevelofP4promoterandup-regulateshumanIGF-IIgenetranscription
TANG Shao-hui1, ZHANG Liang-peng1, WU Xiao-juan1, ZHANG Man-man1, WANG Kuang-jing1, ZHOU Hong-ke1, LUO Yu-hong2, CAO Ming-rong2
(1DepartmentofGastroenterology,2DepartmentofGeneralSurgery,theFirstAffiliatedHospitalofJinanUniversity,Guangzhou510632,China.E-mail:xiger66666@163.com)
AIM: To establish HepG2-HBx cell line stably expressing hepatitis B virus X protein (HBx) and to investigate the effect of HBx on the methylation status and transcription activity of human insulin-like growth factor II (IGF-II) gene P4 promoter.METHODSHBxgene was cloned into the pBABE-puro retrovirus vector to construct recombinant plasmid pBABE-puro-HBx. The latter was transfected into 293FT package cells to generate retrovirus-pBABE-puro-HBx. HepG2 cells were infected with the virus suspension and the resistant cell clones were selected by puromycin. HBx expression in the HepG2-HBx cells was analyzed by Western blotting. P4 promoter methylation status and P4 mRNA expression in HepG2-HBx cells and HepG2-control cells were detected by bisulfite sequencing and real-time fluorescence quantitative RT-PCR, respectively. Furthermore,invitromethylated pGL3-P4 vector driven by P4 promoter of human IGF-II gene was co-transfected into HepG2 cells with pCMV-tag2B-X plasmid carryingHBxgene or control empty plasmid pCMV-tag2B, and the methylation status and transcription activity of P4 promoter in pGL3-P4 vector were analyzed by bisulfite sequencing and dual-luciferase reporter assay system, respectively.RESULTSHepG2-HBx cell line stably expressing HBx was successfully constructed. The percentage of methylated CpG dinucleotides in P4 promoter was lower in HepG2-HBx cells (9.0%) than that in HepG2-control cells (25.0%) (P<0.01), and P4 mRNA expression level of the former was 2.8 times higher than that of the latter. The percentage of methylated CpG dinucleotides in P4 promoter at pGL3-P4 vector was lower in the HepG2 cells co-transfected with pCMV-tag2B-X (60.8%) than that in the HepG2 cells co-transfected with control empty plasmid pCMV-tag2B (84.1%) (P<0.01), and the relative luciferase activity of the former (14.12±0.89) was higher than that of the latter (4.61±0.76) (P<0.01).CONCLUSIONHBx may reduce the methylation level of P4 promoter and up-regulates humanIGF-IIgene transcription.
Hepatitis B virus X protein; Insulin-like growth factor II; Promoters; DNA methylation
R735
A
10.3969/j.issn.1000-4718.2012.09.017
