糖尿病早期脑损伤与线粒体功能障碍*
2012-11-06耿喜林徐明丽穆继英景玉宏
耿喜林, 徐明丽, 尹 洁, 穆继英, 张 朗, 景玉宏,4△
(1兰州大学第二医院创伤外科,甘肃 兰州 730030;2甘肃省卫生学校药学教研室,甘肃 兰州 730000;兰州大学基础医学院 3人体解剖与组织胚胎学研究所,4 神经科学研究所,甘肃 兰州 730000)
1000-4718(2012)09-1571-06
2012-03-13
2012-06-05
国家自然科学基金资助项目(No. 30872731);甘肃省自然科学基金资助项目(No.1010RJZA114)
△通讯作者 Tel: 0931-8915886;E-mail:jingyh@lzu.edu.cn
糖尿病早期脑损伤与线粒体功能障碍*
耿喜林1, 徐明丽2, 尹 洁3, 穆继英3, 张 朗3, 景玉宏3,4△
(1兰州大学第二医院创伤外科,甘肃 兰州 730030;2甘肃省卫生学校药学教研室,甘肃 兰州 730000;兰州大学基础医学院3人体解剖与组织胚胎学研究所,4神经科学研究所,甘肃 兰州 730000)
目的研究1型糖尿病早期阶段脑损伤的主要病理原因,是否影响线粒体功能及其可能机制。方法SD大鼠经股静脉单次注射链脲佐菌素(streptozotocin,STZ)诱导高血糖,持续高血糖2个月后,检测外周血、脑脊液及脑组织中葡萄糖、甘油三酯和总胆固醇水平。取大鼠前额皮层,分离线粒体,检测线粒体氧化及抗氧化水平,Western blotting检测腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)磷酸化水平。全脑冰冻切片,Fluo-Jade-C染色检测神经细胞损伤程度。电镜检测皮层锥体细胞自噬-溶酶体变化。结果1型糖尿病神经损伤主要原因是高血糖,可以导致皮层Fluo-Jade-C阳性细胞增多,线粒体氧化水平升高,抗氧化能力下降,AMPK磷酸化水平下降。同时发现1型糖尿病大鼠皮层锥体细胞自噬体增多,自噬体内包裹有线粒体或线粒体残余。结论1型糖尿病早期所致的脑损伤,与持续高血糖增加氧化应激,进而损伤线粒体功能有关,伴随有自噬激活。
高血糖症; 线粒体; 自噬; 脑
临床研究表明,未严格控制血糖的1型糖尿病患者在早期即可出现脑损伤的症状,该损伤与高血糖、一过性低血糖及酮尿有关,主要病理表现为脑水肿,伴随脑组织氧化应激相关指标的异常以及炎症反应[1]。而脑内氧化应激及炎症反应可能在糖尿病早期就已经存在,并危害神经元的代谢稳态、细胞极性及营养供应[2]。1型糖尿病大鼠模型神经损伤的机制也同样与氧化应激及炎症反应相关,近来更有研究认为代谢障碍及氧化应激是神经退行性疾病(如老年性痴呆)的关键因素[3]。线粒体是细胞内的供能中心,也是氧自由基产生的关键细胞器,对氧化损伤较为敏感,氧化应激不仅损伤线粒体本身,同时通过线粒体信号,如细胞色素C信号启动细胞凋亡,导致神经元死亡。细胞代谢异常,尤其持续高糖刺激会激活细胞内自噬-溶酶体途径,自噬在细胞稳态调节中发挥重要作用,由于氧化应激所致的异常蛋白聚集及细胞器可以通过此途径降解,通过自噬途径实现代谢激发的适应性反应,在神经退行性疾病中发挥细胞毒性效应[4]。在1型糖尿病早期,高血糖可能是关键的病理因素,葡萄糖氧化代谢的核心细胞器是线粒体,因此本实验中我们重点观察1型糖尿病模型大鼠在高血糖2个月后脑损伤情况、这一损伤对线粒体功能的影响和高糖状态下线粒体的变化。
材 料 和 方 法
1动物
SD雄性大鼠,体重275~300 g,购自兰州大学医学实验动物中心,全部动物实验均得到兰州大学实验动物委员会批准。
2主要试剂
链脲佐菌素(streptozotocin,STZ)购自Sigma;Fluo-Jade-C购自Chemicon;腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)及磷酸化AMPK抗体购自Bioworld;葡萄糖(glucose)、甘油三酯(triglyceride,TG)及总胆固醇(cholesterol,CHOL)测定试剂盒购自中生北控生物科技股份有限公司;PVDF膜及ECL发光剂均购自Millipore;丙二醛(malondialdehyde,MDA)检测试剂盒及谷胱甘肽(glutathione,GSH)检测试剂盒均购自南京建成生物工程研究所;其它试剂及耗材购自上海生物工程有限公司。
3主要方法
3.1动物模型 SD雄性大鼠,体重275~300 g,购自兰州大学医学实验动物中心,动物饲养室保持22 ℃,60%湿度,12 h光照周期,自由摄食饮水,全部动物实验均得到兰州大学实验动物委员会批准。适应性饲养1周后,禁食24 h,经股静脉1次性注射STZ(60 mg/kg,溶于生理盐水中),对照组经股静脉注射等量生理盐水,1周后经大鼠尾静脉采血,检测血糖,≥300 mg/dL作为高血糖大鼠,用于实验,常规饲料喂养,2个月后用于各项指标检测。
3.2血浆、脑脊液和大脑皮层组织葡萄糖、TG和CHOL测定 造模后2个月大鼠(每组随机选取10只),10%水合氯醛麻醉(360 mg/kg),暴露枕骨大孔,经小脑延髓池穿刺抽取脑脊液,开胸,暴露心脏,经心脏穿刺采血,离心分离血浆,利用酶底物试剂盒直接检测血浆及脑脊液中葡萄糖、TG及CHOL含量。部分大鼠经心脏采血后,快速经冰生理盐水灌注冲洗血液,冰台上分离全脑,一侧大脑皮层用于制作脑组织匀浆,一侧大脑皮层用于提取总线粒体。脑组织匀浆制作:皮层称重,加入0.01 mmol PBS[含100 mmol的苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)及10 mmol的蛋白酶抑制剂apoprotin(100 g/L)],低温匀浆,超声处理,呈混悬液,测定脑组织中葡萄糖、TG和CHOL,匀浆组织低温离心(12 000×g, 20 min),取上清,测定组织蛋白浓度。
3.3线粒体分离及鉴定 另一侧大脑皮层置于冰的缓冲液(10 mmol/L Na2HPO4, 1.8 mmol/L KH2PO4, 50 mmol/L NaCl, 2.7 mmol/L KCl)中剪碎,并匀浆,加入线粒体提取液,低温梯度离心,获取线粒体组分,取少量,经电子显微镜鉴定,纯度在95%以上者用于后续实验。
3.4线粒体MDA和GSH含量的测定 线粒体提取物,利用RIPA提取总蛋白(加入蛋白酶抑制剂及磷酸酶抑制剂),并根据试剂操作说明书,检测线粒体中MDA及GSH含量。
3.5血浆MDA分析 全血分离血浆,加入双蒸水以5∶1比例稀释,经HPLC检测血浆中MDA含量。
3.6Fluo-Jade-C检测 每组5只大鼠经心脏灌注固定。采用心脏灌注泵(压力控制:28),冰生理盐水冲洗,4% PA-0.1 mol/L PB-buffer灌注固定。取脑,经20%-30%蔗糖梯度处理,冰冻切片机连续冠状切片,片厚30 μm。选取braggma -0.34平面,行Fluo-Jade-C染色。脑片经100%-70%-30%梯度乙醇处理,蒸馏水冲洗,0.06% KMnO4处理15 min,0.001%Fluo-Jade-C染色40 min,避光,室温反应。荧光显微镜观察,拍照。
3.7Western blotting检测线粒体提取物中AMPK磷酸化水平 上述线粒体提取的总蛋白,利用SDS-PAGE分离,转印至PVDF膜,分别用AMPK及磷酸化AMPK抗体孵育,4 ℃过夜,TBST漂洗,对应的Ⅱ抗室温孵育30 min,漂洗,ECL发光剂显色,胶片曝光,定影、显影,扫描,利用Image-Pro Plus软件分析灰度,计算相对表达量。
3.8脑组织自噬体检测 每组随机选取3只大鼠前额皮层,2.5%戊二醛固定,1%锇酸后固定,脱水,树脂包埋,聚合,半薄定位锥体细胞层,超薄切片,观察锥体细胞及周围突起内自噬体数量及形态。
4统计学处理
结 果
11型糖尿病早期大鼠血浆、脑脊液和大脑皮层组织中葡萄糖、TG和CHOL的变化
为证明1型糖尿病早期外周代谢异常对中枢糖脂有无影响,我们在糖尿病大鼠2个月后分别检测了模型和对照组大鼠外周血、脑脊液和皮层脑组织内葡萄糖、TG和CHOL的含量变化。结果表明,2个月后糖尿病大鼠血浆葡萄糖含量明显增高,同时脑脊液中葡萄糖的含量也明显高于正常对照组,但糖尿病大鼠脑组织葡萄糖含量下降,见表1。该结果表明1型糖尿病导致外周和中枢葡萄糖变化明显,组织葡萄糖转运异常可能是脑组织葡萄糖水平较低的原因。我们也检测了TG及CHOL在外周血、脑脊液及脑组织中的变化,结果发现各组之间无显著差异。
2Fluo-Jade-C染色结果
表1结果表明,1型糖尿病不但导致外周血糖升高,同时也存在中枢性高血糖,神经组织内葡萄糖水平下降,表明存在细胞葡萄糖利用障碍。为进一步研究该变化对皮层区域神经细胞的损伤效应,我们通过Fluo-Jade-C染色,检测皮层神经细胞损伤状况,(Fluo-Jade-C可以染色溃变的神经元)。从染色结果可以观察到,2个月后1型糖尿病大鼠皮层可见较多的Fluo-Jade-C染色的阳性神经元出现,见图1。
表11型糖尿病对大鼠血液、脑脊液和大脑皮层组织中葡萄糖、甘油三酯和总胆固醇含量的影响

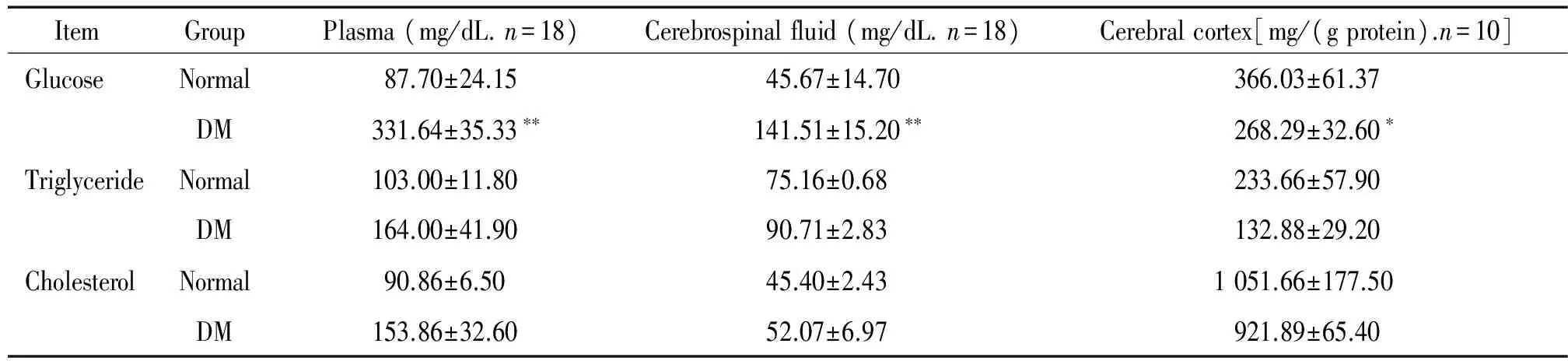
ItemGroupPlasma(mg/dL.n=18)Cerebrospinalfluid(mg/dL.n=18)Cerebralcortex[mg/(gprotein).n=10]GlucoseNormal87.70±24.1545.67±14.70366.03±61.37DM331.64±35.33∗∗141.51±15.20∗∗268.29±32.60∗TriglycerideNormal103.00±11.8075.16±0.68233.66±57.90DM164.00±41.9090.71±2.83132.88±29.20CholesterolNormal90.86±6.5045.40±2.431051.66±177.50DM153.86±32.6052.07±6.97921.89±65.40
*P<0.05,**P<0.01vsnormal.
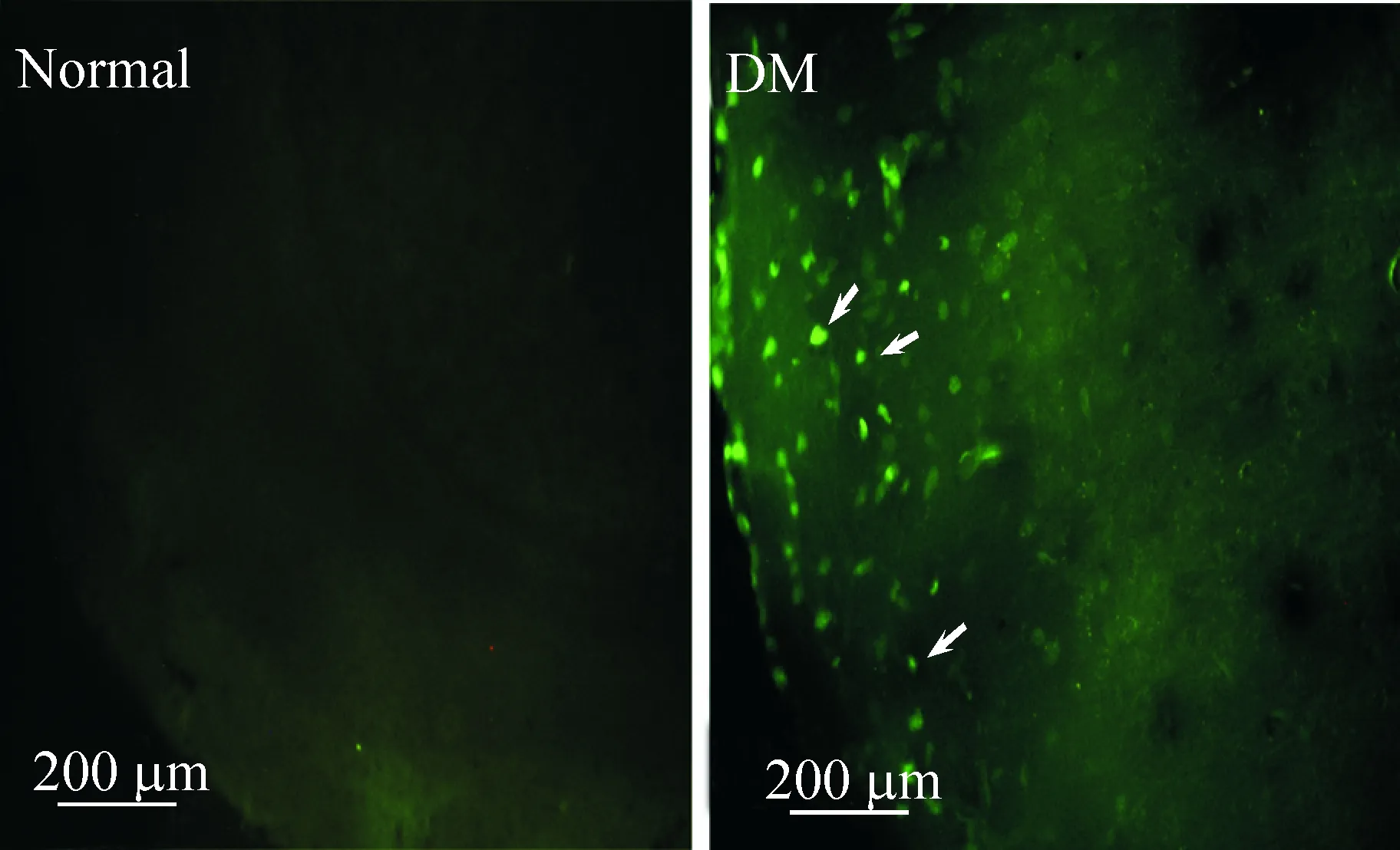
Figure 1. Degenerative neurons were stained by Fluo-Jade-C in frontal cortex in STZ-induced diabetic rats. The arrows indicate degenerative neurons.
图11型糖尿病对大鼠皮层神经细胞溃变的影响
3线粒体检测结果
考虑到1型糖尿病神经损伤的关键因素是高血糖(高血糖可以导致显著的氧化应激,从而波及细胞内的线粒体),我们通过分离皮层组织的线粒体组分,并通过电子显微镜鉴定线粒体纯度,见图2。在此基础上,我们检测了线粒体氧化及抗氧化水平,结果可见当外周血中氧化损伤加剧,MDA含量升高时,脑组织线粒体MDA也同步升高,而线粒体抗氧化能力则下调,即GSH水平下降,见图3。
4线粒体中能量感受分子AMPK磷酸化水平检测结果
线粒体氧化应激可能会影响线粒体的氧化功能。我们检测了线粒体中能量感受分子AMPK磷酸化水平,结果发现1型糖尿病大鼠脑内线粒体中AMPK磷酸化水平明显下降,见图4。
5糖尿病导致的线粒体损伤与自噬活化的关系
1型糖尿病可以导致线粒体损伤,功能异常的线粒体或其它细胞器会通过自噬-溶酶体途径清除。我们对皮层组织进行电镜检测,发现皮层神经元及其突起内出现较多的自噬-溶酶体结构,在这些自噬体中往往包含有线粒体结构,见图5。这说明在1型糖尿病损伤中存在自噬激活。

Figure 2. Identification of mitochondria by electron microscopy. Mitochondria were observed in the isolated fraction.A:normal;B:diabetes mellitus.
图2皮层组织线粒体分离鉴定
讨 论
近年研究表明长期的2型糖尿病,或是未控制血糖的1型糖尿病会导致中枢神经损伤,中枢神经损伤的机制可能涉及多个方面,尤其长期糖尿病所致的代谢障碍,往往会损伤血管系统,波及脑内的小血管,导致血管硬化,血管炎症反应,进而引发神经病理改变[5]。但1型糖尿病早期,没有形成明显的血管病变,但由于胰岛素水平低下,血糖过高,脂类代谢障碍成为脑损伤的潜在病理。本研究中,我们首先确定了糖尿病的主要损伤因素,通过检测血浆、脑脊液和脑组织中葡萄糖、TG和CHOL含量,发现在1型糖尿病早期主要病因为高血糖,这一过度升高的血糖效应,不但存在于外周,同时也影响到脑脊液,这说明高血糖不但会影响外周器官,也会影响脑,虽然有血脑屏障这一结构,但对血液中高浓度葡萄糖似乎并无影响,脑脊液中葡萄糖浓度虽然低于外周,但糖尿病组大鼠脑脊液葡萄糖浓度依然高于对照组。可能部分原因是因为脑内葡萄糖的代谢较少依赖葡萄糖转运体4(glucose transporter 4,GLUT4),已知GLUT4的葡萄糖转运作用对胰岛素具有依赖性[6]。另一方面,和外周器官比较,脑组织对葡萄糖的利用更高,这也许是脑脊液中葡萄糖浓度低于外周血的原因,但因为持续高血糖,以及脑内胰岛素信号也有下降, 所以依然在糖尿病动物的脑脊液中检测到较高的葡萄糖水平。而脑组织内葡萄糖水平则可以反映进入细胞内葡萄糖的量,这一结果发现糖尿病动物脑组织葡萄糖含量有下降,这意味着神经细胞摄取葡萄糖的效率是下降的,该结果的确切机制可能较为复杂,因为胰岛素信号除促进GLUT4的葡萄糖转运外,在神经保护、非GLUT4途径的葡萄糖利用方面也发挥作用[7],因此脑组织中葡萄糖浓度降低,一方面可能是因为葡萄糖转运的问题,另一方面,可能和神经细胞对葡萄糖的利用有关。
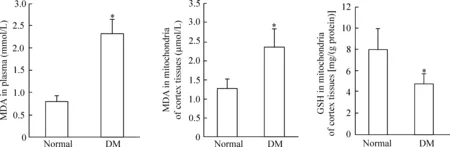

图31型糖尿病对大鼠皮层组织内线粒体氧化和抗氧化能力的影响
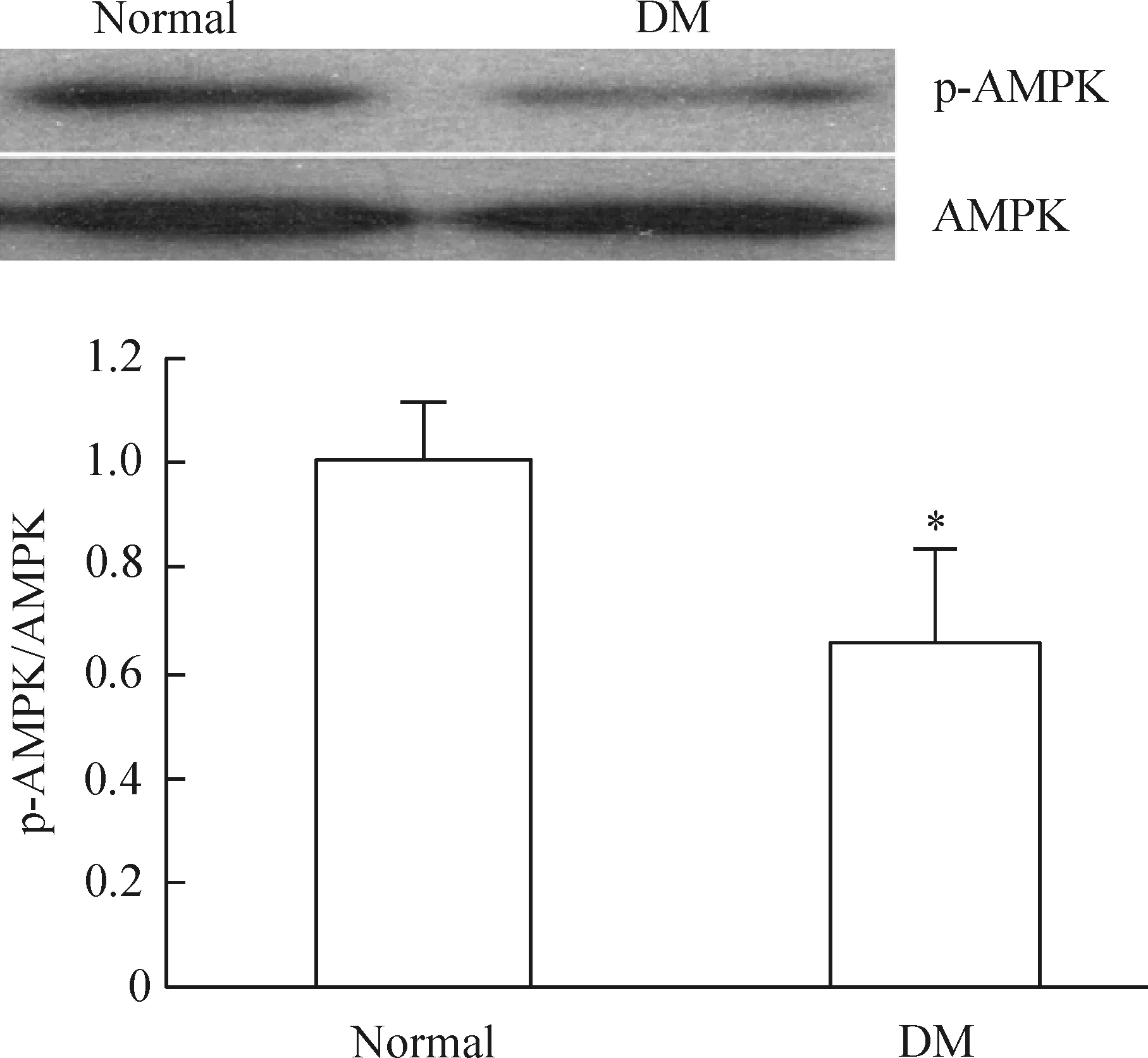

图4糖尿病大鼠皮层线粒体AMPK磷酸化水平的变化
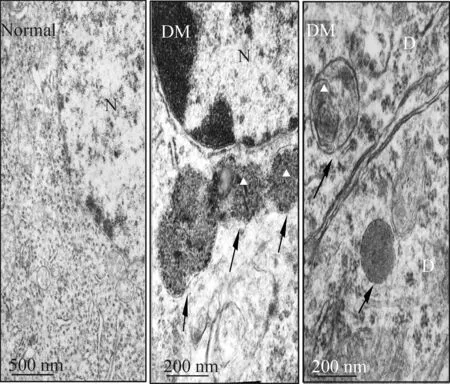
Figure 5. Autophagysomes in the frontal cortex of rats were observed by electron microscopy. N:nucleus;DM:diabetic mellitus;D:dendrite. Black arrows indicate autophagysome;white triangles indicate mitochondria.
图5大鼠前额皮层锥体细胞自噬分析
自由基累积导致线粒体损伤,会影响线粒体功能,线粒体是氧化代谢的核心细胞器,而AMPK分子对能量代谢异常敏感,AMPK通过磷酸化,活化下游的诸多通路,参与糖类、脂类及蛋白的利用[14- 15]。因此通过检测AMPK活性,可以间接反映能量利用效率,通过对线粒体AMPK磷酸化水平检测,发现糖尿病大鼠皮层线粒体蛋白提取物中磷酸化AMPK水平降低。来自糖尿病外周器官损伤的众多研究也发现类似结果,尤其是糖尿病大鼠骨骼肌和肾小球内AMPK活化水平下降,葡萄糖利用率降低[16]。能量利用效率和自噬活化之间有密切关系[17],因为线粒体损伤以及脑组织葡萄糖利用率下降,可能会激活自噬,通过电子显微镜检测,在神经细胞胞体内可以观察到更多的自噬体,正常状态下,脑内自噬水平比较低,自噬体的半衰期很短,所以很难捕捉到广泛出现的自噬体[18]。我们在正常动物脑内皮层锥体细胞中没有观察到太多的自噬体,而在糖尿病大鼠皮层锥体细胞中,则发现有异常增多的自噬体出现,这些自噬体内往往包裹了线粒体结构,或线粒体残体,这说明该过程伴随有自噬的活化,但自噬激活在此扮演的角色依然难下结论,可能自噬活化目的是为了清除功能异常的细胞器,也可能由于高糖持续状态,导致自噬活化,成为加重损伤的原因,要澄清自噬体在此的作用,尚需要更多的实验。
总之,我们的研究发现,1型糖尿病脑损伤的关键因素是持续高血糖,高糖导致氧化应激,进而损伤神经细胞线粒体,线粒体功能异常伴随自噬活化,成为脑损伤的后续病理变化。
[1] Gogitidze JN, Hedrington MS, Tate DB, et al. Effects of acute hypoglycemia on inflammatory and pro-atherothrombotic biomarkers in individuals with type 1 diabetes and healthy individuals [J]. Diabetes Care, 2010, 33 (7): 1529-1535.
[2] Hoffman WH, Siedlak SL, Wang Y, et al. Oxidative damage is present in the fatal brain edema of diabetic ketoacidosis [J]. Brain Res, 2011, 1369: 194-202.
[3] Sayre LM, Perry G, Smith MA. Oxidative stress and neurotoxicity [J]. Chem Res Toxicol, 2008, 21(1):172-188.
[4] Kaushik S, Singh R, Cuervo AM. Autophagic pathways and metabolic stress [J]. Diabetes Obes Metab, 2010,12(Suppl 2): 4-14.
[5] Kalaria RN. Vascular basis for brain degeneration: faltering controls and risk factors for dementia [J]. Nutr Rev, 2010, 68 (Suppl 2): S74-S87.
[6] Kampmann U, Christensen B, Nielsen TS, et al. GLUT4 and UBC9 protein expression is reduced in muscle from type 2 diabetic patients with severe insulin resistance [J]. PLoS One,2011, 6(11): e27854.
[7] Lechin F, van der Dijs B. Central nervous system circuitry involved in the hyperinsulinism syndrome[J]. Neuroendocrinology,2006, 84(4): 222-234.
[8] 金惠铭,胡仁明.糖尿病性微血管病的临床病理生理[J].中国病理生理杂志,2007, 23(2): 399-402.
[9] Evans JL, Goldfine ID, Maddux BA, et al. Oxidative stress and stress activated signaling pathways: a unifying hypothesis of type 2 diabetes [J]. Endocr Rev, 2002, 23(5): 599-622.
[10]Agardh CD,Stenram U,Torffvit O,et al. Effects of inhibition of glycation and oxidative stress on the development of diabetic nephropathy in rats [J]. J Diabetes Complications, 2002, 16(6): 395-400.
[11]Robertson RP, Harmon J, Tran PO, et al.Glucose toxicity in Beta-cells: type 2 diabetes, good radicals gone bad, and the glutathione connection [J]. Diabetes, 2003, 52( 3 ): 581-587.
[12]Bhandarkar SS, Jaconi M, Fried LE, et al. Fulvene-5 potently inhibits NADPH oxidase 4 and blocks the growth of endothelial tumors in mice [J]. J Clin Invest, 2009, 119(8): 2359-2365.
[13]Rains JL, Jain SK. Oxidative stress, insulin signaling, and diabetes [J]. Free Radic Biol Med, 2011, 50(5):567-575.
[14]Wu SB, Wei YH. AMPK-mediated increase of glycolysis as an adaptive response to oxidative stress in human cells: implication of the cell survival in mitochondrial diseases [J]. Biochim Biophys Acta, 2012, 1822(2): 233-247.
[15]Lakshmanan AP, Watanabe K, Thandavarayan RA, et al. Curcumin attenuates hyperglycaemia-mediated AMPK activation and oxidative stress in cerebrum of streptozotocin-induced diabetic rat [J]. Free Radic Res, 2011, 45(7): 788-795.
[16]Hallows KR, Mount PF, Pastor-Soler NM, et al. Role of the energy sensor AMP-activated protein kinase in renal physiology and disease [J]. Am J Physiol Renal Physiol, 2010, 298(5):1067-1077.
[17] Alers S, Löffler AS, Wesselborg S, et al. Role of AMPK-mTOR-Ulk1/2 in the regulation of autophagy: crosstalk, shortcuts and feedbacks [J]. Mol Cell Biol, 2012, 32(1): 2-11.
[18]Green DR, Galluzzi L, Kroemer G. Mitochondria and the autophagy-inflammation-cell death axis in organismal aging [J]. Science, 2011, 333(6046):1109-1112.
Early-onsettype1diabetescausesbraininjuryandmitochondrialdysfunction
GENG Xi-lin1, XU Ming-li2, YIN Jie3, MU Ji-ying3, ZHANG Lang3, JING Yu-hong3,4
(1DivisionofTraumaticSurgery,theSecondHospitalofLanzhouUniversity,Lanzhou730030,China;2DepartmentofPharmacy,GansuProvinceHealthSchool,Lanzhou730000,China;3InstituteofHumanAnatomy,HistologyandEmbryology,4InstituteofNeuroscience,SchoolofBasicMedicalSciences,LanzhouUniversity,Lanzhou730000,China.E-mail:jingyh@lzu.edu.cn)
AIM: To explore the main risk factors of diabetic encephalopathy and to investigate the changes of mitochondria in early-onset type 1 diabetes.METHODSSingle dose of streptozotocin was injected through the femoral vein to establish type 1 diabetes model in rats. The levels of glucose, triglyceride and cholesterol in plasma, cerebrospinal fluid and cerebral cortex were measured. Oxidative and antioxidative status was evaluated by determining the levels of malondialdehyde and glutathione in the isolated mitochondria of cerebral cortex. Furthermore, the level of active AMP-activated protein kinase (AMPK) in the isolated mitochondria was detected by Western blotting. Degenerative neurons were identified by Fluo-Jade-C staining in serial brain sections. Autophagy-lysosome was observed under electron microscope.RESULTSThe main risk factor in the development of diabetic encephalopathy was hyperglucemia, which increased the Fluo-Jade-C positive neurons in the cerebral cortex of diabetic rats. The content of malondialdehyde was increased and glutathione was decreased in diabetic rats compared with the control animals. The activity of AMPK was lower in diabetic brain than that in normal brain. Aggregated autophagysome and mitochondria enveloped by autophagy-lysosome were observed in pyramidal cells of cerebral cortex in diabetic rats.CONCLUSIONPersistent hyperglycemia and mitochondrial dysfunction contribute to the diabetic encephalopathy at an early stage in type 1 diabetes, indicating that the mechanism may be partly related to the oxidative stress and activation of autophagy.
Hyperglycemia; Mitochondria; Autophagy; Brain
R587.1
A
10.3969/j.issn.1000-4718.2012.09.007
