LY367385通过抑制细胞外信号调节激酶途径减轻小鼠脑血管痉挛后神经细胞凋亡*
2012-11-06崔建忠王海涛田艳霞王凯杰张宇新高俊玲
李 冉, 刘 江, 崔建忠, 王海涛, 田艳霞, 王凯杰, 张宇新, 高俊玲△
(1河北联合大学基础医学院,2唐山市工人医院,河北 唐山 063000)
1000-4718(2012)07-1275-06
2011-12-22
2012-02-29
河北省自然科学基金资助项目(No. C2009001247);河北省教育厅重点课题(No. ZH200803);
卫生部人类疾病比较医学重点实验室开放课题 (No. ZDS200801);河北省卫生厅医学科学研究重点计划指令项目(No.20110164)
△通讯作者 Tel: 0315-3725754; E-mail: junlinggao@163.com
LY367385通过抑制细胞外信号调节激酶途径减轻小鼠脑血管痉挛后神经细胞凋亡*
李 冉1, 刘 江1, 崔建忠2, 王海涛1, 田艳霞1, 王凯杰2, 张宇新1, 高俊玲1△
(1河北联合大学基础医学院,2唐山市工人医院,河北 唐山 063000)
目的探讨代谢型谷氨酸受体1(mGluR1)选择性拮抗剂LY367385对脑血管痉挛(CVS)后神经细胞凋亡的影响及细胞外信号调节激酶1/2(ERKl/2)途径的作用。方法采用非开颅血管内线栓法制备小鼠蛛网膜下腔出血(SAH)并CVS模型,随机分为3组:假手术组、模型对照组和mGluR1拮抗剂LY367385组,于SAH后10 min侧脑室注射生理盐水或LY367385(500 nmol)5 μL,术后行神经功能评分。分别在SAH后6、24和48 h 3个时点取右侧脑组织标本,在光镜和电镜下观察脑组织病理变化,采用逆转录-聚合酶链式反应检测各组mGluR1 mRNA的表达变化;蛋白免疫印迹法检测mGluR1和p-ERK1/2蛋白的表达;用TUNEL法检测神经细胞凋亡情况。结果与假手术组比较,模型组小鼠神经功能评分显著降低,随CVS时间延长,各组小鼠mGluR1 mRNA、mGluR1和p-ERK1/2蛋白均有不同程度增强,凋亡细胞增多,神经细胞出现变性坏死、神经轴索变性断裂。与模型组比较,拮抗剂组小鼠神经功能评分增加,mGluR1 mRNA、mGluR1和p-ERK1/2蛋白表达均有不同程度下调,神经细胞凋亡数目减少,脑组织形态学和超微结构损伤减轻。结论(1)CVS后mGluR1的表达增强可通过激活ERK信号途径诱导神经细胞凋亡。(2)mGluR1选择性拮抗剂LY367385对CVS损伤具有拮抗作用。
脑血管痉挛; 受体,代谢型谷氨酸; 细胞外信号调节激酶; 小鼠
脑血管痉挛(cerebral vasospasm,CVS)是蛛网膜下腔出血(subarachnoid hemorrhage, SAH)后最严重的并发症,严重影响患者的预后[1],其确切发病机制不详,目前临床上尚未有药物可以有效治疗[2]。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK) 信号途径是SAH后重要的信号转导通路。有证据表明,在大鼠脑缺血模型中,磷酸化ERK1/2(p-ERK1/2)的表达在脑动脉阻塞后1~4 h即增高[3],而且ERKl和ERK2的磷酸化可能与该区域神经细胞的生存密切相关。在闭合性脑创伤后p-ERK1/2阳性细胞和TUNEL阳性细胞存在共定位,应用ERK抑制剂U0126预处理可减少脑创伤后14 d脑部的损伤面积[4],提示ERK1/2可能在脑损伤过程中起重要作用,研究ERK1/2表达调控机制,对揭示脑损伤发病机制并寻找针对性防治药物有重要意义。近来有研究表明代谢型谷氨酸受体1 (metabotropic glutamate receptor 1,mGluR1)的激活能够诱导包括ERK1/2在内的多种激酶的活性[5],类似机制是否存在于CVS模型神经元凋亡过程仍不清楚。本研究应用SAH并CVS模型小鼠,观察mGluR1的选择性拮抗剂LY367385对脑海马区细胞凋亡及ERK1/2活化的影响,以期为寻找CVS有效的防治策略提供线索。
材 料 和 方 法
1主要试剂
mGluR1兔抗鼠单克隆抗体购自Labvision,p-ERK1/2兔抗鼠单克隆抗体购自Cell Signalling,mGluR1选择性拮抗剂LY367385购自Tocris,β-actin兔抗鼠单克隆抗体购自Sigma,原位末端缺刻标记法(TdT-mediated dUTP nick end labeling, TUNEL)试剂盒购自Roche。
2动物与分组
清洁级雄性ICR小鼠(北京维通利华动物中心)96只,批号为SCXK(京)2002-2003,体质量28~32 g,随机分为假手术组(sham组)20只、模型组[SAH+生理盐水(NS)组]38只和mGluR1的选择性拮抗剂LY367385干预组(SAH+LY367385组)38只。
3主要方法
3.1动物模型的建立与给药方法 麻醉消毒后,于手术显微镜下自小鼠右侧颈外动脉(arteria carotis externa, ECA)经颈内动脉(arteria carotis interna, ICA)导入5-0单纤维尼龙线,至大脑前动脉(anterior cerebral artery, ACA)与大脑中动脉(arteria cerebri media, MCA)分叉处,刺破动脉壁,总进入长度约为(10.0±0.5)mm。假手术对照组将尼龙线只送至MCA与ACA分叉处,稍感阻力即停止继续插入,并迅速退出尼龙线,结扎颈外动脉的断端,缝合皮肤,单笼饲养。利用脑立体定位仪于SAH后10 min用微量注射器向右侧脑室内缓慢注射mGluR1的选择性拮抗剂LY367385 5 μL,5 min注射完,留针10 min,再缓慢拔出微量注射器,NS组在相同时相仅注射等量的NS。
3.2神经功能评分 参照本课题组文献报道[6]方法并改进,每天1次。神经功能评分的总分为3~21分,其中运动功能0~12分,见表1,感觉功能3~9分,见表2。
3.3痉挛脑血管MCA病理改变病理检测 各组动物麻醉开胸,70 mmHg压力下经左心室灌注等渗盐水至流出液体清亮,4%多聚甲醛PBS(pH 7.2~7.4)缓冲液100 mL灌注,断头取脑,取大脑中动脉至大脑前动脉分叉处前后3 mm范围的脑组织冠状切开,入4%多聚甲醛后固定室温2 h,入4 ℃ 20%蔗糖磷酸盐缓冲液,应用恒冷箱切片机连续冠状切片,片厚20 μm。切片行HE染色,光镜下观察痉挛脑血管MCA病理改变。
3.4海马组织总RNA提取和RT-PCR检测 麻醉后断头取脑,分离海马,利用Trizol试剂提取总RNA。按照RNA扩增试剂盒说明书进行逆转录和PCR扩增。引物由上海生工生物工程技术公司合成,序列见表3。反转录反应条件为:42 ℃ 30 min,99 ℃ 5 min 5 ℃ 5 min。采用β-actin为内参照(各引物序列见表2)。β-actin PCR扩增条件:94 ℃ 2 min;94 ℃ 30 s;52 ℃ 30 s;72 ℃ 2.5 min,共30个循环,72 ℃ 10 min。扩增产物进行1%琼脂糖凝胶电泳,利用GIS凝胶成像系统进行积分吸光度(IA)分析, 以目的条带与内参照β-actin的IA比值表示相对表达水平。

表1 神经运动功能评分

表2 神经感觉功能评分

表3 引物序列
3.5蛋白免疫印迹法(Western biotting)检测mGluR1和p-ERK1/2表达 每组各取6只小鼠,断头取脑后冰上快速分离右侧海马,加入全细胞裂解液0.6 mL匀浆,12 000 r/min 4 ℃离心5 min, 取上清,考马斯亮蓝G 250结合法蛋白定量。样品制备,聚丙烯酰胺凝胶电泳转膜,分别加入p-ERK1/2 Ⅰ抗(1∶1 000),mGluR1(1∶800),β-actin(1∶1 000)封闭,免疫荧光化学发光法(ECL)显色。Bio-Rad系统进行吸光度测定,以目的条带与内参照β-actin的平均吸光度的比值表示蛋白水平进行半定量分析。
3.6TUNEL法检测海马CA1区神经细胞凋亡 按原位细胞凋亡检测试剂盒说明进行实验步骤,DAB显色。每个标本取4张切片,每张切片在海马随机选取4个视野,在400倍光镜下应用目镜网格测试系统,随机计数小鼠海马CA1区的阳性细胞数目。
3.7脑组织形态学与超微结构的观察 各组于相应时间点麻醉动物后用多聚甲醛水溶液进行心脏灌注,取材,应用恒冷箱切片机连续冠状切片,片厚20 μm,苏木素-伊红(HE)染色,光镜下观察并摄片。另取2只大鼠,麻醉后开胸、暴露心脏,戊二醛和多聚甲醛磷酸盐缓冲液混合固定液灌注心脏,取大脑海马组织制备常规透射电镜标本,醋酸铀-枸橼酸铅双染,透射电镜下观察脑组织超微结构。
4统计学处理

结 果
1CVS模型评价
模型组及拮抗剂干预组小鼠颅底均有较明显出血,血块分布广,累及整个Willis环,尤以MCA和ACA分叉处及ICA周围血块密度大;假手术组无出血,符合CVS模型制备要求。
2神经功能评分检测结果
SAH术后小鼠精神状态差,难进食水。术侧对侧的面部触觉、胡须触觉与耳后皮肤触觉等局部感觉受损;攀爬能力、平衡能力与本体感觉等均下降。双前肢伸直不对称,提尾令其前行时向左侧倾斜,17%小鼠出现左旋现象,符合CVS研究的要求。假手术组小鼠肌力正常,未出现神经功能缺损体征,神经功能评分为24分。与假手术组比较,模型组小鼠神经功能评分均显著降低(P<0.05)。与模型组比较,拮抗剂干预组24 h和48 h小鼠神经功能评分好转,差异有统计学意义(P<0.05),见图1。
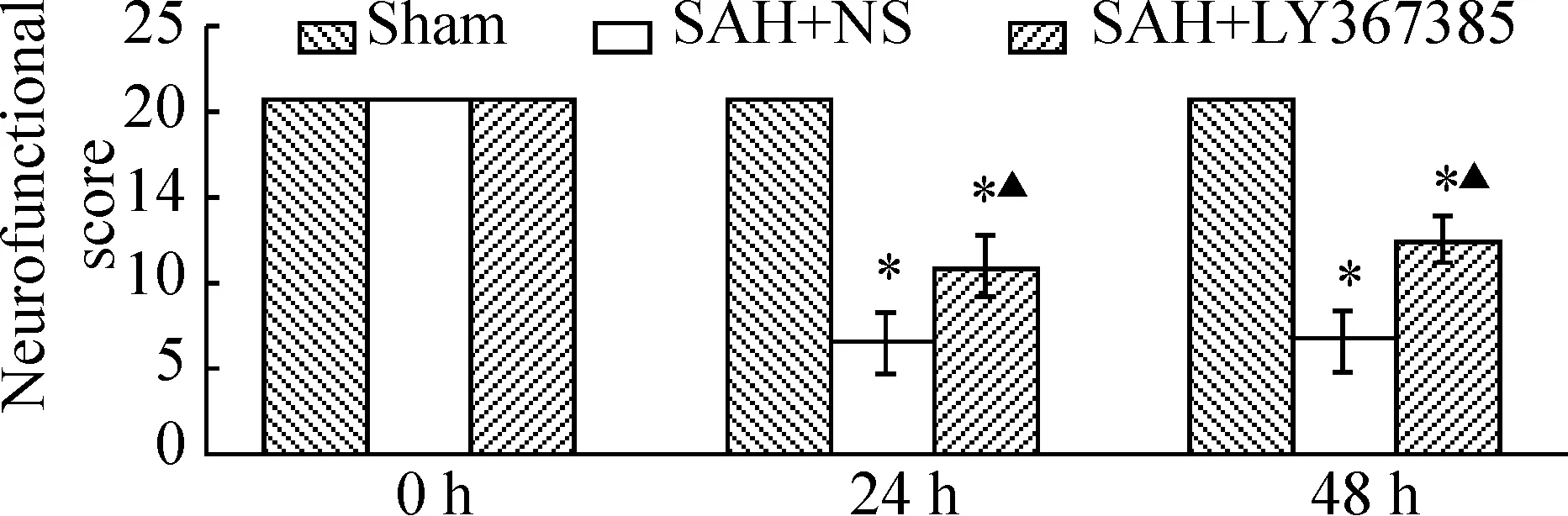

图1各组小鼠神经功能评分
3脑血管痉挛MCA形态改变
假手术组MCA管腔光滑,内皮细胞排列平整;术后模型组MCA产生严重痉挛,管腔明显狭窄,管壁显著增厚,内弹性膜呈折扇样弯曲,平滑肌细胞收缩,外膜炎性细胞侵润;治疗组MCA痉挛程度缓解,内弹性膜基本平坦,血管壁增厚及管腔狭窄程度亦明显改善。
4RT-PCR检测mGluR1mRNA
假手术组mGluR1 mRNA有少量表达。模型组术后6、24和48 h mGluR1 mRNA呈不同程度增高(0.25±0.02,0.39±0.01和0.14±0.02,均P<0.05)。与模型组比较,拮抗剂组各时点mGluR1 mRNA均不同程度减少,差异有统计学意义(0.16±0.01、0.23±0.01、0.09±0.02,均P<0.05)。
5Westernblotting检测海马区mGluR1和p-ERK1/2的表达
与RT-PCR检测结果一致,假手术组mGluR1蛋白有少量表达,造模后6 h mGluR1明显升高(P<0.05),24 h达高峰,以后呈下降趋势,至48 h时仍高于基础表达。与模型组比较,拮抗剂组各时点mGluR1均不同程度减少,差异有统计学意义(均P<0.05),见图2。
假手术组p-ERK1/2蛋白有少量表达,模型组p-ERK1/2水平于伤后6、24和48 h较假手术组显著增高,差异有统计学意义(均P<0.05);拮抗剂可显著降低6、24和48 h p-ERK1/2水平,24 h作用最为显著(均P<0.05),见图3。
6TUNEL法检测结果
凋亡神经细胞表现胞质浓缩,染色质凝集,核深染,呈深棕色颗粒状。造模后6~48 h海马CA1区可见TUNEL阳性细胞递增,差异均有统计学意义(均P<0.05);拮抗剂LY367385可显著减少各时点的凋亡细胞数目(均P<0.05),见图4。


图2Westernblotting检测海马区mGluR1蛋白水平变化

Figure 3. p-ERK1/2 protein expression in the hippocampus detected by Western blotting.*P<0.05vssham group;▲P<0.05vsSAH+NS group.
图3Westernblotting检测海马区p-ERK1/2蛋白水平变化


图4TUNEL法检测海马区凋亡细胞数目
7脑组织形态学变化
假手术组神经元结构完整,核膜清晰,胞质丰富。模型组海马区可见散在变性、坏死的神经元,神经细胞胞体收缩呈三角形,胞质嗜色性减弱,核皱缩浓染,细胞周围出现空隙;视野内可见核溶解及神经元细胞空泡样变,神经元存活数目明显减少。拮抗剂LY367385不同程度减轻神经元损伤,神经元数量有所恢复,结构有所改善,见图5。

Figure 5. Neuronal changes in different groups 48 h after CVS(HE staining, ×400).A: sham group;B:SAH+NS group; C:SAH+LY367385 group.
图5CVS48h各组小鼠神经元形态的变化
8脑组织超微结构变化
假手术组神经细胞核膜结构完整,边界清晰,核内染色质分布均匀;尼氏体和线粒体等细胞器数量丰富,形态规则,结构完整。模型组可见核膜结构崩解,核内染色质边集或片状聚集,尼氏体和线粒体等细胞器数量显著减少,线粒体嵴消失,呈现早期凋亡形态。拮抗剂LY367385可不同程度减轻细胞器损伤,线粒体、微管、高尔基复合体等结构较模型组改善,见图6。

Figure 6. The ultrastructure of hippocampal CA1 neurons in the three groups (×20 000). A: sham group;B:SAH+NS group; C:SAH+LY367385 group.
图6CVS48h各组小鼠海马CA1区神经元超微结构的变化
讨 论
mGluRs是一种重要的中枢神经系统兴奋性氨基酸受体,在脑内分布广泛,与相应的配体结合后主要产生兴奋作用。根据其氨基酸序列的同源性及药理性质,可分为3组:I组含mGluR1和mGluR5,II组由mGluR2和mGluR3组成,III组由mGluR4、mGluR6、mGluR7和mGluR8构成。第I组mGluRs激活后参与神经元的继发性损伤,而第Ⅱ和第Ⅲ组mGluRs激活后则会产生神经保护作用[7]。mGluR1不但在记忆、学习和突触传递效率的可塑性变化等生理过程中起着重要作用,还与多种神经精神疾病的发病机理密切相关。有研究证实该受体的激活与MAPK通路介导的细胞生长与凋亡相关[8],其活化能够诱导包括ERK1/2在内的多种激酶的活性。ERK1/2在CVS病理状态下的启动机制尚未明确,我们推测,mGluR1可能通过调控ERK1/2信号通路而对神经细胞的存活发挥了作用。为此,本实验设计采用mGluR1选择性拮抗剂LY367385加以干预,动态观测其对ERK1/2和神经细胞凋亡的影响,阐述其调控机制。结果发现LY367385可明显下调mGluR1及ERK1/2表达,减少TUNEL阳性细胞,并且改善了CVS后海马CA1区神经细胞坏死,提示CVS后mGluR1调控神经细胞的凋亡机制与ERK1/2信号途径相关。
ERK1/2是一种重要信号转导蛋白,能够将多种外界刺激经细胞质传人细胞核,并在这一过程中调控底物蛋白或基因表达,最终调控细胞的生物学反应。本研究观察到mGluR1在CVS初期已大量表达,24 h达高峰,在出血6~24 h同TUNEL阳性细胞的表达呈平行趋势,至48 h仍显著高于基础水平,此时凋亡细胞数目明显增多。提示,mGluR1部分影响了神经细胞的存活,其活化可能很大程度上调动了其下游相关基因从而启动凋亡程序。mGluR1的表达高峰远早于细胞凋亡,提示mGluR1可能是凋亡之路上游的始动因子。研究表明,mGluR1可通过磷脂酞肌醇(PI)途径一方面激活蛋白激酶C(PKC)增强NMDA受体介导的神经毒性;另一方面可使细胞内Ca2+浓度增高,引起神经递质释放、诱导相关基因表达、选择性促进神经元坏死和凋亡。Heidinger等[9]认为mGluR1可能是通过控制某些激酶活性来控制NMDA受体的酪氨酸残基磷酸化水平,进而增加神经细胞的兴奋毒性。
本实验中SAH初期,ERK1/2快速表达,至48 h仍高于基础水平,说明ERK表达时程明显延长,呈现过度激活状态,ERK1/2长时程活化的结果可能使转录因子的不同部位或者下游效应器被激活,促进了细胞凋亡的发生,推进SAH病理进程。研究证实,脑出血损伤后神经细胞凋亡的发生与神经功能改变具有相关性[10],凋亡现象在CVS形成机制中起重要作用[11],最终可能导致脑损伤后期的神经功能缺陷[12]。在两次注血SAH模型研究中显示,出血后基底动脉发生严重痉挛,基底动脉管径数值在首次注血后3、5、7 d时分别递减,ERK1/2表达水平在第3 d达到高峰,并持续至第7 d,ERK抑制剂PD98059可明显降低ERK1/2的表达水平,并可显著逆转CVS,使SAH后7 d时血管内径增加了26%[13],提示p-ERK1/2在CVS进程中起了重要的作用[14]。mGluR1拮抗剂减少了mGluR1、p- ERK1/2及神经细胞凋亡,进一步证实Glu位于ERK-凋亡通路的上游,抑制mGluR1和p- ERK1/2出血后高表达,可部分阻抑神经细胞凋亡。
综上所述,CVS模型小鼠在过量表达mGluR1的条件下,可上调ERK信号通路,影响神经细胞活性。mGluR1的选择性拮抗剂LY367385可减少p-ERK1/2的活化,抑制细胞凋亡,减少海马神经元损伤,具有神经保护作用。
[1] Takashi S,Vikram J,Robert A, et al. Thrombin inhibition by argatroban ameliorates early brain injury and improves neurological outcomes after experimental subarachnoid hemorrhage in rats[J]. Stroke, 2009, 40(4):1530-1532.
[2] Cengiz SL, Erdi MF, Avunduk MC, et al. The role of intravenous immunoglobulin in the treatment of cerebral vasospasm induced by subarachnoid haemorrhage: An experimental study[J]. Brain Inj, 2011, 25(10):965-971.
[3] Ferrer I, Friguls B, Dalfó E, et al. Early modifications in the expression of mitogen-activated protein kinase (MAPK/ERK), stress-activated kinases SAPK/JNK and p38, and their phosphorylated substrates following focal cerebral ischemia [J]. Acta Neuropathol,2003,105(5):425-437.
[4] Clausen F, Lundqvist H, Ekmark S,et al. Oxygen free radical-dependent activation of extracellular signal-regulated kinase mediates apoptosis-like cell death after traumatic brain injury[J]. J Neurotrauma, 2004, 21(9):1168-1182.
[5] Berkeley JL, Leveya I. Cell-specific extracellular signal-regulated kinase activation by multiple G protein-coupled receptor families in hippocampus[J]. Mol Pharmacol, 2003, 63(1):128-135.
[6] Gao J, Wang H, Sheng H, et al. A novel apoE-derived peptide therapeutic reduces vasospasm and improves outcome in a murine model of subarachnoid hemorrhage[J]. Neurocrit Care, 2006, 4(1):25-31.
[7] Hilton GD, Nunez JL, Bambrick L, et al. Glutamate-mediated excitotoxicity in neonatal hippocampal neurons is mediated by mGluR-induced release of Ca++from intracellular stores and is prevented by estradiol [J]. Eur J Neurosci, 2006, 24(11):3008-3016.
[8] Hideshima T,Akiyama M,Hayashi T, et al. Targeting p38 MAPK inhibits multiple myeloma cell growth in the bone marrow milieu[J]. Blood, 2003, 101(2):703-705.
[9] Heidinger V, Manzerra P, Wang XQ, et al. Metabotropic glutamate receptor 1-induced upregulation of NMDA receptor current: mediation through the Pyk2/Src-family kinase pathway in cortical neurons [J]. J Neurosci, 2002,22(13):5452-5461.
[10]Kawanabe Y, Masaki T, Hashimoto N. Involvement of epidermal growth factor receptor-protein tyrosine kinase transactivation in endothelin-1-induced vascular contraction[J].J Neurosurg, 2004, 100(6):1066-1071.
[11]Ayer RE, Zhang JH. Oxidative stress in subarachnoid haemorrhage: significance in acute brain injury and vasospasm[J]. Acta Neurochir Suppl, 2008,104(1):33-41.
[12]Cahill J, Calvert JW, Zheng JH. Mechanisms of early brain injury after subarachnoid hemorrhage [J]. J Cereb Blood Flow Metab, 2006, 26(11):1341-1353.
[13]Kusaka G, Kimura H, Kusaka I, et al. Contribution of Src tyrosine kinase to cerebral vasospasm after subarachnoid hemorrhage [J]. J Neurosurg, 2003, 99(2):383-390.
[14]Aoki K, Zubkov AY, Tibbs RE,et al. Role of MAPK in chronic cerebral vasospasm[J]. Life Sci, 2002, 70(16):1901-1908.
LY367385attenuatesneuronalapoptosisaftercerebralvasospasminmicebyinhibitingextracellularsignal-regulatedkinasepathway
LI Ran1, LIU Jiang1, CUi Jian-zhong2, WANG Hai-tao1, TIAN Yan-xia1, WANG Kai-jie2, ZHANG Yu-xin1, GAO Jun-ling1
(1SchoolofBasicMedicine,HebeiUnitedUniversity,2TangshanWorkers'Hospital,Tangshan063000,China.E-mail:junlinggao@163.com)
AIM: To investigate the effects of LY367385,a selective antagonist of metabotropic glutamate receptor 1 (mGluR1), on the apoptosis of neuron, and the role of extracellular signal-regulated kinase 1/2 (ERK1/2) signal pathway after cerebral vasospasm (CVS) in mice.METHODSThe model of subarachnoid hemorrhage (SAH) in mice was established by endovascular perforation without opening cranium. Male ICR mice were randomly divided into 3 groups: sham operation group, NS+SAH group and LY367385+SAH group. Ten minutes after SAH, 5 μL of LY367385 or NS was microinjected into lateral cerebral ventricle, and then the neurological scores of the animals were examined. At different time points (6 h, 24 h, 48 h) after operation, the pathological changes in the brain tissues were observed under light and electron microscopes. The mRNA expression of mGluR1 was detected using RT-PCR, and Western blotting was used to examine the protein levels of mGluR1 and p-ERK1/2. Apoptotic cell number was determined by TdT-mediated dUTP nick end labeling (TUNEL) method.RESULTSIn SAH+NS group, the scores of neurological function were significantly lower, while the mGluR1 mRNA, mGluR1 and p-ERK1/2 proteins and the number of apoptotic cells were significantly higher than those in sham operation group.Some neurons displayed histopathological changes of necrosis, myelin sheath internalization and disconnection. LY367385 decreased the mRNA expression of mGluR1 and protein levels of mGluR1 and ERK1/2.The neuronal apoptosis, neurological score and the ultrastructural changes were also improved.CONCLUSIONThe increased expression of mGluR1 in hippocampus may induce apoptosis by activation of ERK1/2 signaling after CVS. LY367385 exerts good therapeutic effect on severe CVS.
Cerebral vasospasm; Receptors,metabotropic glutamate; Extracellular signal regulated kinase; Mice
R743.35
A
10.3969/j.issn.1000-4718.2012.07.023
