运用GC-MS对三种不同方法提取的艾叶挥发油成分的比较分析
2012-11-06吕狄亚娄子洋
李 玲,吕 磊,董 昕,吕狄亚,娄子洋
(第二军医大学,a.药学院分析测试中心,上海 200433;b.东方肝胆外科医院药材科,上海 200438)
运用GC-MS对三种不同方法提取的艾叶挥发油成分的比较分析
李 玲a,吕 磊b,董 昕a,吕狄亚a,娄子洋a
(第二军医大学,a.药学院分析测试中心,上海 200433;b.东方肝胆外科医院药材科,上海 200438)
目的运用GC-MS对不同提取方法所得的艾叶挥发油成分进行比较分析。方法分别采用水蒸气蒸馏,正己烷回流,静态顶空提取艾叶挥发油,运用气相色谱-质谱联用技术,结合NIST05数据库对分离的化合物进行鉴定,并应用峰面积归一化法计算各成分的相对含量。结果3种方法共鉴别出艾叶中80个挥发油成分,其中静态顶空进样59个,水蒸气蒸馏37个,正己烷回流31个。结论结合水蒸气蒸馏和静态顶空进样两种方法可以建立更全面的艾叶挥发性成分GC-MS表征体系;静态顶空进样在挥发油成分鉴别上存在一定优势。
艾叶;气相色谱质谱联用;静态顶空进样;桉油精
艾叶为菊科植物艾ArtemisiaargyiLevi.et Vant的干燥叶,为历版《中国药典》(一部)收载的品种,具有散寒止痛、温经止血的功效[1]。大量的药理研究证明艾叶具有抗菌抗病毒,镇咳平喘,护肝利胆及抗过敏等作用[2,3]。艾叶的挥发油为其重要的有效成分,如桉油精具有平喘和抑制炎症等作用,可用于哮喘,神经痛及皮肤病的治疗[4]。另外艾叶挥发油对革兰阴性菌、革兰阳性菌、真菌均具有强抑菌作用,还对呼吸道合胞病毒有抑制作用[5],具有广阔的应用前景。
艾叶挥发油传统的提取方法主要有水蒸气蒸馏法、溶剂提取法、超临界流体萃取法等[6],其中以水蒸气蒸馏法最为常用,其提取工艺要求高温且提取时间较长,故一些低沸点的挥发性成分或热敏性成分容易被破坏;溶剂提取法可根据化合物性质的差异,采用不同的溶剂提取不同种类的化合物;顶空进样是通过样品基质上方的气体来测定该样品中的组分和含量一种间接分析方法, 该方法操作简便,样品用量少,既免除了冗长烦琐的样品前处理过程,又可避免有机溶剂带入的杂质对分析造成干扰,减少了对色谱柱污染及对分析人员和环境的危害,另外,与其它提取方法相比既可避免在除去溶剂或高温提取过程中引起挥发性成分的损失,又可降低共提物引起的噪音,具更高灵敏度和分析速度。艾叶挥发油成分的GC-MS分析已有报道[7~9],但未有将这三种方法进行比较分析的研究。本实验首次将水蒸气蒸馏,正己烷回流以及静态顶空进样得到艾叶挥发油进行GC-MS比较分析[10],为艾叶挥发油成分的鉴别及资源的合理利用提供了参考依据。
1 仪器和试剂
气相色谱Thermo Trace GC Ultra,质谱Thermo DSQII,顶空自动进样器Thermo Triplus HS(美国赛默飞世尔公司), Xcalibur工作站。挥发油测定器(上海华连医疗器械有限公司),METTLER AE240型电子天平(瑞士梅特勒公司);LX-02药材粉碎机(上海利祥公司)。
药材艾叶(产地安徽,批号20110803)购自上海雷允上大药房,经第二军医大学药学院生药教研室黄宝康副教授鉴定确为菊科植物艾ArtemisiaargyiLevi.et Vant的干燥叶。所用试剂正己烷为分析纯,水为重蒸水,载气为高纯氦气。
2 试验方法
2.1提取方法
2.1.1水蒸气蒸馏 取粉碎后的艾叶药材50 g,精密称定,置于圆底烧瓶中,加蒸馏水,按照2010年版《中国药典》(一部)附录“挥发油测定法”中甲法提取挥发油,得到淡绿色、味浓香的油状液体,样品以5ml正己烷溶解,稀释100倍后取1μl注入气相色谱仪。
2.1.2正己烷回流 取粉碎后的艾叶药材5g,精密称定,置具塞锥形瓶中,精密加入正己烷50 ml,称定重量,加热回流1h,放冷,再称定重量,用正己烷补足减失的重量,摇匀,滤过,取续滤液1 μl注入气相色谱仪。
2.1.3静态顶空 取粉碎后的艾叶药材0.1 g,精密称定,置10 ml顶空进样瓶中,用密封瓶盖密封;孵化箱温度110 ℃,孵化时间40 min,进样针温度115 ℃,进样体积1 ml。
2.2色谱及质谱条件
2.2.1色谱条件 色谱柱HP-5MS (30 m×0.25 mm,0.25 μm),分流比10:1,进样口温度200 ℃,程序升温:起始温度40 ℃,以3 ℃/min 的速率升至100 ℃,然后以10 ℃/min升至200 ℃并保持7 min,传输线温度250 ℃,载气为高纯氦气,流速1 ml/min。
2.2.2质谱条件 离子源:EI源;离子源温度:250 ℃;电子能量:70 ev;扫描范围(m/z):50~350。
3 结果
按2.1和2.2项下实验条件分别对艾叶进行提取分析,37 min得到艾叶挥发油成分的总离子流图,如图1所示。通过检索NIST05数据库,结合参考文献[11~14],以相似度SI>800为依据,初步鉴定出3种提取方法下得到的艾叶挥发油成分80个,以除溶剂以外的全部色谱峰面积作为100%,通过面积归一化法计算得出各成分的相对百分含量,结果如表1所示。
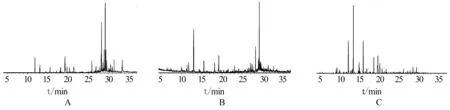
图1 艾叶挥发性成分总离子流图

表1 艾叶挥发性成分分析结果
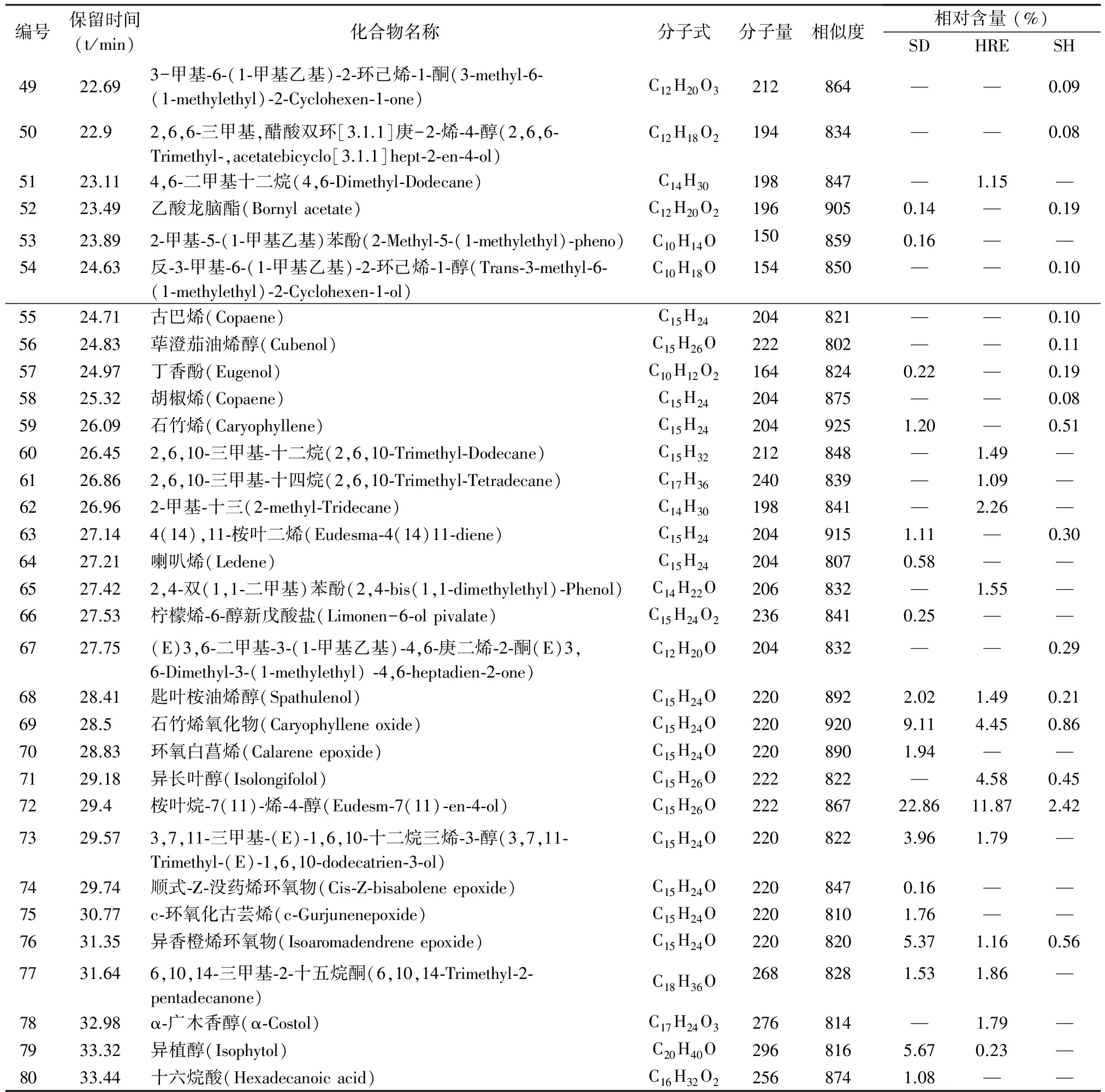
编号保留时间(t/min)化合物名称分子式分子量相似度相对含量(%)SDHRESH4922.693-甲基⁃6⁃(1⁃甲基乙基)⁃2⁃环己烯⁃1⁃酮(3⁃methyl⁃6⁃(1⁃methylethyl)⁃2⁃Cyclohexen⁃1⁃one)C12H20O3212864——0.095022.92,6,6⁃三甲基,醋酸双环[3.1.1]庚-2⁃烯⁃4⁃醇(2,6,6⁃Trimethyl⁃,acetatebicyclo[3.1.1]hept⁃2⁃en⁃4⁃ol)C12H18O2194834——0.085123.114,6⁃二甲基十二烷(4,6⁃Dimethyl⁃Dodecane)C14H30198847—1.15—5223.49乙酸龙脑酯(Bornylacetate)C12H20O21969050.14—0.195323.892⁃甲基⁃5⁃(1⁃甲基乙基)苯酚(2⁃Methyl⁃5⁃(1⁃methylethyl)⁃pheno)C10H14O1508590.16——5424.63反⁃3⁃甲基⁃6⁃(1⁃甲基乙基)⁃2⁃环己烯⁃1⁃醇(Trans⁃3⁃methyl⁃6⁃(1⁃methylethyl)⁃2⁃Cyclohexen⁃1⁃ol)C10H18O154850——0.105524.71古巴烯(Copaene)C15H24204821——0.105624.83荜澄茄油烯醇(Cubenol)C15H26O222802——0.115724.97丁香酚(Eugenol)C10H12O21648240.22—0.195825.32胡椒烯(Copaene)C15H24204875——0.085926.09石竹烯(Caryophyllene)C15H242049251.20—0.516026.452,6,10⁃三甲基⁃十二烷(2,6,10⁃Trimethyl⁃Dodecane)C15H32212848—1.49—6126.862,6,10⁃三甲基⁃十四烷(2,6,10⁃Trimethyl⁃Tetradecane)C17H36240839—1.09—6226.962⁃甲基⁃十三(2⁃methyl⁃Tridecane)C14H30198841—2.26—6327.144(14),11⁃桉叶二烯(Eudesma⁃4(14)11⁃diene)C15H242049151.11—0.306427.21喇叭烯(Ledene)C15H242048070.58——6527.422,4⁃双(1,1⁃二甲基)苯酚(2,4⁃bis(1,1⁃dimethylethyl)⁃Phenol)C14H22O206832—1.55—6627.53柠檬烯⁃6⁃醇新戊酸盐(Limonen-6⁃olpivalate)C15H24O22368410.25——6727.75(E)3,6⁃二甲基⁃3⁃(1⁃甲基乙基)⁃4,6⁃庚二烯⁃2⁃酮(E)3,6⁃Dimethyl⁃3⁃(1⁃methylethyl)⁃4,6⁃heptadien⁃2⁃one)C12H20O204832——0.296828.41匙叶桉油烯醇(Spathulenol)C15H24O2208922.021.490.216928.5石竹烯氧化物(Caryophylleneoxide)C15H24O2209209.114.450.867028.83环氧白菖烯(Calareneepoxide)C15H24O2208901.94——7129.18异长叶醇(Isolongifolol)C15H26O222822—4.580.457229.4桉叶烷⁃7(11)⁃烯⁃4⁃醇(Eudesm⁃7(11)⁃en⁃4⁃ol)C15H26O22286722.8611.872.427329.573,7,11⁃三甲基⁃(E)⁃1,6,10⁃十二烷三烯⁃3⁃醇(3,7,11⁃Trimethyl⁃(E)⁃1,6,10⁃dodecatrien⁃3⁃ol)C15H24O2208223.961.79—7429.74顺式⁃Z⁃没药烯环氧物(Cis⁃Z⁃bisaboleneepoxide)C15H24O2208470.16——7530.77c⁃环氧化古芸烯(c⁃Gurjunenepoxide)C15H24O2208101.76——7631.35异香橙烯环氧物(Isoaromadendreneepoxide)C15H24O2208205.371.160.567731.646,10,14⁃三甲基⁃2⁃十五烷酮(6,10,14⁃Trimethyl⁃2⁃pentadecanone)C18H36O2688281.531.86—7832.98α⁃广木香醇(α⁃Costol)C17H24O3276814—1.79—7933.32异植醇(Isophytol)C20H40O2968165.670.23—8033.44十六烷酸(Hexadecanoicacid)C16H32O22568741.08——
4 讨论
本实验采用了传统的水蒸气蒸馏,正己烷回流和静态顶空进样3种方法提取艾叶的挥发油,初步鉴别出80个成分,其中静态顶空进样59个,水蒸气蒸馏37个,正己烷回流31个。通过NIST05谱库检索,并采用峰面积归一化法计算,其主要成分及相对含量存在一定差异。用水蒸气蒸馏法得到的挥发油中桉叶烷-7(11)-烯-4-醇和氧化石竹烯的相对含量较高,分别为22.86%和9.11%;在正己烷回流中相对含量较高的成分为桉油精和桉叶烷-7(11)-烯-4-醇,分别为13.21%和11.87%;在静态顶空进样中相对含量较高的成分为桉油精和蒿醇,分别为38.56%和8.99%。
水蒸气蒸馏法是中药挥发油提取中最经典的方法,操作相对容易,成本较低,适用于绝大多数的中药挥发油的提取。由图1可以看出,水蒸气蒸馏法提取的挥发油成分相对含量较高的组分主要集中在25~35 min时间段,为沸点相对较高的一些成分,而在静态顶空进样中相对含量较高的组分主要集中在10~20 min时间段,为沸点相对较低的一些成分。由于水蒸气蒸馏法提取时间较长,温度较高,提取过程中一些沸点较低及易氧化的成分容易丢失。静态顶空进样对于这些低沸点的成分保留良好,但由于顶空进样的孵化箱加热温度的高温限制,一些高沸点的成分难以完全被提取检测到。因此,将水蒸气蒸馏法和静态顶空进样结合起来分析,有利于建立更全面的艾叶挥发油成分的化学信息。
正己烷回流得到的艾叶挥发油的主要成分为桉油精,桉叶烷-7(11)-烯-4-醇,长链脂肪酸及长链烷烃等,从成分上看,该方法与水蒸气蒸馏法提取的挥发油的在数量上没有明显的差异。从峰相对含量上看,正己烷回流提取所得艾叶的主要有效成分桉油精相对含量最高,进一步佐证了2010年版《中国药典》用正己烷回提取艾叶中的桉油精并测定其含量作为艾叶的质量控制标准的意义。
静态顶空进样操作简单,样品用量少,不需要任何溶剂,不需要高温提取,既减少了污染又避免了一些热敏性成分的破坏,在中药挥发油的定性分析中已有较多的应用。在定量方面,含量测定的方法还未得到完全认可,但已有报道用顶空进样结合标准加入法测定中药材中挥发性成分的含量[15]。随着顶空进样在中药挥发性成分分析中越来越多的应用,相信在含量测定方面也会得到更多的肯定。
[1] 中国药典2010版.一部[S].2010:82.
[2] 周 峰,秦路平,连佳芳.艾叶的化学成分生物活性和植物资源[J].药学实践杂志,2000,18(2):96.
[3] 梅全喜,高玉桥.艾叶化学及药理研究进展[J].中成药,2006,28(7):1030.
[4] 徐巧萍,王 砚,唐法娣,等.1,8-桉油精对卵白蛋白致哮喘豚鼠的气道高反应性和炎症的抑制作用[J].中国药理学与毒理学杂志,2010,24(1):35.
[5] 韩 轶,戴 璨,汤璐瑛.艾叶挥发油抗病毒作用的初步研究[J].氨基酸和生物资源,2005,27(2):14.
[6] 鲁 争,鲁 玉,左 杰,等.艾叶挥发油提取工艺研究[J].时珍国医国药,2011,22(2):389.
[7] 兰美兵,余永莉,李啸红.贵州产艾叶挥发油的化学成分分析[J]. 药物分析杂志,2009,29(8):1305.
[8] 钱 伟,韩 乐,刘训红,等.野艾叶与艾叶的挥发性成分HSGC-MS比较分析[J].中华中医药学刊,2010,28(8):1766.
[9] 何正有,张艳红,魏 冬,等. 湖北产鲜艾与陈艾挥发油的化学成分[J].中成药,2009,31(7):1079.
[10] 温莉莉,王海英,蒋乃翔.小蓬草鲜叶正己烷提取物化学组分分析[J].中国林副特产,2009,(3):8.
[11] 刘向前,陈素珍,倪 娜.湖南产艾叶挥发油成分的GC-MS研究[J].中药材,2005,28(12):1069.
[12] 郭承军.山东艾叶与野艾叶的挥发油比较研究[J].中草药,2001,32(6):500.
[13] 吴怀恩,韦志英,朱小勇,等. 超临界CO2流体萃取法提取艾叶与五月艾挥发油成分的研究[J]. 广西中医学院学报,2008,11(4):31.
[14] 徐新建,宋 海,韩玉琦,等.艾叶挥发油化学成分的气相色谱-质谱联用分析[J].时珍国医国药,2007,18 (11):2657.
[15] 张小溪,郭 星,吴雪缘,等.顶空气相色谱法测定砂仁中樟脑、龙脑、乙酸龙脑酯的含量[J].中药材,2009,32(6):904.
AnalysisofvolatileoilfromArtemisiaargyiLevi.etVantextractedbythreedifferentmethodsbyGC-MS
LI Linga, LV Leib, DONG Xina, LV Di-yaa,LOU Zi-yanga
(Second Military Medical University,a.Pharmaceutical Analysis Center, School of Pharmacy,Shanghai 200433,China; b.Department of Pharmacy, Shanghai Eastern Hepatobiliary Surgery Hospital, Shanghai 200438,China)
ObjectiveTo analyze the the compositions of volatile oil fromArtemisiaargyiLevi.et Vant extracted by three different methods by GC-MS.MethodsThe volatile oil fromArtemisiaargyiLevi.et Vant were extracted by Steam distillation, Hexane reflux extraction and Static headspace. GC-MS was used for the separation and identification.ResultsBy the three methods, 80 compounds were identified. 59 components were extracted by static headspace, 37 by steam distillation and 31 by hexane reflux extraction.ConclusionCombination of steam distillation and static headspace, sampling was feasible to establish GC-MS representation system forArtemisiaargyiLevi.et Vant; there were certain advantages of static headspace in determination of volatile oil contant.
ArtemisiaargyiLevi.et Vant;GC-MS;static headspace;eucalyptol
李 玲,女,硕士研究生,实验师.E-mail:316262150@163.com.
[作者简介] 娄子洋.Tel:(021)81871335,E-mail:louziyang@126.com.
R917
A
1006-0111(2012)04-0279-05
10.3969/j.issn.1006-0111.2012.04.09
2012-05-08
2012-05-29
