W nt诱导分泌蛋白3对软骨细胞增殖分化的作用
2012-11-06马丽珍詹宇红
黄 佼 马丽珍 詹宇红 陈 军
Wnt诱导分泌蛋白3(Wnt-inducible secreted protein 3,WISP3)基因定位于染色体6q21~22,编码1个354个氨基酸的蛋白质,分子质量大约40kDa,由4个结构域构成,每一个结构域由对应的基因外显子编码,外显子1编码信号肽,外显子2编码的结构域与胰岛素样生长因子结合蛋白(IGFBP)氨基末端同源,根据WISP3蛋白结构提示其功能与某些其他蛋白质具有相似性。WISP3基因突变与晚发型脊柱骨骺发育不良伴进行性骨关节病(spondyloepiphyseal dysplasia tarda with progressive arthropathy,SEDT -PA)的发病密切相关[1,2]。SEDT -PA 是一种主要累及软骨组织的常染色体隐性遗传性疾病,1982年由Wynne-Davies等首先报道,该病的组织学表现为静止带和生长带的软骨细胞呈巢样聚集,提示该疾病可能是由于关节软骨的原发性病变所致[3]。
研究证明胰岛素样生长因子-1(IGF-1)可介导软骨细胞外基质的上调WISP3蛋白质结构域1与胰岛素样生长因子结合蛋白(IGFBPs)的结构同源,推测WISP3促进软骨细胞Ⅱ型胶原和蛋白聚糖的表达可能与 IGF-1信号通路有关[4~6]。本实验研究WISP3蛋白对人永生化软骨细胞增殖和分化的作用,并初步探讨这些作用是否与IGF-1信号通路相关,并为进一步阐明SEDT-PA发病机制提供一定的理论基础。
材料与方法
1.实验细胞及主要试剂:无酚红的DMEM培养液、胰酶-EDTA、Aprotinin和苯甲基磺酰氟(PMSF)(Sigma公司,St.Louis,MO,USA);胎牛血清(FBS)(GIBICO 公司,Grand Island,NY);β - actin 鼠抗(Sigma公司,St.Louis,MO,USA);兔抗WISP3多克隆抗体;羊抗Ⅱ型胶原多克隆抗体;辣根过氧化物酶标记的抗兔、抗羊、抗鼠的二抗Santa Cruz(Santa Cruz,CA,USA);预染蛋白质分子质量Maker购自Fermentas公司;人重组WISP3蛋白(rhWISP3),人重组IGF-1蛋白(rhIGF-1)(Peprotech,London,UK);硝酸纤维素膜和ECL试剂盒购于Amersham Pharmacia公司 (Arkington Heights,IL,USA)。人永生化软骨细胞株T/C-28a2由Mary B.Goldring教授惠赠。
2.T/C-28a2细胞株培养及干预:人软骨细胞株T/C-28a2用 DMEM/Ham'F -12(1∶1,v/v)混合培养液(Sigma,D0547)在37℃,5%CO2条件下培养。每3~5天换液1次,细胞汇片后用 0.05% 胰酶 -EDTA(0.05% 胰酶,0.53mmol/L EDTA,GBICO#25300-054)消化。T/C-28a2细胞接种于24孔板,接近汇片时弃培养液,换无血清培养基(含0.25%BSA)饥饿24h,用重组 WISP3 蛋白 0、100、200、400、800、1600ng/ml干预24h,抽提细胞总蛋白用免疫印记分析软骨细胞Ⅱ型胶原的表达。
3.细胞增殖测定:T/C-28a2细胞接种到24孔板,每孔500μl培养液,每组设3个平行孔。接近汇片时弃培养液,换无血清培养基(含0.25%BSA)饥饿24h,在有或无20ng/ml rhIGF -1 诱导下,用 rhWISP3 0、100、200、400、800、1600ng/ml干预24h。80%~90%融合时加入[3H]-脱氧胸腺嘧啶进行([3H]-TdR)标记,继续培养8h后轻轻弃去培养液,加入2m l预冷的10%三氯乙酸(TCA)液10min,10%TCA液反复洗涤3 次。24 孔板加入03N NaOH·SDS 液0.5ml,60℃,30min。冷却到室温,收集细胞裂解液,加入3ml闪烁液,液闪仪测量各孔每分钟放射性活性(cpm值)。通过测定细胞内标记的量[3H]-TdR,反映细胞增殖活性。
4.IGF-1信号通路的初步研究:T/C-28a2细胞接种到24孔板接近汇片时弃培养液,换无血清培养基(含0.25%BSA)饥饿24h后,在有或无IGF-1信号通路的阻断剂JB1(1.0 μg/ml)干预的情况下,用 rhWISP3(400μg/m l)和(或)rhIGF-I(20ng/ml)干预24h,抽提细胞总蛋白用免疫印记分析软骨细胞Ⅱ型胶原的表达。
5.蛋白免疫印迹(Western blot):取细胞40μg总蛋白与4×SDS加样缓冲液混匀,100℃ 加热蛋白变性5min,点样于10%SDS-PAGE胶中电泳,再电转移至PVDF膜上。PVDF膜用含5%脱脂奶粉的PBS-吐温封闭1h,用含人Ⅱ型胶原抗体(1∶500稀释)的PBS温育2h,PBS-吐温洗膜10min×3次。用含辣根过氧化物酶标记抗鼠二抗(1∶4000稀释)的PBS孵育1h,PBS-吐温洗膜10min×3次,洗膜后ECL发光自显影,洗片显带。同一张膜洗脱后,用1∶1000稀释的羊抗鼠β-actin(sc1616,Santa Cruz公司)一抗,辣根过氧化物酶标记抗羊二抗(1∶4000稀释)重新杂膜,发光自显影,洗片显带作为内对照。所有杂交信号在成像分析仪系统测定条带密度。Ⅱ型胶原蛋白目的条带水平以Ⅱ型胶原/β-actin的光密度比值表示。
6.统计学方法:各实验独立重复3次以上,重复性好。所选图表为重复实验的结果之一。数据结果均数±标准差(x±s)采用SPSS 11.0软件进行统计,组间比较用方差分析,以P<0.05为差异有统计学意义。
结 果
1.rhWISP3对软骨细胞增殖的作用:根据[3H]-TdR 参 入 法,与 对 照 组 比 较 100、200、400、800、1600ng/ml rhWISP3蛋白干预对软骨细胞增殖无明显影响。各浓度液闪仪计数cpm值分别为76500.3±1200.8、76202.8 ± 1005.6、77463.6 ± 1356.3、75100.5 ±2423.6、75036.2 ±1698.3、74632.8 ±1896.4 次/分(图1)。
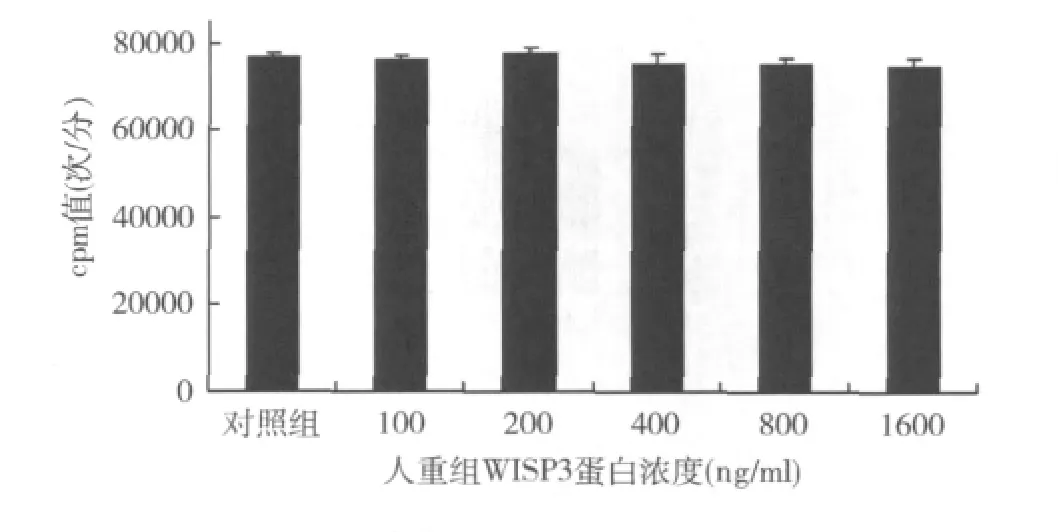
图1 不同浓度rhW ISP3对T/C-28a2细胞增殖活性的影响
2.rh IGF-1对软骨细胞增殖的作用:与对照组比较,20ng/ml rhIGF-1(对照组1)干预显著促进软骨细胞增殖(130134.7 ±1789.6 次/分,76500.3 ±1200.8 次/分,图2)。
3.rhWISP3对rh IGF-1促进软骨细胞增殖的作用:不同浓度rhWISP3干预对rh IGF-1促增殖作用无明显影响 (130134.7±1789.6,132580.3±2563.2,130069.4 ± 1963.4,131523.3 ± 2203.9,133567.3 ±2765.3,129980.6 ±2253.6,图2)。
4.rhWISP3促进软骨细胞表达Ⅱ型胶原,呈剂量依赖性:Western blot印记杂交检测显示rhWISP3不同浓度能显著促进T/C-28a2细胞表达Ⅱ型胶原,从50~1600ng/ml呈剂量依赖性(图3)。
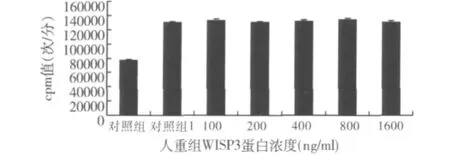
图2 不同浓度rhW ISP3蛋白对rh IGF-I促细胞增殖活性的影响
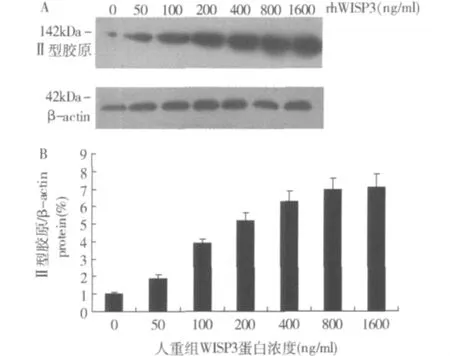
图3 rhW ISP3促进软骨细胞Ⅱ型胶原表达
5.rhWISP3对IGF-1信号通路的影响:Western blot印记杂交检测显示rhWISP3或rh IGF-1单独干预T/C-28a2细胞均能显著促进细胞表达Ⅱ型胶原。IGF-1信号通路的阻断剂JB1干预的情况下,能取消rh IGF-1促进Ⅱ型胶原表达的作用。JB1不能取消rhWISP3促进软骨细胞Ⅱ型胶原表达的作用(图4)。
讨 论
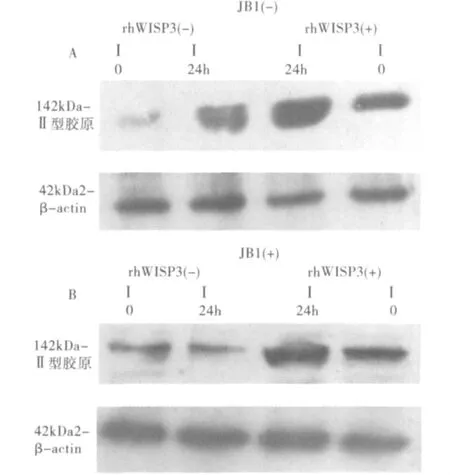
图4 JB1干预细胞前后对Ⅱ型胶原表达的影响
由于人原代软骨细胞难于获得,且从活体分离后的细胞失去其正常的生活环境,几乎没有增殖活性,本实验选用的软骨细胞株T/C-28a2,是来源于青少年的肋软骨,通过原代细胞转染编码SV40抗原的反转录病毒获得永生化的软骨细胞株,是现今研究软骨细胞特异性基因表达调节的一种重复性较好的软骨细胞模型,能特异性的表达Ⅱ型胶原、蛋白聚糖和SOX-9[8]。人永生化的软骨细胞株与原代细胞相比也有一些局限性,如有较强的增殖活性,而表达细胞外基质的能力较弱,所以它并不能完全取代人原代软骨细胞用于研究软骨细胞功能。本研究发现rh-WISP3对T/C-28a2软骨细胞增殖无明显影响,而rh IGF-1能显著促进软骨细胞增殖。rh IGF-1促增殖作用是通过活化IGF-1R,继而活化下游的IRS-1及MAPK信号通路而产生作用。不同浓度rh-WISP3干预对rh IGF-1促增殖作用无明显影响。Matsumoto等[9]的实验证实IGFBP-3能显著抑制rh IGF-1促增殖作用,而IGFBP-5不能抑制rh IGF-1促增殖作用。虽然WISP3结构域IGFBP与IGFBPs同源,且可能具有类似的功能,但是即使同属IGFBPs的IGFBP-3和IGFBP-5也可能对细胞增殖有不同的影响。
Ⅱ型胶原是软骨细胞外基质的主要特异性成分,是成熟软骨细胞分化的典型标志,SEDT-PA一个可能的发病机制是细胞成熟障碍[10]。本实验研究发现rhWISP3促进软骨细胞表达Ⅱ型胶原,呈剂量依赖性,表明WISP3基因能明显地促进软骨细胞的分化,这与Sen等的实验结果相似。Sen等将野生型和SEDT-PA相关的WISP3基因突变(Cis78-Arg)转染人永生化软骨细胞株T/C-28a2,结果显示转染野生型WISP3基因Ⅱ型胶原表达增加。但该实验结果并未在动物实验中复制成功,WISP3基因敲除的小鼠并未出现SEDT-PA的表型,转染WISP3基因的小鼠也未出现与野生型小鼠不同的表型,体内实验与体外实验结果差异的原因至今仍未阐述清楚[11,12]。
我们的实验欲初步探讨WISP3基因上调Ⅱ型胶原表达是否通过IGF-1信号通路。实验中使用IGF-1信号通路的阻断剂JB1。JB1是一种IGF-1的类似物,能与IGF-1R结合而抑制IGF-1R自身的磷酸化,在功能上表现为IGF-1信号通路的阻滞剂。
多个实验室均证明IGF-1上调Ⅱ型胶原的的表达,本实验用JB1阻断IGF-1信号通路的作用后,取消了IGF-1介导的Ⅱ型胶原的上调[13]。Western blot印记杂交检测显示rhWISP3或rh IGF-1均能显著促进T/C-28a2表达Ⅱ型胶原。IGF-1信号通路阻断剂JB1干预的情况下,能取消rh IGF-1促进Ⅱ型胶原表达的作用,但JB1不能取消rhWISP3促进软骨细胞Ⅱ型胶原表达的作用。此实验结果提示WISP3可能不是通过IGF-1信号通路产生促细胞外基质上调的作用。这与Lorenzatti等在炎性乳腺癌(inflammatory breast cancer,IBC)中的研究结果有差异,他们的研究认为rhWISP3能通过IGF-1信号通路抑制乳腺癌细胞转录因子ZEB1的表达,减弱乳腺癌细胞的侵袭能力[14]。不同位点的WISP3基因突变与SEDT-PA的发病密切相关,WISP3基因也是一种肿瘤抑制基因,Kleer等发现80%IBC组织中不表达WISP3基因,稳定转染WISP3基因的SUM149细胞部分取消了IBC肿瘤组织血管生成能力[15]。但SEDT-PA患者并没有报告有更高的IBC的发病率,即使是同一个基因的不同突变形式也可能通过不同的信号通路发生作用,产生不同的生物学功能。
综上所述,在体外实验中rhWISP3显著促进了Ⅱ型胶原的表达,这种促表达的作用可能是通过独立于IGF-1信号通路而产生的,但SEDT-PA的具体发病机制仍需进一步的研究。
1 Ye J,Zhang HW,Wang T,et al.Clinical diagnosis and WISP3 gene mutation analysis for progressive pseudorheumatoid dysplasia[J].Zhonghua Er Ke Za Zhi,2010,48(3):194 - 198
2 Temiz F,Ozbek MN,Kotan D,et al.Ahomozygous recurring mutation in WISP3 causing progressive pseudorheumatoidarthropathy[J].JPediatr Endocrinol Metab,2011,24(1 -2):105 -108
3 Hurvitz JR,SuwairiWM,Van HW,et al.Mutations in the CCN gene family member WISP3 cause progressive pseudorheumatoid dysplasia[J].Nat Genet,1999,23(1):94 -98
4 Wang Y,Cheng Z,Elalieh HZ,et al.IGF -1R signaling in chondrocytes modulates growth plate development by interacting with the PTHrP/Ihh pathway[J].J Bone Miner Res,2011,26(7):1437 -1446
5 Clemmons DR,Busby WH,Garmong A,et al.Inhibition of insulin -like growth factor binding protein 5 proteolysis in articular cartilage and joint fluid results in enhanced concentrations of insulin-like growth factor 1 and is associated with improved osteoarthritis[J].Arthritis Rheum,2002,46(3):694 -703
6 Sen M,Cheng YH,Goldring MB,et al.WISP3 -dependent regulation of type II collagen and aggrecan production in chondrocytes[J].Arthritis Rheum,2004,50(2):488 -497
7 Goldring MB,Birkhead JR,Suen LF,et al.Interleukin - 1 beta -modulated gene expression in immortalized human chondrocytes[J].J Clin Invest,1994,94(6):2307 - 2316
8 Chiu LH,Chen SC,Wu KC,et al.Differential effect of ECMmolecules on re-expression of cartilaginousmarkers in near quiescent human chondrocytes[J].JCell Physiol,2011,226(8):1981 - 1988
9 Matsumoto T,Tsurumoto T,Goldring MB,et al.Differential effects of IGF-binding proteins,IGFBP-3 and IGFBP-5,on IGF-I action and binding to cell membranes of immortalized human chondrocytes[J].JEndocrinol,2000,166(1):29 -37
10 KutzWE,Gong Y,Warman ML,etal.WISP3,the gene responsible for the human skeletal disease progressive pseudorheumatoid dysplasia,is not essential for skeletal function inmice[J].Mol Cell Biol.2005,25(1):414-421
11 Nakamura Y,Cui Y,Fernando C,et al.Normal growth and development in mice over- expressing the CCN familymemberWISP3[J].J Cell Commun Signal,2009,3(2):105 -113
12 Yang Y,Liao E.MutantWISP3 triggers the phenotype shiftof articular chondrocytes by promoting sensitivity to IGF-1 hypothesis of spondyloepiphyseal dysplasia tarda with progressive arthropathy(SEDTPA)[J].Med Hypotheses,2007,68(6):1406 - 1410
13 LorenzattiG,HuangW,Pal A,et al.CCN6(WISP3)decreases ZEB1-mediated EMT and invasion by attenuation of IGF-1 receptor signaling in breast cancer.[J].JCell Sci,2011,124(Pt 10):1752 -1758
14 Ye J,Zhang HW,Qiu WJ,et al.Patientswith progressive pseudorheumatoid dysplasia:from clinical diagnosis to molecular studies.[J].Mol Med Report,2012,5(1):190 -195
15 Kleer CG,Zhang Y,Pan Q,etal.WISP3 isa novel tumor suppressor gene of inflammatory breast cancer[J].Oncogene,2002,21(20):3172-3180
