壳聚糖对大肠埃希菌生物被膜耐药性的影响
2012-11-05胡金树于庆杰朱一堂丁继生
胡金树,于庆杰,朱一堂,丁继生
(沧州市中心医院 检 验科,河北 沧 州061001)
细菌生物被膜是发生呼吸机相关性肺炎的重要原因,在对生物被膜的研究中很多物质能抑制生物被膜,但增加了细菌的耐药性,本文主要研究壳聚糖对大肠埃希菌生物被膜的影响。
1 材料与方法
1.1 材料
1.1.1 菌株 实验菌株:临床标本中分离,经API20E鉴定的大肠埃希菌;药敏质控菌株ATCC25922,肺炎克雷伯菌ATCC700603、阴沟肠杆菌029M购自卫生部临床检验中心。
1.1.2 材料和仪器 壳聚糖:分子量30万,脱乙酰度大于85%,浙江金壳生物化学有限公司;气管导管规格8.0 mm,广州韦士泰医疗器械有限公司。
药敏纸片:OXIOD公司,分别是哌拉西林/他唑巴坦(TZP)、左氧沙星(LEV)、亚胺培南(IPM)、庆大霉素(CN)、阿米卡星(AK)、头孢曲松(CRO)、头孢噻肟(CTX)、头孢他啶(CAZ)、头孢呋新(CXM)、阿莫西林/棒(AMC)、头孢西丁(FOX)、头孢噻肟/克拉维酸 (CTX/CLAX)、头孢他啶/克 拉 维 酸(CAZ/CLAV)。
仪器:扫描电子显微镜:日本电子JSM-5600LV型。
1.2 方法
1.2.1 大肠埃希菌生物被膜模型的培养 称量壳聚糖适量放入3%乙酸溶液10 ml中浸泡后,加入适量甘油和无水乙醇搅拌均匀,在导管内壁涂层,自然干燥后放入10%NaOH溶液中固定20 min,用蒸馏水冲洗至中性。取新鲜菌落放入生理盐水,调至吸光度为0.145,以此作为菌悬液。按文献方法[1]并改良。吸取0.1 ml菌悬液种入含有4.9 ml生理盐水及1 cm长导管的无菌杯中(导管水平放置),36℃培养,隔日更换液体,培养7 d得到BF。7天后,将导管的外壁用酒精纱布反复擦拭,生理盐水反复冲洗其内壁、外壁和套囊孔,以去除未粘附细菌及残余酒精。
1.2.2 实验分组 空白组为浮游菌组,对照组为由空白导管制备的生物被膜组,实验组为包被分子量30万壳聚糖的导管制备的生物被膜组,每组标本为12例。
1.2.3 扫描电镜观察对照组和实验组
1.2.4 酶的检测和细菌药敏 ESBLs的检测,CTX、CTX/CLAX 及 CAZ、CAZ/CLAV 中任何1对纸片抑菌环直径差≥5 mm时,判断为ESBLs阳性株。肺炎克雷伯ATCC700603作为阳性对照。Amp C的检测,先用FOX检测,抑菌环直径≤18 mm的菌株,若FEP、TPM 表现为敏感,而CTX、CTX/CLAX 和 CAZ/CLAV 表现为耐药,或在CTX、CTX/CLAX和CAZ/CLAV的抑菌环内存在散在的菌落,判断为Amp C阳性。阴沟肠杆菌029M作为AmpC酶阳性对照,肺炎克雷伯ATCC700603作为Amp C酶阴性对照。药敏采用KB法,判断标准以CLSI为准则。
1.2.5 统计方法 两组之间各酶的检出率进行χ2检验,设P<0.05有显著统计学差异。
2 结果
2.1 对照组和实验组的电镜照片 图中对照组细菌数量明显比实验组多,不但证明该方法能够形成生物被膜,还证明30万分子量的壳聚糖能抑制大肠埃希菌的生物被膜。
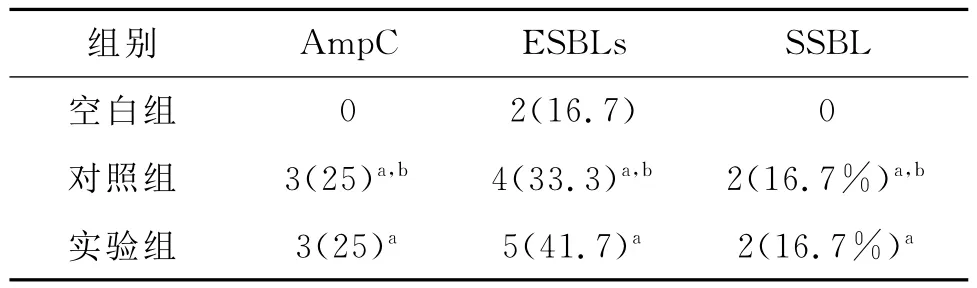
表1 各组酶的检出结果(菌株/检出率%,n=12)

图1 各实验组的电镜照片
2.2 药敏结果 各组对亚胺培南的耐药率最低,其次是对加酶抑制剂的抗生素耐药率较低,对照组、实验组对抗生素的耐药性高于空白组。整个结果见表2。
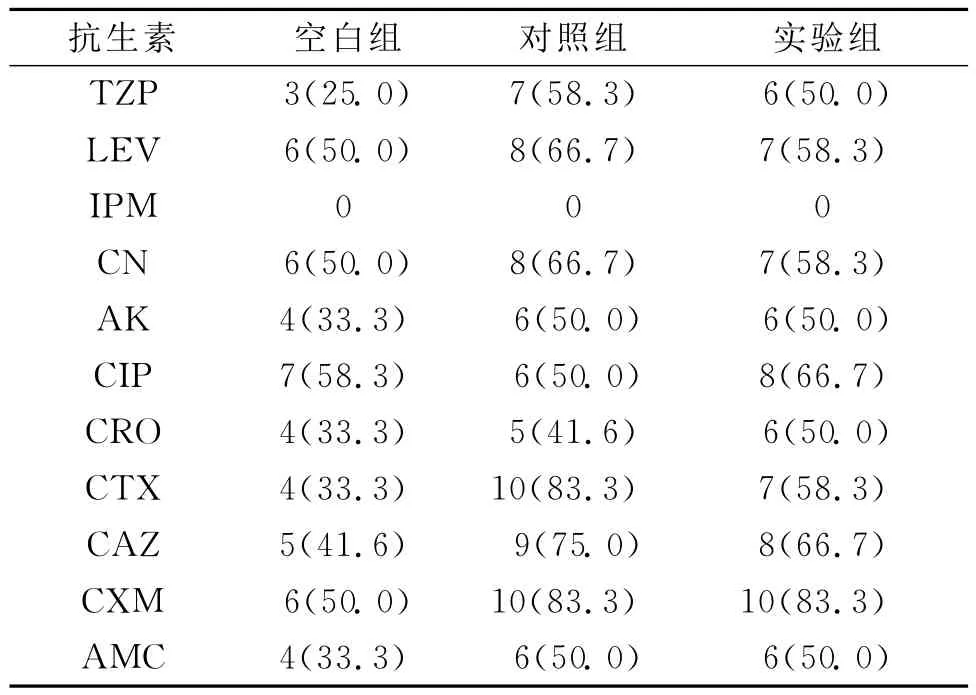
表2 各组的药敏率(菌株/耐药率%)
随着对生物被膜的研究,发现了许多物质对其有抑制作用,但有的增加了耐药性[2]、对人体毒性[3]等副作用。壳聚糖是不但对人体细胞无毒[4],而且能够抑制生物被膜的形成[5]。
本实验首次选用大肠埃希菌来研究壳聚糖对生物被膜细菌耐药性的影响。耐药性的比较以ESBLs和AmpC来研究。ESBLs由质粒介导,可通过接合、转化和传导等方式在细菌种属之间进行传递。Amp C酶是指由革兰阴性杆菌产生的不被克拉维酸抑制的“丝氨酸”头孢菌素酶组成的一个酶家簇。
结果表明生物被膜两组ESBLs和Amp C酶的检出率均明显高于浮游组各酶的检出率。其中原因可能为BF的细菌无论在形态结构、生理生化特性及致病特点等都与浮游生长的细菌显著不同,开启了耐药基因,具有很强的耐药性[6]。由于BF的形成,促进了AmpC和ESBLs的产生,而这两种酶同时存在又增加了耐药性,但是亚胺培南的抗菌活性最高,无耐药菌株。从药敏结果来看,对其他抗生素的耐药性较高,可知,对于该菌感染一定要在药敏实验的指导下进行治疗。对照组和实验组的耐药性没有差异,壳聚糖没有影响生物被膜细菌的耐药性,可能是壳聚糖杀灭细菌的机理是进入细菌干扰其带负电荷的遗传物质DNA和RNA,抑制细菌的繁殖,是一种物理的静电吸引作用,不同于常规的化学药物[7]。
综上所述壳聚糖既对人体无毒无害、可抑制生物被摸的形成,又未增加细菌的耐药性,在医学有潜在价值。
[1]Ishida H,Ishia Y,urosaka Y,et al.In vitro and in vivo activities of levofloxacin against biofilm-producing pseudomonas aeruginosa[J].Antimicrob Agents Chemother,1998,42(7):1641.
[2]Sampath LA,Tambe SM,Modak SM.In vitro and in vivoefficacy of catheters impregnated with antiseptics or antibiotics:evaluation of the risk of bacterial resistance to the antimicrobials in the catheters[J].Infect Cont HospEpidemiol,2001,22(10):640.
[3]Nagamune H,Maeda T,Ohkura K,et al.Evaluation of the cytotoxic effects of Bisquaternary ammonium antimicro-bial reagents on human cells[J].Toxicol in Vitro,2000,14(2):139.
[4]Enríquez de Salamanca A,Diebold Y,Calonge M,et al.Chitosan nanoparticles as a potential drug delivery system for the ocular surface:toxicity,uptake mechanism and in vivo tolerance[J].Invest Ophthalmol Vis Sci,2006 ,47(4):1416.
[5]Cao Z,Sun Y.N-halamine-based chitosan:preparation,characterization,and antimicrobial function[J].J Biomed Mater Res A,2008,85(1):99.
[6]Donlan RM,Costorton JW.Biofilms:survival mechanisms of clinically relevant microorganisms[J].Clin Microbiol Rev,2002,15(2):167.
[7]Issam S T,Adele M G,Adele CP,et al.Chitosan polymer as bioact-ive coating and film against Aspergillus niger contamination[J].Journal of Food Science,2005,70(2):100.
