NKT细胞通过IL-10参与诱导小鼠心脏移植免疫耐受
2012-11-05王远涛王伟刚周洪澜高宝山
王远涛,王伟刚,王 钢,周洪澜,高宝山,安 伟
(吉林大学白求恩第一医院 泌 尿系统疾病诊治中心,吉林 长 春130021)
NKT(Nature killer T cells)细胞是一种具有NK细胞特点的T细胞。它是一种独特的细胞亚群,兼有NK细胞和T细胞两种性质[1-3]。NKT细胞活化后能迅速分泌大量的IFN-γ和IL-4[4]。因此,NKT细胞在机体免疫自稳、抗感染和抗肿瘤以及移植免疫等诸多方面发挥重要作用。但其在诱导免疫耐受过程中的具体作用,仍不十分清楚。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取BALB/c小鼠作为供者,C57BL/6小鼠作为受者,约6-8周龄,体重15-20 g,所有试验小鼠均为雌性且购于吉林大学第一医院动物实验中心。
1.1.2 手术器械及试剂 单人双目手术显微镜一台购于深圳瑞沃德公司;显微外科手术器械若干,购自德国ROBOZ公司;鼠NKT isolation kit购自BD公司;IL-10、IFN-γELISA 检测试剂盒购自 BD 公司;10-0血管缝合线购自美国Ethicon;6-0医用丝线购自上海医用缝合厂;4%水合氯醛由吉林大学基础医学院提供;CD40L抗体购自ABCAM。MLR缓冲液及MACS缓冲液由吉林大学第一医院泌尿系统疾病诊治中心研究室配置。
1.2 方法
1.2.1 供体手术 供体采用4%水合氯醛(10μl/g)腹腔注射麻醉。经下腔静脉静推注1%的肝素盐水0.3 m L,使供体小鼠全身肝素化。沿胸骨中线剪开胸骨颈部,充分暴露心脏并迅速喷洒冰盐水降温。迅速结扎下腔静脉。充分游离肺动脉及主动脉并剪断,其余血管及组织于近心脏侧集束结扎并切断。取下供心,置于4℃生理盐水中保存备用。
1.2.2 受体手术 小鼠麻醉满意后,固定于鼠板上。腹部经正中切口单层进腹,游离下腔静脉及腹主动脉周围结缔组织,血管夹同时阻断下腔静脉及腹主动脉,供心主动脉和受体腹主动脉行端侧吻合,供心肺动脉和下腔静脉行端侧吻合,单层连续缝合关闭腹腔。灯下保温至小鼠苏醒。术后通过腹部移植心触诊,观察移植心存活情况,以指尖不能触及移植心明显跳动作为排斥标准。
1.2.3 免疫耐受诱导及实验分组 选取BALB/c小鼠作为供者,C57BL/6小鼠作为受者。排斥组:单纯行心脏移植,无其他处理;耐受组:受鼠于术前7天接受C57BL/6来源脾细胞(1×107个/只)尾静脉注射,并分别于术前7天、5天、3天,接受抗CD40L抗体腹腔注射(250μg/只/次)。
1.2.4 NKT细胞的制备 NKT细胞分选采用MACS免疫磁珠分选法。简述如下:供体脾细胞制备成脾细胞悬液,重悬于MACS缓冲液中,加入一抗后孵育10分钟,洗涤后加入二抗孵育15分钟,洗涤后过MACS阳性分选磁柱。具体操作过程根据试剂盒说明书。
1.2.5 混合淋巴细胞实验 30 Gy照射的BALB/c小鼠全脾细胞作为刺激细胞,C57BL/6小鼠全脾细胞作为反应细胞,4×105个细胞/空加入96孔板,刺激细胞与反应细胞的比例为1∶1。选取排斥组移植后第10天的受鼠脾细胞及耐受组移植后50天的受鼠脾细胞,MACS分别分选出NKT细胞作为抑制细胞,2×105个细胞/空加入到反应体系,共同孵育3天,每孔加入3H-Td R 0.5μCi后继续培养16 h,多头细胞收集器收集细胞后用全自动液体闪烁器计数。用特异增殖孔和对照孔的平均cpm值,以增殖指数表示各组反应细胞的增殖情况(特异增殖孔的cpm均值/对照孔的cpm均值)。
1.2.6 细胞因子检测 NKT细胞作为反应细胞,制备如上所述,2×104/孔加入96孔板;100 ng/m L的a-GalCer刺激BALB/c全脾细胞4小时后,30 Gy放射线照射,处理后的细胞作为刺激细胞,4×104/孔与反应细胞共培养3天,ELISA检测上清中IL-10、IFN-γ含量。具体操作过程见说明书。
1.2.7 统计学分析 采用GraphPad 5.0软件统计,用t检验比较组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 移植心存活状况
排斥组小鼠移植心平均存活时间(MST)为8天;与对排斥组比较,采用供体脾细胞尾静脉注射结合CD40L封闭诱导免疫耐受组,既耐受组移植心存活时间显著延长(P<0.05)。见图1。
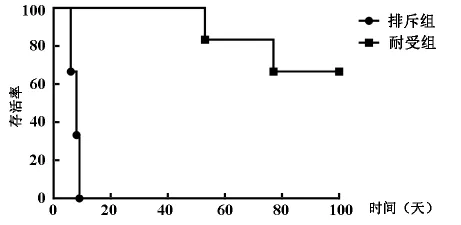
图1 小鼠心脏移植物存活时间比较
2.2 混合淋巴细胞反应结果
如前述,BALB/c小鼠全脾细胞作为刺激细胞,C57BL/6小鼠全脾细胞作为反应细胞,并选取排斥组移植后第10天的受鼠脾细胞及耐受组移植后50天的受鼠NKT细胞作为抑制细胞,观察NKT细胞的抑制功能。
对照组:只有刺激细胞及反应细胞;排斥组NKT:除有刺激细胞和反应细胞外,还加入排斥组术后第10天的NKT细胞;耐受组NKT:除有刺激细胞和反应细胞外还加入耐受组术后50天的NKT细胞。结果显示:没有加入任何NKT细胞的对照组,淋巴细胞增殖反应明显;加入排斥组NKT细胞的淋巴细胞增殖反应略有降低,但与对照组比较没有显著差异;而加入耐受组NKT细胞的淋巴细胞增殖反应明显受抑制,与对照组及排斥组比较差别具有显著性(P<0.000 1)。见图2。
2.3 不同组NKT细胞的细胞因子分泌情况
排斥组取术后第10天的NKT细胞,耐受组取术后50天的NKT细胞检测其IL-10、IFN-γ的分泌情况。结果显示:与排斥组比较,耐受组NKT细胞分泌了大量的IL-10,P<0.001;同时与排斥组比较,耐受NKT细胞组分泌的IFN-γ明显减少,P<0.000 1。见图3。
3 讨论

图2 不同组NKT细胞抑制淋巴细胞增殖反应情况
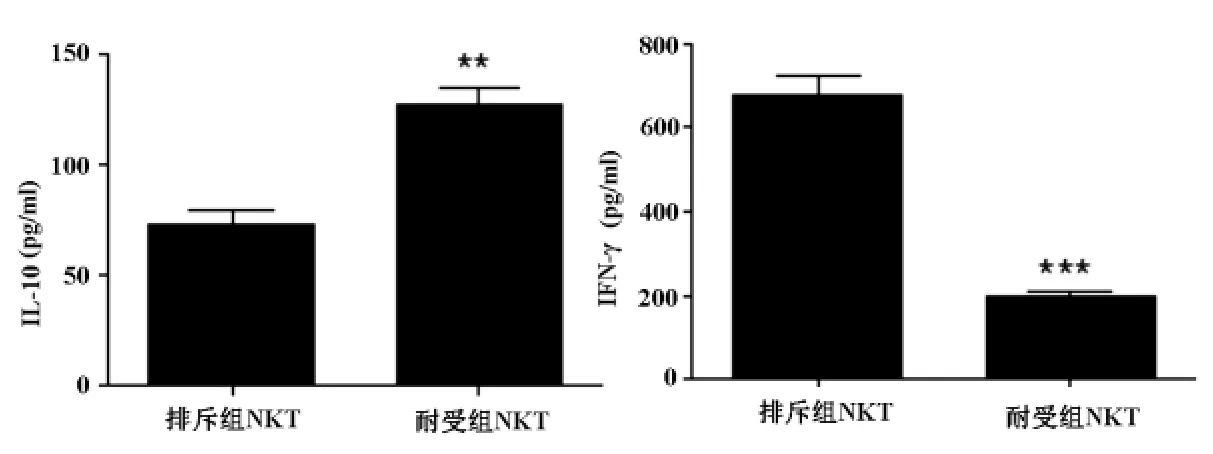
图3 不同组NKT细胞IL-10、IFN-γ的分泌情况
同种异体移植排斥反应是引起移植物失功的主要原因,也是移植免疫领域所要解决的主要问题。已有研究表明:NKT细胞对免疫耐受的诱导具有调节功能。Yang等[5]通过阻断CD40/CD40L共刺激途径诱导野生型受体小鼠胰岛移植物长期存活,而NKT细胞缺陷者的平均生存时间明显缩短,过继性输注活化的NKT细胞后又可产生免疫耐受。另有研究表明[6],在口服抗原诱导免疫耐受过程中,耐受组NKT细胞及CD4+CD25+CTLA-4+T细胞数量增加,免疫调节功能增强,考虑NKT细胞抑制了效应性T细胞,同时又有助于调节性T细胞的产生,进而延长了心脏移植物的存活时间。本研究中,应用供体抗原特异性输注结合CD40L共刺激因子封闭,成功诱导了全错配小鼠心脏移植物的免疫耐受,而在NKT细胞抑制淋巴细胞增殖反应的试验中,可以明显的看出,耐受组NKT细胞具有很强的抑制淋巴细胞增殖的能力,这也在一定程度上说明了NKT细胞的抑制作用可能与细胞-细胞接触性抑制有关。
NKT细胞所分泌的细胞因子在诱导免疫耐受中的作用尚不十分明确。有研究表明,NKT细胞在阻断共刺激诱导小鼠同种异体心脏移植免疫耐受中扮演了关键的角色,其功能主要与IFN-γ有关[7]。另有研究表明[8-10]:NKT细胞的免疫调节功能主要与IL-10、IL-4的分泌有关。也有其他领域的研究显示NKT细胞对效应性T细胞的调节作用不需要IL-4、IL-10等细胞因子的参与。在本项研究中可以明显看出,排斥组NKT细胞主要分泌了大量的IFN-γ,而耐受组NKT细胞分泌的IL-10明显增加,提示NKT细胞可能主要通过IFN-γ诱导移植物排斥,而主要通过IL-10诱导免疫耐受。
NKT细胞在免疫调节中的作用已成了国内外移植免疫学者关心的前沿领域,并且展现出了诱人的前景,本研究也为NKT细胞在诱导移植免疫耐受中的作用提供了新的证据和思路。
[1]Nicol A,Nieda M,Koezuka Y,et al.Human invariant V al-pha24+ natural killer T cells activated by alpha-galactosylce-ramide(KRN7000)have cytoxic anti-tumour activity through mechanisms distinct from T cells and natural killer cells[J].Immunology,2000,99(2):229.
[2]Kawano T,Cui JQ,Koezuka Y,et al.Analysis of human Vα24+CD4+ NKT cells activated byα-galactosylceramide pulsed monocytederived dendritic cells[J].J Immunol,2000,164:4458.
[3]Nieda M,Nicol A,Koezuka Y,et al.Activation recognition of human Vα24NKT cells byα-glycosylceramide in a CD1d restricted and Vα24 TCR-mediated manner [J].Hum Immunol,1999,60(1):10.
[4]Godfrey DI,Hammond KJ,Poulton LK,et al.NKT cells:facts,functions and fallacies[J].Immunol Today,2000,21(11):573.
[5]Yang SH,Jin JZ,Lee SH,et al.Role of NKT cells in allogeneic islet graft survival[J].Clin Immunol,2007,124:258.
[6]Li W,Carper K,Perkins JD.Enhancement of N KT cells and increase in regulatory T cell s results in improved allograft survival[J].J Surg Res,2006,134:10.
[7]Seino K,Fukao K,Muramoto K,et al.Requirement for natural killer T(NKT)cells in the induction of allograft tolerance[J].PNAS,2001,98:2577.
[8]Oh K,Kim S,Park SH,et al.Direct regulatory role of NKT cells in allogeneic graft survival is dependent on the quantitative strength of antigenicity[J].J Immunol,2005,74:2030.
[9]Jiang X,Kojo S,Harada M,et al.Mechanism of N KT cell-mediated transplant tolerance[J].Am J Transplant,2007,7:1482.
[10]Haeryfar SM,Lan Z,Leon-Ponte M,et al.Prolongation of cardiac allograft survival by rapamycin and the invariant natural killer T cell glycolipid agonist OCH.[J].Transplantation,2008,86:460.
