红细胞膜免疫磁珠检测成分血中抗A/抗B的研究
2012-11-05吴晓葵牟忠梅
李 岩,吴晓葵,牟忠梅,刘 颖,王 超,李 勇*
(1.长春市中心血站,吉林 长 春130031;2.吉林市中心医院;3.长春博德生物技术有限责任公司)
多年来,O型血一直被视为万能供血者,且被广泛使用。但近年来,越来越多的关于O型血(血浆、血小板)进行异型输血时,由于其血浆中含有高效价抗体(效价≥128)而引起溶血性输血反应的报道。因此,欧洲、美国的一些输血组织建议进行献血员的抗体效价筛查,并将具有高效价抗体的O型成分血做以标识,仅供给O型患者使用[1,2]。目前,临床测定抗体效价所采用的试剂均为新鲜红细胞,应用的方法为试管法、微柱凝胶法。笔者采用了红细胞膜免疫磁珠试剂进行抗体效价的检测,红细胞膜免疫磁珠是将新鲜红细胞内容物去除,填充入纳米磁性颗粒制备而成,其特点是不具有生命活性,但其ABO血型抗原性却与新鲜红细胞相同。膜免疫磁珠保存期长,且可将红细胞抗原标准化,在进行抗体检测时,可避免由于试剂红细胞厂家不同而造成检测结果的不一致。我们应用此试剂检测抗体效价并与现有方法进行比较。同时将待检样本稀释并检测,以确定应用红细胞膜免疫磁珠检测标本中是否含有高效价抗体的方法,现报告如下。
1 材料与方法
1.1 材料与试剂 ABO血型反定型试剂(人红细胞)、微柱凝胶卡购自长春博迅生物技术有限责任公司;红细胞膜免疫磁珠购自长春博德生物技术有限责任公司;程控磁化振荡器、血型血清学多用途离心机由长春博研科学仪器有限责任公司提供;待检标本来源于吉林省血液中心;其他试剂均为国产分析纯。
1.2 方法
1.2.1 效价、特异性测定 用试管法、微柱凝胶法及红细胞膜免疫磁珠法进行60份血清样本(30份A型,30份B型)的检测。在试管中,用生理盐水将同一份血浆标本倍比稀释,分别用三种方法检测,比较抗体效价。同时用阴性血清进行特异性检测。
结果判定:以产生1+凝集强度的反应最高稀释倍数倒数为其效价。特异性检测为阴性。判断标准如下[3]:
试管法1+,很多小的凝集块,液体背景有游离的红细胞。阴性:均一的红细胞悬液,无红细胞凝集。
微柱凝胶法1+,红细胞复合物位于凝胶中下部。阴性:红细胞沉于凝胶底部。
免疫磁珠法1+,很多小的凝集块,液体背景中存在细小均一的磁珠。阴性:均一的磁珠悬液。
1.2.2 用上述三种方法同时检测50份O型血浆抗体效价 将50份经新鲜细胞试管法检测效价≥128的血清标本(1份效价1024,13份效价512,12份效价256,24份效价128)分别10、15、20倍稀释,用膜免疫磁珠法检测其凝集强度并进行评分。判读标准及评分[3]:

凝集强度 描述 评分4+ 一个完整的凝集块12 3+ 数个大凝集块 10 2+ 很多小凝集块中散在一些大的凝集块 8 1+ 很多小的凝集块,液体背景中存在细小均一的磁珠5 W+ 很多更小的凝集块,与液体背景中细小均一的磁珠混在一起 3阴性 均一的磁珠悬液0
1.3 统计学分析 采用SPSS11.5统计学软件,对不同方法测定的效价进行相关分析。
2 结果
2.1 用试管法、微柱凝胶法及红细胞膜免疫磁珠法进行60份血清样本的检测(30份A型,30份B型)。在试管中,用生理盐水将同一份血浆标本倍比稀释,分别用三种方法检测,比较抗体效价。结果微柱凝胶法最敏感,其次为试管法,红细胞膜免疫磁珠法低于试管法1个滴度。同时用阴性血清进行特异性检测,三种方法特异性成立。结果见表1。
2.2 采用新鲜细胞试管法、微柱凝胶法及红细胞膜免疫磁珠法三种方法测定50份O型血浆样本抗体效价,统计结果见表2,表3。同时进行方法比较,将红细胞膜免疫磁珠法分别与试管法及微柱凝胶法进行比较,两方法间比较采用相关性分析。将每份标本均分为三份,同时用新鲜细胞试管法、微柱凝胶法及红细胞膜免疫磁珠法三种方法进行测定,红细胞膜免疫磁珠法结果计为Y变量,试管法、微柱凝胶法结果分别计为X变量,作线性回归,比较红细胞膜免疫磁珠法检测结果与另外两种方法检测结果的相关性。红细胞膜免疫磁珠法检测结果与试管法检测结果之间的线性回归方程为:Y=1.0154X-3.7471,回归系数b=1.0154,相关系数为0.9952,P<0.01,表明两种检测方法的检测结果间呈显著性相关。红细胞膜免疫磁珠法检测结果与微柱凝胶法检测结果之间的线性回归方程为:Y=0.9986X-1.1753,回归系数b=0.9986,相关系数为0.9961,P<0.01,表明两种检测方法的检测结果间呈显著性相关。

表1 三种方法测定60份血清样本(30份A型,30份B型)结果比较
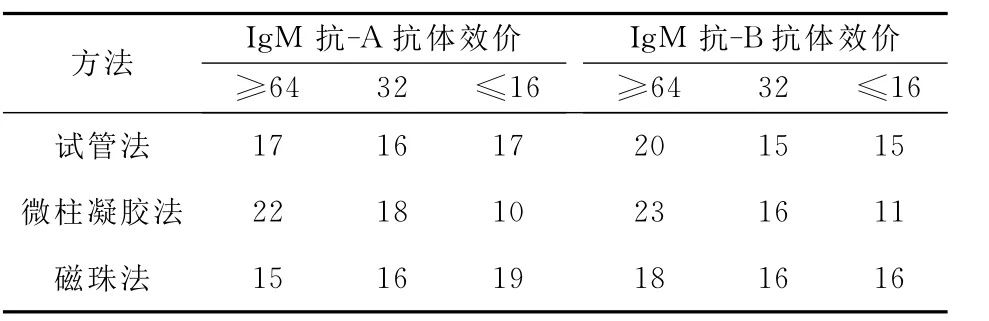
表2 三种方法测定50份O型血浆样本抗体效价结果统计
表3 三种方法测定50份O型血浆样本抗体效价评分()
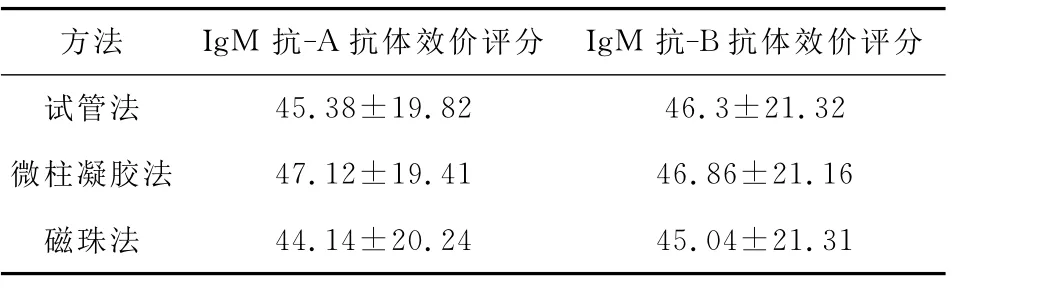
表3 三种方法测定50份O型血浆样本抗体效价评分()
45.38±19.82 46.3±21.32微柱凝胶法 47.12±19.41 46.86±21.16磁珠法抗体效价评分试管法方法 Ig M抗-A抗体效价评分 Ig M抗-B 44.14±20.24 45.04±21.31
2.3 将已采用新鲜细胞试管法检测效价≥128的50份待检样本(1份效价1024,13份效价512,12份效价256,24份效价128)10倍、15倍、20倍稀释后,用红细胞膜免疫磁珠检测,测定其凝集强度。结果见表4。

表4 红细胞膜免疫磁珠检测稀释后的血清标本的凝集强度
由上表分析,将高效价抗体进行不同倍数稀释后,与膜免疫磁珠反应强度不同。将样本15倍稀释后,反应强度均≥2+。进一步将另外50份未知抗体效价的血清样本直接进行15倍稀释,用红细胞膜免疫磁珠检测。其中有5份样本凝集强度>2+,用新鲜细胞试管法检测其效价均≥128;有2份标本凝集强度1+,用新鲜细胞试管法检测其效价分别为32、64。
3 讨论
尽管早在1992年英国血液病标准化委员会输血专业组就输用新鲜冰冻血浆和血小板提出了指导标准,明确指出输用新鲜冰冻血浆和血小板时要ABO同型输注[4]。但是在紧急条件下,给患者配O型成分血为最佳选择。O型成分血中含有高效价抗体时易产生溶血性输血反应,这种情况尽管少,但仍然存在[1,5]。并且由于药物原因也会使献血员体内产生ABO血型系统抗体[6]。故2005年英国输血指南中指出为保证输血安全要求对于全血和红细胞、新鲜冰冻血浆、单采血小板、来自于含有高效价O型献血员血浆的血小板以及新生儿使用的血或其他血液制品都要进行抗体效价的检测,效价大于128时标记为高效价[7]。Laura L.Cooling,Thalhimer W等人在使用新鲜红细胞微柱凝胶法进行抗体效价研究时发现,在使用不同厂家,不同批号的红细胞试剂检测同一样本效价时,出现的反应终点不同[5,8]。而由于红细胞膜免疫磁珠可将ABO血型抗原标准化,作为标准化红细胞应用与抗体效价检测能够解决这一问题。
通过三种方法的比较发现,应用红细胞膜免疫磁珠试剂检测抗体效价时要低于新鲜细胞试管法,所以应用红细胞膜免疫磁珠试剂检测抗体效价≥64时,即可标记为高效价抗体,只能用于同型输血。同时,为方便临床使用,笔者将效价≥128的多份血清标本进行10倍、15倍、20倍稀释,应用红细胞膜免疫磁珠检测。从实验结果得出,使用红细胞膜免疫磁珠试剂检测标本效价时,可将其进行15倍稀释,若检测凝集强度≥2+时,即可视为带有高效价抗体。
红细胞膜免疫磁珠在保存期方面要远远优于新鲜红细胞。据文献报道[9],应用传统的红细胞保护液CPD-A液及ACD液保存新鲜红细胞,4℃保存其保存期分别为35天、21天;而现市售的新鲜红细胞试剂最多能保存3个月,在其使用过程中,易受环境条件的影响,室温有菌环境下应用新鲜红细胞,红细胞易染菌,在30天后有溶血出现。而红细胞膜免疫磁珠为冻干试剂,尽管试剂厂家确定其有效期为1年,但我们对其稳定性跟踪检测时发现,室温保存4年的膜免疫磁珠其ABO抗原性与效期内的磁珠无明显差别。另外,在使用过程中,膜免疫磁珠受环境条件影响小,重复性好,可以使检测结果标准化。故笔者认为其应用于成分血中高效价抗体的检测,结果可靠,试剂均一性好,优于新鲜红细胞,值得推广应用。
[1]Mac Lennan S.High titre anti-A/B testing of donors within the National Blood Service(NBS)[monograph on the Internet].Information document INF/MED/MA/004/01.London: NBS;2002?;Available from:http://www.blood.co.uk/hospitals/library/pdf/hightit.pdf
[2]Josephson CD,Mullis NC,Van Demark C,et al.Significant numbers of apheresis-derived group O platelet units have a“high-titer”anti-A/A,B:implications for transfusion policy[J].Transfusion,2004,44(6):805.
[3]童 军,刘庆海,杨文冲.血型血清学实验方法//李勇,马学严.实用血液免疫学血型理论和实验技术[M].北京:科学技术出版社,2006:589-591.
[4]British Committee for Standards in Haematology,Working Party of the Blood Transfusion Task Force.Guidelines for the use of fresh frozen plasma/for platelets[J].Transfusion Med,1992,2(1):57-63/311.
[5]Cooling L,Downs T,Butch S,Davenport R.Anti-A and anti-B titers in pooled group O platelets are comparable to aphaeresis platelets[J].Transfusion,2008,48(10):2106.
[6]Jennifer Daniel-Johnson,Susan Leitman,et al.Probitic-associated high-titer anti-B in a group A platelet donor as a cause of severe hemolytic transfusion reaction[J].Transfusion,2009,49(9):1845.
[7]Donation testing (red cell immunohaematology).Guidelines for the Blood Transfusion Services in the UK [M].2005;180-1 A-vailable from:www.tsoshop.co.uk
[8]Thalhimer W,Taylor ES.The low agglutinin titer of both small and large pools of plasma[J].JAMA,1945,128:277.
[9]Technical Manual[M].American Association of Blood Banks 13TH Edition 166.
