色满卡林对培养乳鼠心肌细胞H/R损伤的保护作用研究
2012-11-05祝春梅王国贤
祝春梅,王国贤,张 涛
(1.辽宁医学院附属第一医院,2.辽宁医学院药理学教研室,辽宁 锦 州121000)
色满卡林(CRK)是传统的钾通道开放剂,具有舒张血管、降低血压、保护心脏的作用,用于高血压和心肌缺血的治疗,但其作用机制尚未完全阐明[1-3]。本研究在建立原代培养大鼠乳鼠心肌细胞H/R损伤模型的基础上,观察CRK对受损心肌细胞的保护作用,并对其作用机制进行探讨。
1 材料与方法
1.1 材料 实验动物:选用出生2-3 d的SD大鼠乳鼠,雌雄不拘,由辽宁医学院实验动物中心提供,动物合格证号:SCXK(辽)2003-0008。主要设备:CO2孵育箱、全自动生化分析仪、倒置显微镜、79-1磁力加热搅拌器、JY2型超声细胞粉碎仪、721紫外分光光度计、流式细胞仪。主要试剂:CRK(Sigma)、DMEM 培养基(Gibco)、新生牛血清(北京华美生物工程公司)、LDH检测试剂盒(南京建成生物工程研究所)、Annexin V-FITC凋亡检测试剂盒(北京宝赛生物技术有限公司)、Caspase-3抗体(Cell Signaling公司),其余试剂均为国产分析纯。
1.2 心肌细胞分离培养 取出生2-3 d的SD大鼠乳鼠,无菌条件下,开胸剪取心脏,剪成1 mm3的小块后用0.08%胰蛋白酶消化液消化10 min,重复以上过程4-6次,1 000 r/min离心10 min后弃上清,加入含15%小牛血清的DMEM培养基混悬沉淀的细胞,置入CO2孵箱,37℃条件下培养2 h,以差速贴壁分离法纯化心肌细胞。调整细胞浓度至1×106个/ml,接种到培养瓶内,常规培养,第三天加药。
1.3 心肌细胞H/R损伤模型的制备 缺氧:将细胞置入37℃、95%N2+5%CO2饱和的细胞培养箱培养2 h;复氧:将细胞置入37℃、5%CO2饱和的细胞培养箱中继续培养30 min。
1.4 实验分组 将常规培养3 d的心肌细胞分为5组:①正常对照组:细胞正常培养,不施加任何处理因素;②H/R组:缺氧2 h,复氧30 min;③用药组:三组中分别加入终浓度为2.5、5、10μmol/L的CRK,即刻缺氧2 h,复氧30 min。
1.5 细胞培养液中LDH活性测定 收集各组细胞培养液,用LDH试剂盒并按其说明书进行操作,各种液体加好后,用721紫外分光光度计测各组液体的吸光光度值(检测波长440 nm),用公式计算出LDH的释放量,检测LDH的活性。
1.6 流式细胞仪检测心肌细胞凋亡率 各组细胞先用0.125%胰蛋白酶消化细胞,调整细胞浓度至1×106个/ml,离心并弃上清;加入预冷的PBS震荡重悬,离心去上清。加入含10μl Annexin V-FITC和5μl PI的Binding Buffer 200μl,混匀后室温避光反应15 min,再加入Binding Buffer 300μl上机检测。
1.7 Western blot分析caspase-3蛋白表达水平
心肌细胞给予各组药物处理培养后,用细胞刮刀刮下细胞,用PBS洗两遍,离心,弃上清,将心肌细胞放置于-70℃冰箱中备用,测定指标时取出样品,每份样品取样50μg,变性的SDS-聚丙烯酰胺凝胶恒压电泳,电压积压80 V,分离胶120 V,半干法将蛋白转移至硝酸纤维素膜,恒压电泳95 V,室温1 h,4℃封闭过夜,按0.1 ml·cm-2膜面积加入1∶2 000稀释的一抗 (兔抗 Caspase-3,购自 Cell Signaling公司)杂交2 h,封闭液漂洗后按0.1 ml·cm-2膜面积加入1∶2 000稀释的二抗 (鼠抗兔IgG抗体,购自北京中山金桥生物有限公司),室温下摇床杂交1 h,漂洗后加显色剂 (NBT,购自沈阳基因公司)5 min,放射显影。
1.8 统计学分析 数据采用SPSS 13.0软件完成统计处理分析。所有计量资料结果采用表示,组间比较采用单因素方差分析和LSD-t检验。以P≤0.05为差异具有显著性,P≤0.01为差异具有非常显著性。
2 结果
2.1 各组细胞培养液中LDH活性测定 见表1。
表1 细胞培养液中LDH活性测定()

表1 细胞培养液中LDH活性测定()
注:与正常对照组比较,*P<0.01;与损伤组比较,△P<0.01
组别 LDH(U/L)80.7±9.8 H/R组 176.9±15.5*CRK低剂量组 144.7±7.0△CRK中剂量组 109.8±16.4△CRK高剂量组 90.3±5.4正常对照组△
H/R组培养液中LDH活性较正常对照组明显升高。CRK各浓度组培养液中LDH活性较H/R组低,CRK低、中、高剂量组LDH细胞漏出较H/R组分别降低33.47%、69.75%和90.02%,以高剂量组最为明显。
2.2 各组心肌细胞凋亡率 见表2,图1。
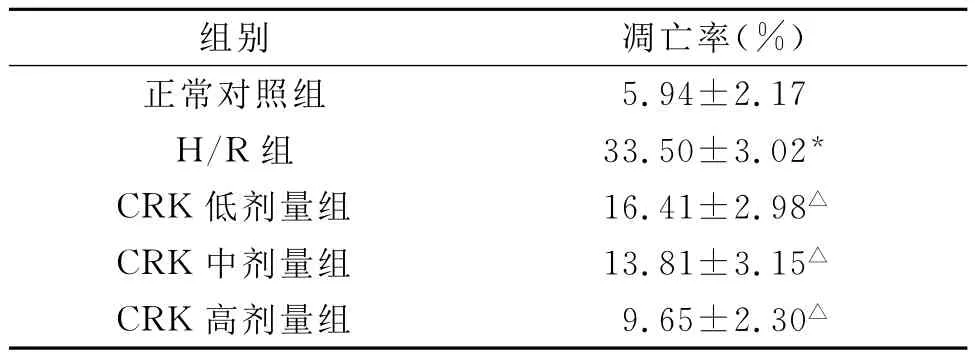
注:与正常对照组比较,*P<0.01;与损伤组比较,△P<0.01
2.3 各组心肌细胞caspase-3活性蛋白表达水平见表3,图2。
表3 各组心肌细胞caspase-3活性蛋白表达水平的比较()
表3 各组心肌细胞caspase-3活性蛋白表达水平的比较()
注:与正常对照组比较,*P<0.01;与损伤组比较,△P<0.01
0.71±0.07 H/R组 1.61±0.08*CRK低剂量组 1.23±0.06△CRK中剂量组 0.97±0.08△CRK高剂量组 0.77±0.05组别 蛋白灰度比值正常对照组△
经 Western blot分析显示,正常对照组培养乳鼠心肌细胞Caspase-3 17 k D亚单位的表达量很小,灰度值为0.71±0.07;经 H/R处理的组别出现17 k D带谱,表达量明显高于正常对照组(P<0.01);而CRK组的Caspase-3 17 k D亚单位表达量低于H/R组(P<0.01)。
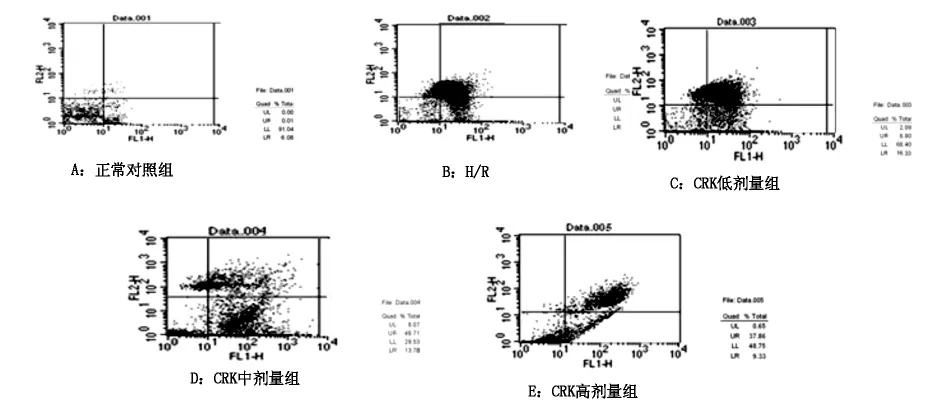
图1 各组心肌细胞凋亡率比较

图2 各组心肌细胞caspase-3活性蛋白表达水平的比较
3 讨论
心肌缺血再灌注损伤主要是由于心肌细胞缺血缺氧,活性氧生成增多,破坏了机体氧化-还原动态平衡。而心肌细胞凋亡是持续性心肌缺血中早期心肌细胞死亡的主要形式,再灌注促进了细胞的不可逆损伤[4]。
细胞凋亡早期改变主要表现为磷脂酰丝氨酸(PS)从细胞膜内转移到细胞膜外,通过PS特异的Annexin V,联合细胞活性鉴定染料PI双染,对细胞生存状态进行定性和定量分析;同时心肌细胞培养液中LDH的活性是观察H/R损伤的重要指标,反映损伤对细胞膜通透性的影响[5]。将两项指标结合起来,对细胞膜完整性及稳定性进行研究。本研究利用95%N2+5%CO2条件使心肌细胞缺氧培养2 h,再复氧,结果显示培养基中LDH漏出明显,细胞凋亡率及凋亡蛋白表达增加,证实H/R模型制备成功。而经CRK预处理的心肌细胞,则可不同程度地降低以上损害。说明CRK可以维持心肌细胞膜的完整性及稳定性,从而减轻心肌细胞损伤。
CRK是传统的ATP敏感性钾通道开放剂,临床用于高血压和心肌缺血的治疗[6]。已有研究显示,线粒体ATP敏感性钾通道(Mito-KATP)开放后可以显著降低氧应激诱发的心肌细胞凋亡的发生率[7]。可能为缺血再灌注早期大量氧自由基产生,开放 Mito-KATP,稳定线粒体跨膜电位(Δψm),减少线粒体内膜的通透性转换孔(MPTP)开放及细胞凋亡的蛋白质释放,从而减少心肌细胞的凋亡[8-10]。这与本研究得出的结论一致。标志性凋亡蛋白酶caspase-3在细胞即将发生凋亡时会由无活性酶原状态裂解成由17k D和12 k D两个亚单位组成的异源二聚体,通过级联反应最终引起细胞凋亡[11]。本研究结果显示:体外原代培养的乳鼠心肌细胞经H/R处理后,caspase-3蛋白活性表达上调,而CRK预处理的心肌细胞,可逆转如上变化,提示CRK对心肌细胞具有保护作用,可以减少caspase-3酶原活化,对心肌细胞凋亡具有抑制作用。综上,CRK对缺氧复氧致培养大鼠乳鼠心肌细胞的损伤具有保护作用,其机制可能与CRK维持细胞膜完整性与稳定性,下调caspase-3活性蛋白表达水平,降低心肌细胞凋亡有关。
[1]贾三庆,胡大一,常英姿等.ATP敏感性钾通道开放剂Cromakalim 心 脏保护机制的初步探讨[J].中国医科导刊,2000,2(5):40.
[2]Liu Y,Ren G,O,Rourke B,et al.Pharmacological comparison of native mitoc-hondrial K(ATP)channels with molecularly defined surface K(ATP)channels[J].Mol Pharmacol,2001,59(2):225.
[3]杨 慧,张珍祥,徐永健.克罗卡林对缺氧性肺动脉高压的影响及其机制探讨[J].中华结核和呼吸杂志,2003,2(1):60.
[4]Hoffman JW Jr,Gilbert TB,Poston RS,et al.Myocardial reperfusion injury:etiology,mechanisms,and therapies[J].J Extra Corpor Technol,2004,36(4):391.
[5]王晓明,张卫卫,龚卫琴等.氯离子通道阻滞剂DIDS和NPPB对缺血再灌注诱导心肌细胞凋亡保护作用的研究[J].中华老年心脑血管病杂志,2008,10(10):765.
[6]Cecchetti V,Tabarrini O,Sabatini S.From cromakalim to different structural classes of K(ATP)channel openers[J].Curr Top Med Chem,2006,6(10):1049.
[7]Andreadou I,Iliodromitis EK,Farmakis D,et al.To prevent,protect and save the ischemic heart:antioxidants revisited[J].Expert Opin Ther Targets,2009,13(8):945.
[8]Kowalczyk JE,Zablocka B.Protein kinases in mitochondria[J].Postepy Biochem,2008,54(2):209.
[9]Light PE,Kanji HD,Fox JE,et al.Distinct myoprotective roles of cardiac sarcolemmal and mitochondrial KATP channels during metabolic inhibition and recovery[J].FASEB J,2001,15(14):2586.
[10]Grover GJ.Pharmacology of ATP-sensitive potassium channel(KATP)openers in models of myocardial ischemia and reperfusion[J].Can J Physiol Pharmacol,1997,75(4):309.
[11]Faubel S,Edelstein CL.Caspases as drug targets in ischemic organ injury[J].Curr Drug Targets Immune Endocr Metabol Disord,2005,5(3):269.
