牙体修复性纳米羟基磷灰石复合材料生物相容性评价
2012-11-05王青山赵蒙蒙
李 瑞,王青山,赵蒙蒙,王 云
(山东:1.滨州医学院附属医院口腔内科,滨州 256603;2.市人民医院,聊城 252000)
牙体修复材料不仅与牙齿长期直接接触,而且还与口腔软组织和唾液相接触,因此,必须具有良好的生物相容性和生物学活性。纳米羟基磷灰石作为一种新型的生物材料,以其优异的性能已在牙科和骨科领域广泛应用,并展现出诱人的前景[1-3]。本研究在成功研制出牙体修复性纳米羟基磷灰石复合材料的基础上,旨在进一步通过动物在体实验初步评价该材料的生物相容性,为临床应用提供实验室依据。
1 材料和方法
1.1 实验材料及其浸提液的制备
参照文献[4-5]将纳米羟基磷灰石与树脂基体按质量分数55∶45的比例混合,制成牙体修复性纳米羟基磷灰石复合材料[4-5],并在模具中制备成直径(15.0 ±0.1)mm,高(3.0 ±0.1)mm 的圆柱形试件,光照固化,备用。
取20个试件,用无水乙醇超声清洗20 min,干燥后在121℃、33 MPa压力下灭菌处理,然后分别放入2个无菌广口瓶中(每瓶10个),按照材料表面积与浸提介质之比为1 cm2/mL的比例,在每瓶中加入生理盐水49.50 mL,置于37℃培养箱中浸提72 h,浸提液过滤、分装,37℃恒温箱内保存备用[6]。
1.2 方法
1.2.1 急性毒性试验
取体质量350 g左右,2月龄健康SD大鼠10只(山东中医药大学实验动物中心),随机分为实验组和对照组,每组5只。分别记录每只大鼠的初始体质量后,实验组大鼠经尾静脉注入纳米羟基磷灰石复合材料浸提液1 mL,对照组注射等量生理盐水。分别于注射后24、48、72 h称量每只大鼠体质量,观察注射后呼吸、活动、反应、有无中毒、死亡等情况,记录结果[7-8]。
1.2.2 过敏性试验
取健康SD大鼠20只,随机分为实验组和对照组,实验组腹腔注射复合材料浸提液0.2 mL,隔日注射1次,连续3次,其中5只于首次注射后14 d再次腹腔注射2 mL浸提液,另外5只于首次注射后21 d再次注射2 mL浸提液。对照组分别在相同时间点注射等量生理盐水。每次注射后均观察15 min,特别是末次注射后仔细观察有无用爪搔鼻、喷嚏、竖毛、抽搐、呼吸困难、大小便失禁、休克、死亡等反应[7-8]。
1.2.3 热原试验
健康SD大鼠6只,雌雄不限,先相同环境,同一饲料饲养7 d,观察SD大鼠体质量无减轻,精神、食欲、排泄等无异常后,再进行基础体温测量。测量体温时将肛温计插入肛门深度约5 cm,保持2 min。每天早晚各测量1次,连续3 d,所有大鼠的体温均在37.6~38.0℃的范围内,且最高与最低体温的差值不超过0.4℃,符合热原试验要求。然后,每只大鼠均由尾静脉注射纳米羟基磷灰石复合材料浸提液1 mL,再按上述方法测量注射后体温,每隔30 min测量1次,连续6次。6次体温中最高的1次减去正常体温即为实验大鼠体温升高值。所有测试均在22℃环境下进行[7-8]。
1.2.4 黏膜刺激试验
取纳米羟基磷灰石复合材料在模具内制备成直径5 mm、厚1 mm的圆片,光照固化后,高温高压灭菌备用。取健康SD大鼠10只,口腔内外进行清洁消毒后,随机分为实验组和对照组(每组5只)。分别将实验材料圆片和高压灭菌后的同样规格的牙胶圆片(对照材料)置于口腔两侧颊黏膜表面,用医用缝合线穿颊与皮肤缝合,使试片固定在颊黏膜上,并确保密合无压迫。术后14 d观察与试片接触的黏膜表面有无充血、糜烂、溃疡、水肿等反应[7-8]。并按口腔黏膜刺激临床分级标准进行评分(表1)。

表1 口腔黏膜刺激临床分级标准
1.2.5 皮肤刺激试验
取健康SD大鼠10只,背部3 cm×3 cm范围(以脊柱为中线)皮肤脱毛,在椎旁两侧1.0 cm处各选3个注射点,间距1 cm,左侧皮内注射纳米羟基磷灰石复合材料浸提液,右侧皮内注射生理盐水,每点注射1 mL。分别于注射后 6、24、48、72 h,观察皮肤反应情况[7-8]。皮肤刺激反应记分标准见表2。刺激反应总评定:0分为无刺激,<1.9分为轻度刺激,2.0 ~4.9 分为中度刺激,5.0 ~8.0 分为强刺激。

表2 皮肤刺激反应记分标准
1.3 统计学分析
采用SPSS 13.0软件进行统计分析,组间比较用t检验,检验水准α=0.05。
2 结果
2.1 急性全身性毒性试验
2.1.1 一般情况
试验材料浸提液注射后24、48、72 h各时间点,实验动物无一死亡,活动食欲正常,呼吸平稳,无惊厥、瘫痪、呼吸抑制、腹泻、运动减少、体质量下降等现象。实验组和对照组比较无差异。
2.1.2 体质量变化
在72 h观察期内,实验组和对照组所有大鼠体质量都有不同程度地增加,而且两组体质量相比,差异无统计学意义(P>0.05)(表3)。
表3 实验组与对照组体质量变化比较(g,)
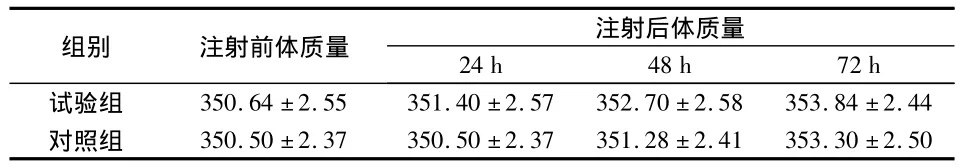
表3 实验组与对照组体质量变化比较(g,)
注射后体质量24 h 48 h 72 h试验组 350.64 ±2.55 351.40 ±2.57 352.70 ±2.58 353.84组别 注射前体质量±2.44对照组 350.50 ±2.37 350.50 ±2.37 351.28 ±2.41 353.30±2.50
2.2 过敏试验
末次注射后所有实验动物一般情况良好,均未出现竖毛、抽搐、喷嚏、呼吸困难、用爪搔鼻、休克、大小便失禁、死亡等反应。表明纳米羟基磷灰石复合材料浸提液和生理盐水在过敏试验中均为阴性反应。
2.3 热原试验
按ISO医疗器械评价标准[9],如果注射后体温升高达0.4℃或每3只大鼠的体温升高总和大于1.4℃为阳性,表示材料浸提液有致热作用。本研究6只大鼠中均无注射后体温升高达0.4℃,而且每3只大鼠的体温升高总和均小于1.4℃(表4),说明该材料的浸提液无致热作用。

表4 纳米羟基磷灰石复合材料浸提液注射前后体温变化(℃)
2.4 黏膜刺激试验
所有受试动物均未出现全身不良反应,实验材料试样均无松动,无脱落,与试样相接触的颊黏膜未见粗糙、红肿、糜烂或溃疡等反应。所有动物反应评分均为0。
2.5 皮肤刺激试验
皮内注射后6、24、48、72 h材料浸提液组和生理盐水组各注射点均无红肿、渗液、溃烂等情况出现,未见明显皮肤刺激症状,表明材料浸提液与生理盐水相似,无刺激性(表5)。

表5 皮肤原发刺激试验结果、原发刺激指数(PⅡ)及评分情况 (n=6)
3 讨论
寻找理想的牙体修复材料是牙科领域研究的重点内容之一,尽管目前使用的修复材料的机械和生物学性能均有显著提高,但与牙体硬组织性能相近且具有生物活性的牙体缺损修复材料仍然未能应用于临床。羟基磷灰石不仅可以中和口腔中的酸性物质,而且其较高的溶解反应还能够最大限度的提高唾液中钙、磷离子的浓度,推动羟基磷灰石的沉淀—溶解平衡向形成羟基磷灰石结晶的方向移动。有研究报道:羟基磷灰石具有抑制口腔内细菌生长繁殖、预防龋病、促进早期龋再矿化等功能,可用于颅骨缺损修复,引导牙周组织再生等[10]。Skrtic等将羟基磷灰石前驱体作为填料加入复合树脂中,发现其能在仿口腔环境的缓冲液中转换为羟基磷灰石,并稳定释放钙、磷离子,促进牙齿再矿化[11]。虽然人工合成的羟基磷灰石生物替代材料具有与天然羟基磷灰石一样的生物相容性,但是由于羟基磷灰石自身的脆性大、强度低、韧性、力学性能较差等限制了其作为牙体修复材料的应用[12]。
近年来的一系列研究已初步证明,纳米羟基磷灰石不仅具有天然羟基磷灰石的特点和结构,在力学性能上也与牙齿硬组织具有高度相似性,既保持了羟基磷灰石材料的生物相容性和生物活性的优点,而且又克服了羟基磷灰石自身的缺陷,具有更强的生物活性和特异性[13-14]。将其与机械能优良的树脂一起制成复合材料,则能充分发挥两者的性能优势。
本研究通过将硅烷偶联剂KH-570进行表面处理后的纳米羟基磷灰石与配制好的光固化树脂基质共混,制备成牙体修复性纳米羟基磷灰石复合材料,在完成物理和化学性能、加工性能、外形等有效性设计,并经检测确定其机械性能达到了牙体修复材料基本性能要求的基础上[14],参照ISO医疗器械评价标准[9],通过急性毒性实验、热原实验、过敏实验、口腔黏膜刺激实验、皮肤刺激实验,以初步评价该材料的生物相容性。结果显示:全身急性毒性试验两组大鼠体质量增加无明显差异,未发现全身急性毒性,符合相关标准。复合材料浸提液组和生理盐水组在过敏试验和皮肤刺激试验中所引起的反应大致相同,均为阴性反应,表明无刺激性和致敏性。热源试验结果表明复合材料符合热源试验检查要求,无致热作用。黏膜刺激试验中与受试试样相接触的颊黏膜未见粗糙、红肿、糜烂、溃疡反应,原发刺激指数为0,证实该复合材料对口腔黏膜无刺激性。
[1]Sato M,Aslani A,Sambito MA,et al.Nanocrystalline hydroxyapatite/titania coatings on titanium improves osteoblast adhesion[J].J Biomed Mater Res A,2008,84(1):265 -272.
[2]富建明,苗波,贾刘合,等.纳米羟基磷灰石修复兔颌骨的组织学分析[J].中国组织工程研究与临床康复,2008,(3):171-174.
[3]Fukui N,Sato T,Kuboki Y,et al.Bone tissue reaction of nano-thydroxyapatite/collagen composite at the early stage of implantation[J].Biomed Mater Eng,2008,18(1):25 -33.
[4]王云,王青山.牙体修复性纳米羟基磷灰石复合材料的机械性能研究[J].现代口腔医学杂志,2011,25(2):115-117.
[5]Lee JH,Um CM,Lee IB.Rheological properties of resin composites according to variations in monomer and filler composition[J].Dent Mater,2006,22(6):515 -526.
[6]要秉文,张光磊,田秀淑,等.牙科全瓷修复用长石瓷的生物相容性评价[J].中国组织工程研究与临床康复,2008,12(14):2671-2674.
[7]Sun Y,Lacour SP,Brooks RA,et al.Assessment of the biocompatibility of photosensitive polyimide for implantable medical device use[J].J Biomed Mater Res A,2009,90(3):648 -655.
[8]Cai X,Tong H,Shen X,et al.Preparation and characterization of homogeneous chitosan-polylactic acid/hydroxyapatite nanocomposite for bone tissue engineering and evaluation of its mechanical properties[J].Acta Biomater,2009,5(7):2693 -2703.
[9]标准出版社第一编辑室编.医疗器械生物学评价标准汇编[M].北京:中国标准出版社,2005.
[10]王云,王青山.纳米羟基磷灰石及其复合材料在口腔医学中的应用[J].中国组织工程研究与临床康复,2010,14(8):1426-1428.
[11]Skrtic D,Antonucci JM.Dental composites based on amorphous calcium phosphate-resin composition/physicochemical properties study[J].J Biomater Appl,2007,21(4):375 -393.
[12]Deng XM,Hao JY,WANG CS.Preparation and mechanical properties of nanocomposites of poly(D,L-lactide)with Ca-deficient hydroxyapatite nanocrystals[J].Biomat,2001,22(21):2867-2873.
[13]Sadat-Shojai M,Atai M,Nodehi A,et al.Hydroxyapatite nanorods as novel fillers for improving the properties of dental adhesives:synthesis and application[J].Dent Mater,2010,26(5):471-482.
[14]Rauschmann MA,Wichelhaus TA,Stirnal V,et al.Nanocrystalline hydroxyapatite and calcium sulphate as biodegradable composite carrier material for local delivery of antibiotics in bone infections[J].Bioma,2005,26a(15):2677-2684.
