表皮生长因子在牙齿萌出通道形成中的作用研究
2012-11-05刘宗霞杨春俞
刘宗霞,王 建,李 纾,杨春俞
(山东:1.潍坊医学院口腔医学系,潍坊 261053;2.潍坊口腔医院,潍坊 261011;3.山东大学口腔医学院牙周病科,山东省口腔生物医学重点实验室,济南 250012)
牙的萌出是牙胚、牙槽骨以及诸多细胞及其分子相互作用且复杂有序的生理过程。这一过程需要在牙胚的冠方形成萌出通道,即由邻近牙槽骨吸收形成硬组织通道,并且软组织通过吸收改建而形成软组织通道。表皮生长因子(epidermal growth factor,EGF)是参与牙萌出的关键性调控因子之一,Cohen(1962)首先发现将EGF注射到新生小鼠体内可以使切牙早熟性地萌出[1],并且Hoath等[2]证实在大鼠出生后0~3 d注射EGF,其促萌效果最佳,但其是否参与软、硬组织通道的形成尚不清楚。
本研究通过观察EGF/EGFR(epidermal growth factor receptor,表皮生长因子受体)在牙齿萌出前后口腔黏膜中的表达差异,研究EGF是否参与牙齿萌出通道的形成;通过研究EGF与牙囊细胞中单核细胞趋化蛋白-1(monocyte chemotactic protein-one,MCP-1)的关系,探讨其在牙槽骨的吸收,即硬组织通道形成过程中的作用。
1 材料和方法
1.1 主要材料和试剂
出生后不同发育期SPF级BALB/c小鼠、SPF级4~6 d龄Wistar大鼠(山东大学动物中心提供);PV二步法免疫组化检测试剂盒和DAB试剂盒(迈新生物技术公司);α-MEM培养液(Hyclone,美国);胎牛血清(FBS)(杭州四季青);EGF(Sigma,美国);四唑盐(MTT)、Trizol(上海生工生物工程有限公司);逆转录试剂盒(Fermentas);PCR试剂盒(大连宝生物公司)。
1.2 EGF/EGFR在牙齿萌出过程中表达的组织学定位观察
1.2.1 标本处理
分别取出生后13、15 d以及牙齿已萌出完成的成年BALB/C小鼠各4只,引颈处死后,分离解剖含下颌第一磨牙的下颌骨,置新鲜配制40 g/L多聚甲醛中固定过夜,根据发育时期的不同,分别用100 g/L EDTA脱钙液常温脱钙1~3月不等。梯度乙醇脱水,石蜡包埋,近中远中向5 μm连续切片,多聚赖氨酸包被的玻片捞片,60℃烤片2~3 h。HE染色观察牙齿发育的情况。
1.2.2 免疫组化PV二步法检测EGF/EGFR的表达
取上述各发育期小鼠的标本,二甲苯脱蜡,梯度水化至水,30 mL/L过氧化氢液室温孵育5 min,以阻断内源性过氧化物酶;复合消化液消化5 min,蒸馏水洗,血清封闭,室温孵育20 min,不洗,滴加一抗(1∶100稀释)37℃孵育1 h,PBS漂洗;滴加羊抗鼠IgG抗体-HRP多聚体,37℃孵育20 min,PBS漂洗;DAB溶液显色,蒸馏水冲洗,苏木素复染,中性树胶封片,显微镜下观察并照相。阴性对照片用PBS分别代替一抗或二抗。
1.3 EGF对牙囊细胞增殖和MCP-1表达的影响
1.3.1 大鼠牙囊细胞分离培养和鉴定
取出生后4~6 d的SPF级Wistar大鼠,参照Wise等[3]方法进行牙囊细胞分离培养。即大鼠引颈处死后,浸入750 mL/L乙醇2~3 s,体视显微镜下分离下颌第一磨牙的牙胚,10 g/L胰蛋白酶液消化1.5 h,在体视显微镜下分离牙囊组织。然后将分离的牙囊组织置于培养瓶中,加入含200 mL/L FBS的 α-MEM 培养液,在37℃,50 mL/L CO2以及饱和湿度下培养,每天在倒置显微镜下严密观察细胞生长状况,每3 d换液1次。待细胞单层生长达培养瓶底80%以上时,用胰蛋白酶消化法传代培养,取第3代牙囊细胞进行角蛋白、波丝蛋白免疫组化染色法鉴定细胞的组织来源,备用。
1.3.2 EGF对牙囊细胞增殖的影响
取生长良好的第3代牙囊细胞以2×104/孔接种于 96孔板,同时加入含 150 mL/L FBS的α-MEM培养液,37℃ 50 mL/L CO2条件下培养24 h,倒置相差显微镜下观察,见大多数牙囊细胞贴壁并伸展后,弃去孔内液体和未贴壁细胞,用无血清α-MEM培养液冲洗3次后,将细胞随机分为5个实验组和1个对照组共6组,每组复5孔。5个实验组分别加入含EGF终末浓度为0.5、1、5、10和50 ng/mL的含5 mL/L FBS的α-MEM培养液,对照组加含5 mL/L FBS的α-MEM培养液,每孔100 μL。然后将96孔培养板放入37℃,50 mL/L CO2的细胞培养箱中继续培养5 d后,每孔中加入5 mg/mL的MTT 20 μL,继续培养4 h后,吸弃孔内液体,每孔加入150 μL 的DMSO,振荡10 min,在分光光度仪490 nm波长下测吸光度(A)值。
1.3.3 RT-PCR 检测 EGF 对牙囊细胞MCP-1mRNA表达的影响
1.3.3.1 牙囊细胞处理
取生长良好的第3代牙囊细胞,用2.5 g/L的胰蛋白酶液消化后,配成单细胞悬液并接种于直径为70 mm培养皿中,加入含50 mL/L FBS的α-MEM培养液,37℃,50 mL/L CO2条件下培养。次日去除未贴壁细胞,待细胞生长至汇合点时,将细胞随机分为4个实验组和1个对照组。4个实验组先用无血清的α-MEM培养液培养5 h后,均换用含EGF终末浓度为10 ng/mL的无血清α-MEM培养液,并分别继续孵育0.5、1、3、6 h 后终止培养。对照组用无血清的α-MEM培养液培养5 h后终止培养。
1.3.3.2 RT-PCR 检测
上述各组细胞终止培养后,Trizol法提取总RNA,反转录合成 cDNA,以 cDNA为模板扩增MCP-1和内参照β-actin。引物由上海博尚生物科技公司合成。
MCP-1分子引物序列:上游引物:5'GCAGGTCTCTGTCACGCTT3',下游引物:5'GTGCTTGAGGTGGTTGTGGAAA3',该引物产生413 bp的cDNA片段。β-actin分子引物序列:上游引物:5'CCCTGAAGTACCCCATTGAA3',下 游 引 物:5'CTTTTCACGGTTGGCCTTAG3',该引物产生158 bp的cDNA片段。采用2 ×Taq PCR MasterMix 25 μL反应体系。反应条件一致为:94℃预变性3 min,94 ℃变性 35 s、54.4 ℃退火35 s、72 ℃延伸1 min,35个循环;最后72℃延伸5 min。
1.3.3.3 PCR 产物鉴定和分析
取8 μL PCR产物经12 g/L琼脂糖凝胶电泳,溴化已啶染色,DL 2000 Maker 5 μL作参照,80 V电压下电泳,在紫外线箱中观察并照相记录。用UVP凝胶成像系统照相,并用JD801显微图像分析系统分析软件测量其积分光密度值。
1.4 统计学分析
2 结果
2.1 EGF/EGFR的组织学定位
小鼠出生后13 d时,在下颌第一磨牙冠方可观察到退化的成釉细胞、口腔上皮、固有层,EGFR在其冠方口腔黏膜的全层包括基底层、棘层和角化层呈强阳性表达(图1),EGF在口腔黏膜上皮呈弱阳性表达(图2)。小鼠出生后15 d时,牙齿冠方的软组织融合为实性的上皮细胞团,部分细胞呈现为空泡状的凋亡状态(图3)。此时,EGFR仅在缩余釉上皮处呈强阳性表达,其余部分表达明显减弱,处于凋亡状态的细胞无表达(图4)。而EGF在实性上皮团中呈阴性表达(图3)。
在牙齿萌出后,EGFR的表达集中于上皮基底层(图5),EGF的表达集中于口腔黏膜的固有层(图6)。
2.2 牙囊细胞的培养和鉴定
与葛少华等[4]的实验结果相似,牙囊组织培养24 h后便可见少数细胞从组织周围爬出,14~21 d后细胞即可达单层汇合。主要有两种细胞形态,一种细胞呈梭形,另一种细胞呈多角形,两种细胞间杂在一起生长。免疫细胞化学染色显示细胞的波形蛋白表达阳性(图7),角蛋白表达阴性(图8),表明细胞源自间充质。
2.3 EGF对牙囊细胞增殖的影响(表1)
EGF对牙囊细胞增殖的影响在浓度为5 ng/mL时开始显效,10 ng/mL时达到最高,两者与对照组相比差异均有统计学意义(P<0.05)。50 ng/mL时增殖活性开始降低,且与对照组无显著性差异(P >0.05)。
表1 EGF对牙囊细胞增殖的影响(A490,)

表1 EGF对牙囊细胞增殖的影响(A490,)
*与对照组比较 P<0.05
EGF(ng/mL)细胞增殖活性0.0(对照组)0.094 ±0.0090.5 0.107 ±0.0221.0 0.111 ±0.0195.0 0.116 ±0.012*10.0 0.125 ±0.006*50.0 0.103 ±0.008
2.4 EGF对体外培养的牙囊细胞MCP-1 mRNA表达的影响
PCR产物测序结果与基因库中公布的MCP-1(M -57441)序列100%一致。MCP-1、β-actin 的扩增产物分别为413、158 bp(图9)。牙囊细胞与10 ng/mL EGF 共同孵育0.5 h,牙囊细胞中MCP-1 mRNA表达开始升高,3 h表达最高,以后逐渐恢复,但仍比对照组高,即共同孵育 0.5、1、3、6 h 各时间点MCP-1 mRNA表达量均明显高于对照组,差异有统计学意义(P<0.05)(图10)。

图2 13 d小鼠,EGF在下颌第一磨牙冠方上皮层呈弱阳性表达(×20)
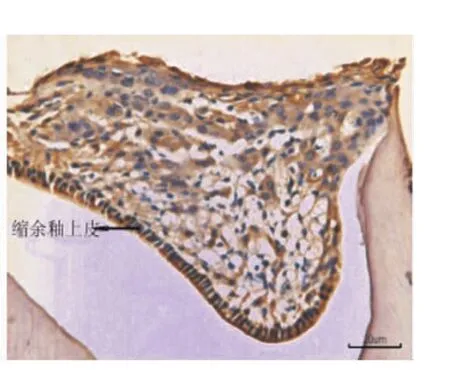
图4 15 d小鼠,EGFR在缩余釉上皮中呈阳性表达,在实性上皮团其余部分表达明显减弱(×20)

图5 牙齿萌出完成后,EGFR在牙龈上皮基底层呈阳性表达,在固有层中无表达(×20)
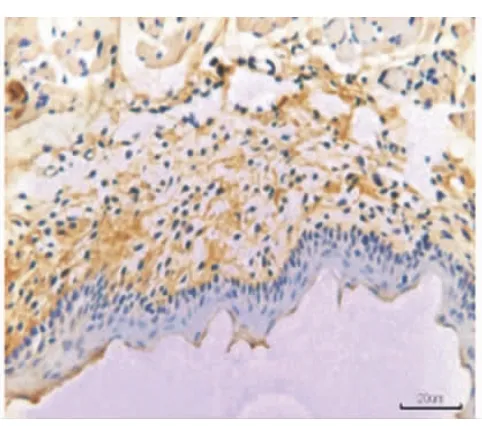
图6 牙齿萌出完成后,EGF在牙龈固有层呈阳性表达,在上皮层中无表达(×20)

图7 牙囊细胞抗波形丝蛋白染色呈阳性(棕黄色),位于细胞浆中,胞核着色阴性(免疫细胞化学染色,×20)

图8 牙囊细胞抗角蛋白染色呈阴性,蓝色为苏木素复染的细胞核(免疫细胞化学染色,×20)

图9 EGF对牙囊细胞MCP-1表达的影响
3 讨论
牙齿的萌出是在牙冠形成后,牙胚向牙合面移动,穿过骨隐窝和口腔黏膜,直至达到功能位置的一个复杂的过程。这一过程可分为3个时期:萌出前期、萌出期和萌出后期(或功能期)[5]。其中,萌出前期的主要变化是牙根形成时牙胚在牙槽骨中的移动,这一过程需要相应部位的牙槽骨发生吸收和改建,以形成利于牙萌出的硬组织通道。在萌出期,覆盖在牙冠表面的缩余釉上皮分泌多种酶,溶解结缔组织,形成一个有上皮衬里的软组织通道。因此我们可以认为软、硬组织通道的建立是牙得以顺利萌出的关键所在。

图10 EGF作用后牙囊细胞MCP-1mRNA表达的积分光密度值(*与对照组相比P<0.05)
EGF属于小分子多肽,是细胞生长因子的一类,与其受体结合,在靶细胞内产生一系列生物学效应,包括促进表皮生长和角化[6-7],促进 DNA合成,引起细胞增殖等。EGF是参与牙萌出的重要调控因子之一,将其注射到新生大鼠体内,可有效促进磨牙的萌出[2],但其具体的促萌机制尚不清楚。
Huvsseune等[8]通过光镜和电子显微镜观察斑马鱼第一副牙齿萌出过程,认为上皮的改建在牙萌出过程中发挥着重要的作用。牙萌出时,缩余釉上皮分泌酶,溶解结缔组织,加之萌出时上皮对结缔组织的压力,使结缔组织破坏。这时,缩余釉上皮外层细胞和口腔上皮细胞增殖并移动到退变的结缔组织处,在萌出牙的上方融合形成上皮团,继而上皮团中央细胞死亡,形成一个有上皮衬里的牙萌出通道,通过该通道,牙萌出时不会发生出血[5]。本研究在15 d小鼠下颌第一磨牙的冠方观察到实性的上皮细胞团,符合上述理论。同时还发现,13 d时EGF在小鼠下颌第一磨牙冠方的口腔黏膜上皮层中呈弱阳性表达,而其在成年鼠的口腔黏膜中的表达仅限于固有层。Wise等[9]报道,在刚出生大鼠体内注射EGF可以增加星网状层细胞IL-1α的表达,提示在体外EGF也可促进星网状层细胞 IL-1α以及 IL-1α mRNA的表达。Modeer等[10]研究发现,EGF可促进 IL-1诱导前列腺素E2(PGE2)的生成。PGE2可以抑制成纤维细胞的增殖及胶原的合成,并使基质金属蛋白酶(MMPs)增加,从而促进结缔组织的溶解吸收。上述研究结果提示EGF可促进结缔组织的退变吸收。本研究发现,牙齿萌出后,EGFR表达于口腔黏膜上皮的基底层,随细胞向棘层分化而逐渐消失。而出生13 d时,EGFR在口腔黏膜的全层呈强阳性表达,高水平表达的EGFR明显增强了上皮细胞对生长因子的反应性,促进它与受体结合形成复合物,这样势必促进了口腔黏膜上皮的增殖分化进程。这进一步证实了牙齿萌出时,其冠方结缔组织的退化吸收,上皮的增殖改建是实性上皮团得以顺利形成的关键。出生15 d时,在实性上皮团中,EGF呈阴性表达,EGFR仅在退化的成釉上皮处维持强阳性表达,其余部分表达明显减弱,处于凋亡状态的细胞无表达。表明EGF/EGFR的相互作用集中于上皮改建的初期,即EGF可能主要在实性上皮团的形成过程中发挥着积极的作用。由此可见EGF可能通过间接诱导PGE2的合成,促进结缔组织的溶解吸收,并且可促进冠方上皮的增生融合,参与了上皮团的形成,这可能在软组织通道的形成中发挥着重要的作用。
单核细胞进入牙囊并在其中聚集是牙萌出的关键[11],此后单核细胞转变成破骨细胞,破骨细胞吸收牙槽骨以形成牙齿萌出的硬组织通道。本研究发现:EGF具有促进体外培养的牙囊细胞增殖的作用,且呈剂量依赖性,5~10 ng/mL EGF可显著促进牙囊细胞的增殖,10 ng/mL时增殖活性最强,50 ng/mL时增殖活性开始减弱。推测EGF可能通过促进牙囊细胞中EGFR的表达,并与之结合,从而有效的促进了牙囊细胞的增殖。EGF是否可通过促进牙囊细胞的有丝分裂而参与牙的萌出有待进一步研究,但现在至少可以证实EGF在维持牙囊细胞的增殖活性方面发挥着积极的作用。
选择EGF的较佳效应浓度10 ng/mL来检测其对MCP-1的影响,结果发现10 ng/mL的EGF具有促进MCP-1表达的作用,共同培养0.5 h开始起效,在3 h表达增强最显著,以后逐渐减弱。MCP-1表达的降低可能是由于大量外源性的EGF抑制了牙囊细胞表面EGFR的表达,受体表达下降会减弱EGF上调MCP-1转录和翻译的过程。Que等[12]研究证实,在大鼠体内注射EGF同样可促进牙囊细胞中MCP-1的表达,进一步证实了EGF对于MCP-1的上调作用。EGF通过促进牙囊细胞分泌MCP-1,诱使单核细胞迁入牙囊,从而促进硬组织通道的形成。
牙萌出是牙胚和周围牙槽骨内发生的多种与牙萌出相关的信号分子共同参与的复杂的激联过程[13],可能存在多种通路,EGF可能在软、硬组织通道的形成过程中发挥着积极的作用,但其具体的过程仍不清楚,有待进一步的研究。
[1]Cohen S.Isolation of mouse submaxillary gland protein accelerating incisor eruption and eyelid opening in the new-born animal[J].J Biol Chem,1962,237:1555-1562.
[2]Hoath SB.Treatment of the neonatal rat with epidermal growth factor:differences in time and organ response[J].Pediatr Res,1986,20(5):468-472.
[3]Wise GE,Lin F,Fan W.Culture and characterization of dental follicle cells from rat molars[J].Cell Tissue Res,1992,267(3):483-492.
[4]葛少华,李德懿,杨丕山.小鼠牙囊细胞的体外分离培养鉴定及异质性研究[J].上海口腔医学,2004,13(6):506-509.
[5]于世凤,汪说之.口腔组织病理学[M].北京:人民卫生出版社,2004.
[6]Cohen S.The stimulation of epidermal proliferation by a specific protein(EGF)[J].Dev Biol,1965,12(3):394 -407.
[7]Steidler NE,Reade PC.Histomorphological effects of epidermal growth factor on skin and oral mucosa in neonatal mice[J].Archs Oral Biol,1980,25(1):37 -43.
[8]Huvsseune A,Sire JY.The role of epithelial remodelling in tooth eruption in larval zebrafish[J].Cell Tissue Res,2004,315(1):85-95.
[9]Wise GE,Lin F,Zhao L.Immunolocalization of interleukin-1 alpha in rat mandibular molars and its enhancement after in vivo injection of epidermal growth factor[J].Cell Tissue Res,1995,280(1):21-26.
[10]Modeer T,Yucel-Lindberg T,Iinuma M,et al.Epidermal growth factor potentiates interleukin 1 and tumor necrosis factorinduced prostaglandin biosynthesis in human gingival fibroblasts[J].Cytokine,1993,5(3):198 -204.
[11]Nakchbandi IA,Weir EE,lnsogna KL,et al.Parathyroid hormone-related protein induces spontaneous osteoclast formation via a paracrine cascade[J].Proc Natl Acad Sci USA,2000,97(13):7296-7300.
[12]Que BG,Wise GE.Tooth eruption molecules enhance MCP-1 gene expression in the dental follicle of the rat[J].Dev Dyn,1998,212(3):346-351.
[13]Wise GE,Frazier-Bowers S,D'Souza RN.Cellular,molecular,and genetic determinants of tooth eruption[J].Crit Rev O-ral Biol Med,2002,13(4):323-334.
