多酚氧化酶交联β-酪蛋白的抗原性变化初步研究
2012-11-02高金燕刘法辉陈红兵
程 伟,高金燕,李 欣,刘法辉,陈红兵
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047; 2.南昌大学中德联合研究院,江西南昌330047; 3.南昌大学环境与化学工程学院,江西南昌330047; 4.南昌大学生命科学与食品工程学院,江西南昌330047)
多酚氧化酶交联β-酪蛋白的抗原性变化初步研究
程 伟1,2,3,高金燕1,4,李 欣1,4,刘法辉1,4,陈红兵1,2,*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047; 2.南昌大学中德联合研究院,江西南昌330047; 3.南昌大学环境与化学工程学院,江西南昌330047; 4.南昌大学生命科学与食品工程学院,江西南昌330047)
利用多酚氧化酶催化牛乳β-酪蛋白交联,并通过ELISA方法检测交联前后β-酪蛋白抗原性的变化。SDS-PAGE结果显示,多酚氧化酶可以有效地催化β-酪蛋白交联。同时,间接竞争ELISA检测的β-酪蛋白交联后的半抑制浓度(IC50值)由2.63μg/mL变为4.07μg/mL,表明交联后β-酪蛋白抗原性明显降低。本研究工作为通过多酚氧化酶交联制备低致敏性乳制品提供了部分理论依据。
多酚氧化酶,酶交联,β-酪蛋白,牛奶过敏
酶交联蛋白技术是食品非热加工中的一种新方法,它是利用酶催化蛋白质发生交联反应,使蛋白质内部多肽链之间(分子内交联)或蛋白质之间(分子间交联)形成共价键,改变其原有的空间结构,从而改善蛋白质的乳化性、起泡性等一系列功能特性[1]。已报道用于催化蛋白质交联的酶有转谷酰胺酶、过氧化物酶、多酚氧化酶等[2]。其中,多酚氧化酶(Polyphenol oxidase,PPO;EC 1.14.18.1),通常也称为酪氨酸酶,是由核编码的含铜金属酶,广泛存在于各种动物、植物和微生物中,是果蔬等农产品发生酶促褐变的主要原因[3],这也是人们早期对其功能的认识。新近的一些研究表明,多酚氧化酶也能够催化乳蛋白发生交联反应[4]。目前,酶交联乳蛋白的研究主要集中于改善其乳化性、起泡性等功能性[5],而对交联后乳蛋白的抗原性变化研究报道较少,且国内未见关于PPO交联牛乳蛋白后其抗原性变化的相关报道。本研究采用双孢蘑菇多酚氧化酶催化牛乳中主要过敏原β-酪蛋白(β-Casein,β-CN)进行交联,并分析交联后β-酪蛋白抗原性的变化,旨在利用交联技术降低牛乳过敏原蛋白质的抗原性,为利用酶交联技术制备低致敏性乳制品提供理论依据。
1 材料与方法
1.1 材料与设备
双孢蘑菇 市售;β-酪蛋白 实验室自制;咖啡酸、羊抗兔IgG:HRP酶标二抗、OPD底物 美国Sigma公司;96孔可拆酶标板 深圳金灿华实业有限公司;邻苯二酚、丙酮、磷酸氢二钠、磷酸二氢钠等常规试剂 均为国产分析纯。
Allegra 64R高速冷冻离心机 美国Beckman公司;Model 860酶联免疫检测仪、BIO-RAD凝胶成像系统 美国Bio-Rad公司;TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 PPO酶液制备 取市售的新鲜双孢蘑菇去皮、切碎,放入研钵中,加入液氮,迅速用研钵研磨至无明显颗粒的粉末状。加入预冷丙酮(-20℃),用布氏漏斗进行抽滤,将得到的粉末经真空冷冻干燥后,即得多酚氧化酶粗酶粉,-20℃保存备用。取多酚氧化酶丙酮粉2.5g,加入4℃预冷的50mL磷酸盐缓冲液(0.05mol/L、pH 7.0),磁力搅拌30min,4000×g离心20min,取上清液即为多酚氧化酶酶液[6]。
1.2.2 PPO酶活测定 参照Gawlik-Dziki[7]等的方法,用磷酸盐缓冲液(0.05mol/L、pH 7.0)配制0.04mol/L邻苯二酚溶液。测酶活时,取2.8mL邻苯二酚溶液作为反应底物,加入0.2mL粗酶液,混匀后在420nm波长处比色,从酶液加入后开始计时,每30s记录1次OD420nm值,以最初直线段的斜率计算酶比活力。一个酶活力单位定义为在测定条件下,每分钟引起光密度值改变0.001所需的酶量。
1.2.3 抗β-酪蛋白多克隆抗体的制备 按照常规免疫方法[8],利用本实验室分离得到的β-酪蛋白免疫日本大耳兔,制备抗β-酪蛋白多克隆抗体。选取2只 8周龄大的雄性日本大白耳兔(体重 1.8~2.0kg),编号为A、B,所选日本大白耳兔喂养的食物中确保不含牛乳蛋白。喂养一周无异常后,开始免疫。免疫前,耳静脉采血作为阴性血清。
β-酪蛋白与弗氏完全佐剂1∶1混匀乳化后皮下多点注射日本长耳大白兔,免疫剂量为1mg/只。等量的抗原与弗氏不完全佐剂乳化后每隔两周加强免疫,并用间接ELISA法检测兔血清的效价,当抗体效价升高并平稳后即动脉取血获得多克隆抗体。
1.2.4 PPO酶促交联β-酪蛋白方案 β-酪蛋白用磷酸盐缓冲液(0.05mol/L、pH 7.0)稀释至1.0mg/mL,加入100mmol/L咖啡酸并使其终浓度为1mmol/L,然后继续加入PPO粗酶液,并使反应体系中多酚氧化酶浓度达到1.000U/mL,最后补充蒸馏水使β-酪蛋白溶液终质量浓度为0.5mg/mL,混匀,30℃反应6h后,放入-20℃保存。同时设空白组和对照组,空白组为0.5mg/mL的β-酪蛋白,对照组为用灭活的酶(灭活条件:90℃,10min)代替反应体系中的多酚氧化酶。
实验得到的交联产物,按照Laemmli[9]的方法,进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),根据蛋白条带的变化分析并观察β-酪蛋白的交联情况。
1.2.5 竞争ELISA法检测交联前后β-酪蛋白的抗原性 采用间接竞争抑制ELISA方法[10-11],检测PPO交联β-酪蛋白后的抗原性变化。实验步骤如下。
1.2.5.1 抗原包被 用包被液稀释β-酪蛋白至浓度为6.25μg/mL,100μL/孔加入酶标板A中,4℃过夜。
1.2.5.2 洗涤 次日倾去孔内的液体,用250μL/孔PBST(含0.05%吐温-20的磷酸盐缓冲液,10mmol/L,pH 7.4)溶液洗板3次,甩干。
1.2.5.3 封阻 酶标板A中加入3%的明胶进行封阻,每孔250μL,37℃放置1h。
1.2.5.4 板外竞争 另取一块新的酶标板B,先用3%的明胶封阻1h后,洗涤,然后分别加入不同稀释浓度的竞争蛋白(β-酪蛋白和交联蛋白),再加入等体积的一抗,37℃孵育1h。
1.2.5.5 加样 酶标板A封阻结束后,从酶标板B孔中吸取竞争蛋白与一抗的混合物以100μL/孔的量对应加入酶标板A孔内,于37℃孵育1h。
1.2.5.6 加酶标二抗 用PBS将羊抗兔IgG:HRP酶标二抗稀释,加入100μL/孔,37℃孵育1h。
1.2.5.7 显色 加新鲜配制的OPD底物溶液100μL/孔,37℃暗处反应15min。
1.2.5.8 终止反应 加 50μL/孔终止液(2mol/L H2SO4)中止反应。
1.2.5.9 比色 用酶联免疫检测仪在490nm下测定各孔的吸光值。
根据得到的OD值,将各浓度的2种竞争蛋白(β-CN和β-CN交联蛋白)对应的OD值转换成结合率(B/B0)的%值,无竞争蛋白时的OD值为B0,各浓度的竞争蛋白对应的 OD值为 B。然后,以(B/B0)的%值为纵坐标,以相对应的竞争蛋白浓度的对数值—lg[竞争蛋白]为横坐标,绘制竞争ELISA标准曲线,并计算出IC50值,比较β-CN和β-CN交联蛋白的IC50值,并确定其抗原性变化。
2 结果与分析
2.1 多酚氧化酶性状
实验制备得到的多酚氧化酶酶液成透亮的棕色液体,测得酶活为6300U/mL。
2.2 抗牛乳β-酪蛋白兔血清效价
用间接ELISA法测得兔血清效价,结果如图1所示,至免疫第9周,兔血清效价不再升高,即动脉取血获得多克隆抗体。最终测定A兔血清效价为1∶240000,B兔为1∶150000。选用A兔血清用于后续抗原性评价实验。
2.3 交联蛋白的SDS-PAGE图谱分析
β-酪蛋白交联后的 SDS-PAGE图谱如图2所示。
根据图2可以看出,多酚氧化酶催化交联β-酪蛋白后,原有低分子量β-酪蛋白几乎完全消失,转而生成了大量高分子量的交联蛋白。可见,在本实验条件下,多酚氧化酶主要催化β-酪蛋白分子间的交联反应,β-酪蛋白通过分子间交联生成了多聚体,随着β-酪蛋白多聚物的形成,其蛋白质化学结构会有所改变,可以推测它的抗原性也会随之受到影响。
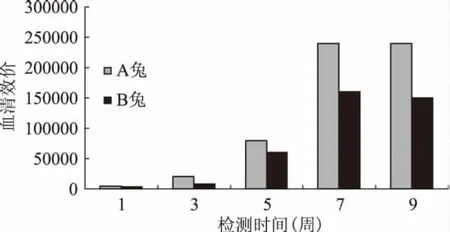
图1 兔对牛乳β-酪蛋白的免疫应答(抗血清效价的变化)Fig.1 Immune response of the rabbits against β-casein(Antiserum change defined by ELISA)
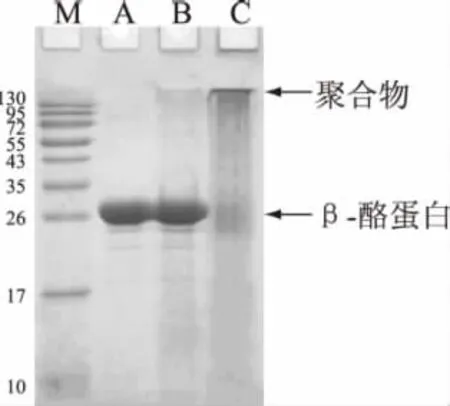
图2 PPO对β-酪蛋白的交联效果Fig.2 Effect of PPO on the cross linking of β-casein
2.4 多酚氧化酶交联β-酪蛋白后的抗原性变化
间接竞争ELISA法检测β-酪蛋白交联前后的抗原性结果如表1所示。
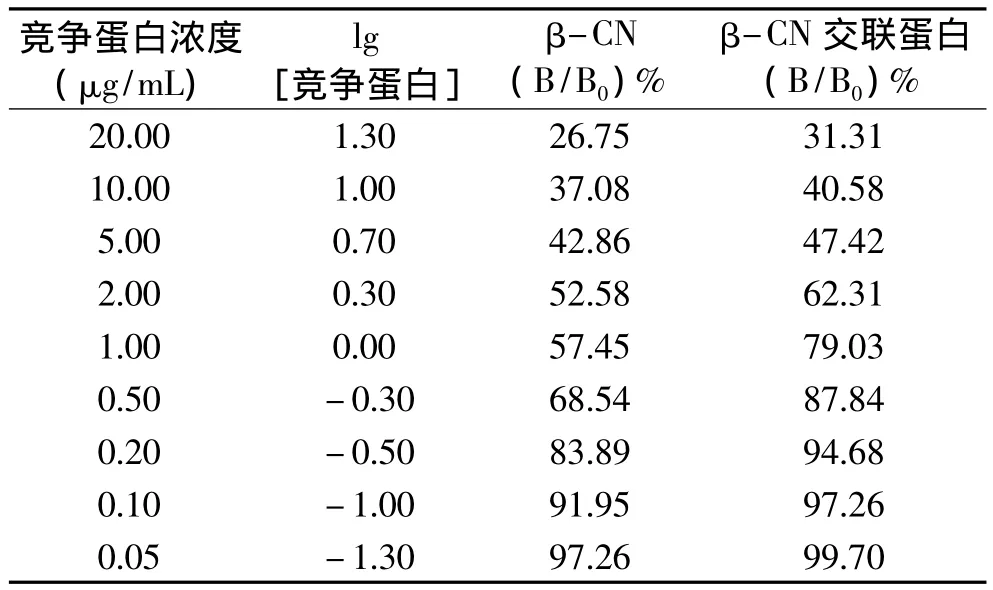
表1 β-CN与β-CN交联蛋白间接竞争ELISA结果Table 1 Results of indirect competitive ELISA for β-CN and β-CN cross-linked protein
根据间接竞争ELISA结果绘制标准曲线如图3所示。
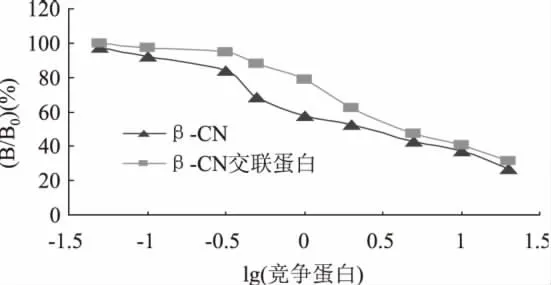
图3 间接竞争ELISA法标准曲线Fig.3 Standard curve by indirect competitive ELISA
在间接竞争 ELISA标准曲线中,当结合率(B/B0)%为50%时,则其抑制率也为50%,此时所对应的竞争抗原的浓度就为半抑制浓度,也称IC50值。在抗原抗体反应中,IC50的数值越大,表明达到半抑制率所需的竞争抗原量越多,也就是竞争抗原与特异性IgG的结合能力越弱,即抗原性越弱。从本实验得到标准曲线可以得出,β-CN的IC50值为2.63μg/ mL,β-CN交联蛋白的IC50值为4.07μg/mL。由此可见,β-CN交联后的IC50值明显升高,即β-酪蛋白经过多酚氧化酶催化交联后,交联蛋白与特异性IgG的结合能力减弱,其抗原性明显降低。
3 讨论
酶交联蛋白技术作为一种可以有效改善食品蛋白质功能特性的手段,已经成功地运用于许多食物蛋白的结构与功能的改性中,但由于交联位点以及空间位阻等原因,常用的转谷氨酰胺酶不适于直接催化天然状态的乳清蛋白交联,除非加入二硫苏糖醇等还原剂,这限制了转谷氨酰胺酶在乳蛋白交联中的发展。多酚氧化酶作为一种新兴的催化蛋白交联的酶类,受到越来越多的关注。本实验中研究利用双孢蘑菇中提取的多酚氧化酶催化牛乳β-酪蛋白交联,证明其可以有效地催化β-酪蛋白交联,并生成多聚体形态的交联蛋白,这进一步验证和显示了多酚氧化酶在乳蛋白交联中的应用潜力。
最近,Leszczyńska等研究发现,用转谷氨酰胺酶处理的面粉,可以使其过敏原性降低30%[12],同时Garcia等发现,过氧化物酶也可以降低苹果中过敏原Mal d1的特异性IgE结合能力[13]。这一系列研究报道,预示了酶交联技术可能成为一种降低食物过敏原性的新方法,值得深入探索。本研究结果显示,利用多酚氧化酶催化交联β-酪蛋白,交联反应生成的β-酪蛋白交联蛋白与自然状态的β-酪蛋白相比,其抗原性明显降低。这可能是由于多酚氧化酶催化β-酪蛋白交联而形成多聚体,使部分原来暴露在蛋白质表面的过敏原表位被包裹进蛋白质内部,掩盖了原有的一些过敏原表位,因而降低β-酪蛋白的抗原性。
牛乳及乳制品因其丰富的营养而深受人们的喜爱,但同时,牛乳及乳制品又是一类常见的食物过敏原,流行病学研究资料显示,2%~2.5%的婴幼儿会对牛乳产生过敏反应[14-15],牛乳过敏的潜在性、广泛性和长期性使其成为乳制品行业发展的一大难题。目前,低致敏牛乳的生产主要依据酶水解技术,利用多种蛋白酶对牛乳进行限制性水解而减少其过敏原表位,达到降低过敏原性的目的,但在水解过程中不可避免的会产生苦味肽,这大大影响了牛乳的风味。本研究结果进一步表明,酶交联蛋白技术可以明显降低牛乳的抗原性,为利用多酚氧化酶交联制备低致敏性乳制品提供了部分理论依据,具有广阔的应用前景。
[1]Anuradha S,Prakash V.Altering functional attributes of proteins through cross linking by transglutaminase-A case study with whey and seed proteins[J].Food research international,2009,42(9):1259-1265.
[2]程伟,陈红兵,高金燕,等.酶改性对食物蛋白质过敏原性的影响[J].食品科学,2010,31(23):391-394.
[3]代丽,宫长荣,史霖,等.植物多酚氧化酶研究综述[J].中国农学通报,2007,23(6):322-326.
[4]Buchert J,Ercili Cura D,Ma H,et al.Crosslinking food proteins for improved functionality[J].Annual Review of Food Science and Technology,2010(1):113-138.
[5]Hiller B,Lorenzen PC.Functional properties of milk proteins as affected by enzymatic oligomerisation[J].Food Research International,2009,42:899-908.
[6]吴进菊,高金燕,刘潇,等.双孢蘑菇多酚氧化酶交联作用对酪蛋白乳化性及其稳定性的影响[J].食品科学,2010,31 (15):117-120.
[7]Gawlik-Dziki U,Zlotek U,Swieca M.Characterization of polyphenol oxidase from butter lettuce(Lactuca sativa var.capitata L.)[J].Food Chemistry,2008,107(1):129-135.
[8]杨苗,侯先志,杨银芬,等.牛-β-酪蛋白多克隆抗体的制备及鉴定[J].中国兽医科学,2010,40(11):1180-1183.
[9]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227: 680-685.
[10]WroblewskaB,KaramacM,AmarowiczR,etal. Immunoreactive properties of peptide fractions of cow whey milk proteins after enzymatic hydrolysis[J].International Journal of Food Science and Technology,2004,39:839-850.
[11]布冠好,郑喆,郑海,等.牛乳过敏原β-乳球蛋白间接竞争ELISA检测方法的建立[J].中国农业大学学报,2008,13 (6):71-76.
[12]LeszczyńskaJ,LckaA,BryszewskaM.Theuseof transglutaminase in the reduction of immunoreactivity of wheat flour[J].Food and Agricultural Immunology,2006,17(2): 105-113.
[13]Garcia A,Wichers J H,Wichers H J.Decrease of the IgE-binding by Mal d1,the major apple allergen,by means of polyphenol oxidase and peroxidase treatments[J].Food Chemistry,2007,103(1):94-100.
[14]Selo I,Clement G,Bernard H,et al.Allergy to bovine betalactoglobulin:specificity of human IgE to tryptic peptides[J].Clin Exp Allergy,1999,29(8):1055-1063.
[15]Heinzmann A,Blattmann S,Spuergin P,et al.The recognition pattern of sequential B cell epitopes of beta-lactoglobulin does not vary with the clinical manifestations of cow’s milk allergy[J]. International Archives of Allergy and Immunology,2000,120(4): 280-286.
Antigenicity changes of enzymatically crosslinked β-casein by polyphenol oxidase
CHENG Wei1,2,3,GAO Jin-yan1,4,LI Xin1,4,LIU Fa-hui1,4,CHEN Hong-bing1,2,*
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China; 2.Sino-German Joint Research Institute,Nanchang University,Nanchang 330047,China; 3.School of Environmental and Chemical Engineering,Nanchang University,Nanchang 330047,China; 4.School of Life Sciences and Food Engineering,Nanchang University,Nanchang 330047,China)
The study focused on the antigenicity changes of cross-linked β-casein catalyzed by polyphenol oxidase using indirect competitive ELISA method.The SDS-PAGE profile showed that the polyphenol oxidase could catalyze the cross-linked β-casein effectively.Meanwhile,according to the results of indirect competitive ELISA,the half inhibitory concentration(IC50values)of β-casein after crosslinked changed from 2.63μg/mL into 4.07μg/mL,indicating the antigenicity of crosslinked β-casein decreased significantly.It might provide some theoretical basis for developing hypoallergenic dairy through protein crosslinking by polyphenol oxidase.
polyphenol oxidase;enzymatic cross-linking;β-casein;milk allergy
TS201.2+5
A
1002-0306(2012)08-0219-04
2011-05-23 *通讯联系人
程伟(1986-),男,硕士研究生,研究方向:生物加工工程。
国家自然科学基金(30860220,31171716);教育部新世纪优秀人才支持计划(NCET-08-0704);国家科技支撑计划项目(2011BAK10B03);南昌大学食品科学与技术国家重点实验室项目(SKLF-MB-201002,SKLF-TS-201109);南昌大学研究生创新专项资金项目。
