高压处理对牛骨骼肌原肌球蛋白结构的影响
2012-11-02乌云娜莎丽娜格日勒图
乌云娜,莎丽娜,格日勒图
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
高压处理对牛骨骼肌原肌球蛋白结构的影响
乌云娜,莎丽娜,格日勒图*
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
从牛骨骼肌中提取原肌球蛋白,施行0.1~400MPa的高压处理,解压后测定原肌球蛋白荧光光谱、光谱质量中心、芳香族表面疏水性、脂肪族表面疏水性、表面巯基含量的变化来探讨压力对原肌球蛋白结构的变化。荧光光谱强度及光谱质量中心与对照组(0.1MPa)相比,随着压力的增加有逐渐下降趋势,最大荧光波长发生蓝移。100MPa时芳香族、脂肪族表面疏水基团显示出最低荧光强度值,压力继续升高时又逐渐上升。表面巯基含量在100MPa时大幅增长,随着压力的增加有缓慢的增长趋势。从此结果可推测压力引起原肌球蛋白的结构变化,而这些变化可能是一定程度的可逆性变化。
高压处理,原肌球蛋白,光谱质量中心,表面疏水性,巯基
肉类科学领域中,高压处理可降低宰后肌肉僵直程度、促进肌肉到食肉的变化、引起内源性蛋白酶活性变化、对肌肉嫩化产生积极的作用[1-3]。为了解析这些变性机理有许多关于高压对肌肉蛋白质结构影响方面的研究报道。Ikkai等[4]报道了高压对肌动蛋白的影响,发现在没有ATP存在下>150MPa时肌动蛋白发生不可逆变性,而在ATP存在下>250MPa时发生不可逆变性,说明ATP可保护肌动蛋白受高压而引起的变性。王志峰等[5]以及Gerelt等[6]从牛骨骼肌中提取G-肌动蛋白后进行高压处理,使用荧光光谱、圆二色光谱、核磁共振等分析,发现G-肌动蛋白在300MPa压力时三级结构发生不可逆变化。Chia-Ling等[7]对罗非鱼肌球蛋白进行50~300MPa压力处理后发现,150MPa压力时肌球蛋白变性,并随着Ca2+-ATP酶活性的减少,肌球蛋白形成网状结构。但高压对骨骼肌原肌球蛋白的影响极少。原肌球蛋白与肌动蛋白、肌钙蛋白相互作用构成细丝,在肌肉收缩过程中起重要调节作用。它由两条平行的α-螺旋链(α、β链)相互缠绕组成,由284个氨基酸构成,分子量在30~40ku之间,约占肌原纤维蛋白质的5%~8%。以往对原肌球蛋白的研究主要集中于它的性质及功能等[8-10]方面,而对它在高压下的变化情况尚不明确。本实验从牛骨骼肌中提取原肌球蛋白,进行不同程度的高压处理,解压后测定原肌球蛋白功能基团的变化,探讨压力对原肌球蛋白的结构影响。通过本研究解明肌肉蛋白质的结构与机能的变性情况,并为高压技术在肌肉蛋白质的特性控制、促进肌肉成熟、嫰化以及新产品的开发等方面提供有效的理论依据。
1 材料与方法
1.1 材料与仪器
新鲜牛肉 购于呼和浩特市西口市场,宰后取自同一头牛的后臀腿肉,取样后在-20℃条件下保存;透析袋MD44 Solarbio公司;cis-parinaric acid(cPA)、ANSA(8-nalino-1-naphthalene sulphonic acid)、β-Mercaptoethanol 美国sigma公司;2,2-Dithiobis-(5-nitropyridine)(DTNP) 美国Aldrich公司;半胱氨酸 BBI公司。
QW-DJ18A多功能绞肉机 佛山市顺德区奇伟电器有限公司;FSH-2高速匀浆机 常州国华电器有限公司;H2500R-2超速冷冻离心机 湖南湘仪实验室仪器开发有限公司;BG-Power600稳流稳压电泳仪 北京百晶生物技术有限公司;UVWIN5可见紫外分光光度计 北京普析通用仪器有限责任公司;RF-5301PC荧光分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 原肌球蛋白的提取 原肌球蛋白的提取参考Bailey等[11]的方法,在低温(2~4℃)条件下进行。取肌肉组织100g破碎,a.加入等体积超纯水,缓慢搅拌15min,高速匀浆1min。在4℃条件下静置30min,两层纱布过滤;b.滤出物等体积加入97%乙醇,充分搅拌后纱布过滤;c.滤出物加入4倍体积的50%乙醇、97%乙醇、乙醚各洗两次,在通风橱里干燥成粉末;d.干燥物每100g加入700mL 1mol/L KCl,调pH至7.0;e.室温下搅拌12h,纱布过滤(留滤液);f.滤出物再次加入1mol/L KCl,搅拌1h后纱布过滤;g.滤液与e步滤液混合,调pH至4.3;h.10400×g条件下离心20min;i.沉淀加5倍体积的超纯水充分溶解,调pH至7.0,搅拌加入0.7倍体积的饱和硫酸铵;j.10400×g条件下离心20min,上清加硫酸铵粉末至70%饱和度,4℃条件下静置2h;k.18000×g条件下离心1h,沉淀在少量超纯水里溶解,在大量超纯水里透析24h;l.取出上清液加入粉末KCl至1mol/L浓度;返回第h步同样操作重复两次,第一次重复时硫酸铵粉末加至60%饱和度,第二次循环加至55%饱和度;m.最后一次透析在0.1mol/L KCl(pH7.0)溶液里透析24h,得到的上清液即为原肌球蛋白。
1.2.2 SDS-PAGE电泳分析 根据Leamml等[12]的方法,采用12.5%的分离胶与4.5%的浓缩胶进行SDSPAGE电泳,检测提取的原肌球蛋白纯度。以考马斯亮蓝G-250染色。
1.2.3 高压处理 根据Suzuki等[13]的方法对原肌球蛋白进行高压处理。在4℃条件下分别进行100、200、300、400MPa压力处理,保压时间为5min,以常压(0.1MPa)作为对照组。
1.2.4 光谱质量中心的测定 光谱质量中心的测定采用Ruan等[14]的方法,在室温条件下进行。用20mmol/L Tris-HCl(pH7.0)溶液将原肌球蛋白浓度调整为0.2mg/mL,激发波长280nm,发射波长范围为304~ 450nm,激发狭缝10nm,发射狭缝10nm,扫描速度为中速,等条件下进行荧光测定。由下列公式计算光谱质量中心:

式中:[V]为质量中心;Vi为波长的倒数;Fi为荧光强度。
1.2.5 芳香族表面疏水性的测定 芳香族表面疏水性的测定采用Boyer等[15]的方法,在室温条件下进行。用0.04mol/L Tris-HCl(pH7.5)缓冲溶液将样品浓度调整为0.05mg/mL,铝箔遮光的试管里加2.5mL样品,加8μL 5mmol/L ANSA溶液,搅拌均匀后,在激发波长为380nm,发射波长为475nm条件下进行荧光强度测定。
1.2.6 脂肪族表面疏水基团的测定 脂肪族表面疏水基团的测定采用Boyer等[15]的方法,在室温条件下进行。用0.04mol/L Tris-HCl(pH7.5)缓冲溶液将样品浓度调整为0.05mg/ml,2.5mL样品加12.5μL 1mmol/L cPA溶液,搅拌均匀后,在激发波长为325nm,发射波长为410nm条件下进行荧光强度测定。
1.2.7 表面巯基(-SH)含量的测定 表面巯基含量的测定采用小幡明雄等[16]的方法,在室温条件下进行。以半胱氨酸溶液做标准曲线,样品溶液用0.1mol/L的磷酸缓冲液调整质量浓度至0.6mg/mL。调好的样品溶液及标准溶液2.00mL,加入5×10-4mol/L DTNP乙醇溶液0.5mL,0.5mL DTNP乙醇溶液,搅拌后室温条件下反应约20min。反应结束后,添加2.50mL 10% HCIO4,在1000×g条件下离心15min除去蛋白质。用滤纸(ADVANTEC 5C)过滤,取上清液在波长386nm处测定吸光度。
使用SAS方差分析,分析各实验组组间数据。
2 结果与讨论
2.1 原肌球蛋白SDS-PAGE电泳图
从牛骨胳肌中提取原肌球蛋白后纯度通过SDSPAGE电泳检测,结果见图1。SDS-PAGE电泳检测结果表明提取的原肌球蛋白较纯,没有其他杂蛋白,图中TM即为原肌球蛋白两条肽链,出现了分子量分别约为36、38ku的两个条带。因此我们考虑用于以下实验。
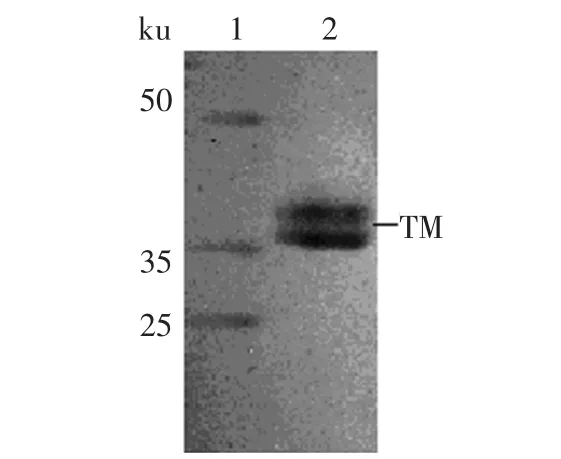
图1 原肌球蛋白SDS-PAGE电泳图Fig.1 SDS-PAGE profile of tropomyosin
2.2 高压处理对原肌球蛋白荧光光谱及光谱质量中心的影响
图2为压力处理后的原肌球蛋白用20mmol/L Tris-HCl(pH7.0)溶液调整其质量浓度至0.2mg/mL,在激发波长为280nm,发射波长为300~480nm下测得的荧光光谱图。
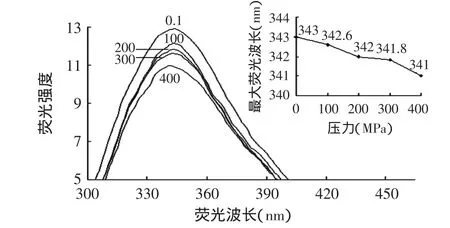
图2 高压处理对原肌球蛋白荧光光谱及最大荧光波长的影响Fig.2 Effect of high pressure treatment on the fluorescence spectra and maximum wavelength of tropomyosin
由图2中可以看出,原肌球蛋白荧光强度随压力的增加呈下降趋势。此外,最大荧光波长由343nm移动到341nm,发生了蓝移(右上图)。图3为根据以上的数据结果,计算出来的光谱质量中心结果图。原肌球蛋白光谱质量中心随着压力的增加也呈下降趋势,在100MPa时与对照组(0.1MPa)相比下降迅速(P<0.05),表明原肌球蛋白受压力影响较大,在压力作用下结构发生收缩现象,使得位于分子表面的酪氨酸(或色氨酸)残基被包埋在分子内部而降低了光谱质量中心。随着压力的继续增加下降缓慢,100MPa和200MPa以及300MPa和400MPa之间得差异不显著,100MPa与300、400MPa之间差异显著。以上结果可以推测原肌球蛋白受压力后有一定的结构上的变化,100MPa压力对其作用较大,分子发生收缩现象,而在大于100MPa的压力时这些结构变化在解压后有恢复现象,因此压力对原肌球蛋白结构的变化有一定程度的可逆性。此结果只是在280nm下测定的蛋白质内源性荧光物质(酪氨酸)放射出的光强度来计算的质量中心的变化,只能说明酪氨酸周边的结构发生可逆性的变化,难于说明原肌球蛋白整体的结构变化。
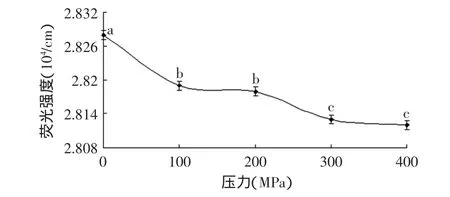
图3 高压处理对原肌球蛋白光谱质量中心的影响Fig.3 Effect of high pressure treatment on the center of spectral mass of tropomyosin
2.3 高压处理对原肌球蛋白芳香族表面疏水基团的影响
蛋白质疏水相互作用是维持蛋白质三级结构的主要作用力,它对蛋白质结构的稳定和功能性质具有重要的作用。ANSA荧光探针法是一种评价蛋白质表面疏水性的方法,是水溶液中蛋白质三级结构的一种反映。ANSA与芳香族氨基酸结合后在380nm激发波长下475nm处有最大吸收,且荧光强度与蛋白质的表面疏水性成正相关[17]。本实验采用此方法测定了高压处理后原肌球蛋白芳香族表面疏水基团,结果如图4所示。
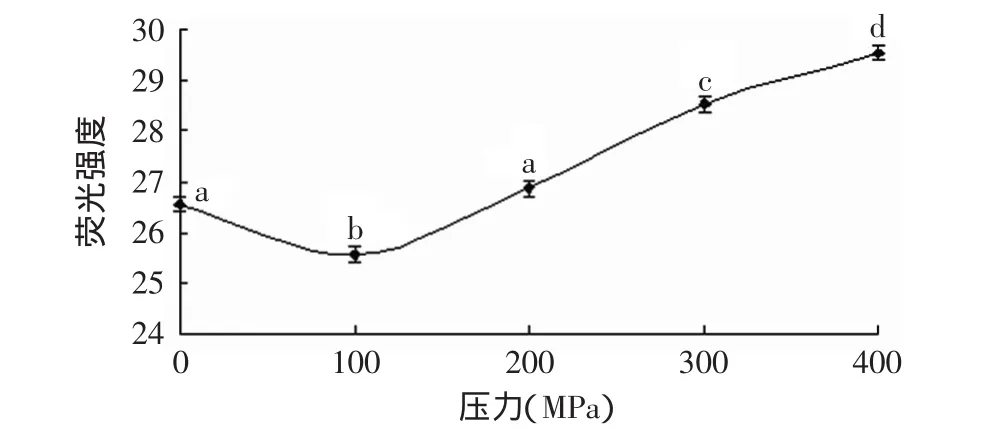
图4 高压处理对原肌球蛋白芳香族表面疏水基团的影响Fig.4 Effect of high pressure treatment on the surface aromatic hydrophobicity of tropomyosin
由图4可看出,与对照组(0.1MPa)相比,100MPa时芳香族表面疏水基团略有降低(p<0.05),而后随着压力的升高有上升趋势(p<0.05),200MPa时与对照组相比没有显著差异。100MPa时芳香族表面疏水基团的降低可能是因为在压力作用下原肌球蛋白分子发生了收缩现象,使得疏水性氨基酸隐藏在内而降低了表面疏水性。而在200MPa时受压力影响的原肌球蛋白分子有所恢复,表面疏水基团与常压时状态相近,被包埋的芳香族疏水性氨基酸暴露出来而增加了表面疏水性。随着压力的继续增加原肌球蛋白分子空间结构逐步发生变化,压力破坏了蛋白分子内部疏水相互作用,产生和暴露了更多的疏水性区域,原肌球蛋白三级结构发生变化。
2.4 高压处理对原肌球蛋白脂肪族表面疏水基团的影响
原肌球蛋白分子中脂肪族疏水性氨基酸将近占总氨基酸的30%,在稳定原肌球蛋白三维结构中起到重要作用[8]。cPA是检测脂肪族氨基酸疏水性常用的荧光探针,cPA与脂肪族氨基酸结合后在325nm激发波长下在410nm处有最大吸收,本实验采用此方法检测压力处理后原肌球蛋白脂肪族表面疏水性,结果如图5所示。
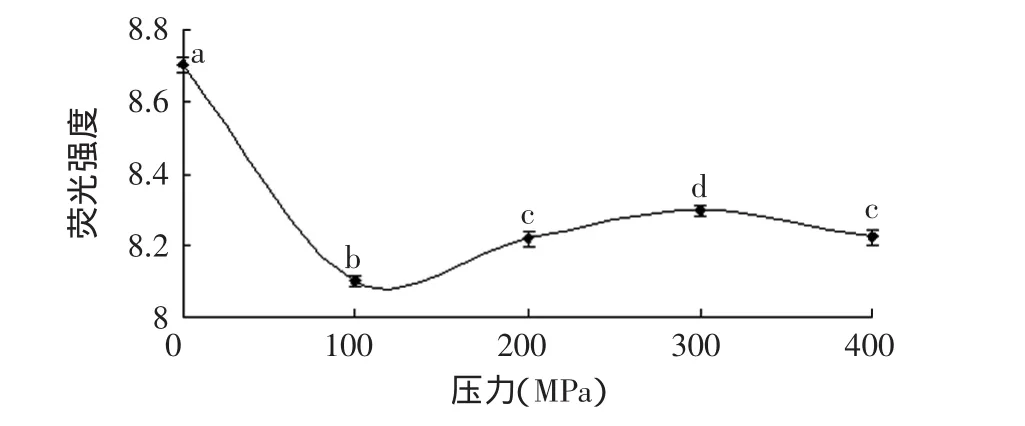
图5 高压处理后原肌球蛋白脂肪族表面疏水基团含量的变化Fig.5 Changes of surface aliphatic hydrophobicity content of tropomyosin after high pressure treatment
由图5看出,脂肪族表面疏水基团在100MPa时与对照组相比迅速下降(p<0.05),这时脂肪族表面疏水基团降低到最低值,原因可能是在压力作用下原肌球蛋白分子的收缩使得脂肪族疏水性氨基酸隐藏在内而降低了表面疏水性。这结果符合芳香族表面疏水基团的变化规律。随着压力升高脂肪族表面疏水基团又有缓慢上升趋势(p<0.05)。但与芳香族表面疏水基团变化不同的是脂肪族表面疏水基团在各个压力下的变化均比常压低,而芳香族表面疏水基团到300MPa时比常压有上升趋势。脂肪族表面疏水性的缓慢增加可能是在压力(>100MPa)作用下原肌球蛋白分子发生了解聚,或解压过程中破坏了原有的疏水相互作用,隐藏在内的疏水性残基又暴露出来发生了结构上的变化而造成。原肌球蛋白分子由α、β-两条肽链组成,由284个氨基酸构成,其中将近30%为脂肪族疏水性氨基酸,而芳香族疏水性氨基酸不到5%[8],受压力影响更多的脂肪族疏水性氨基酸发生收缩等结构变化,这可能是压力处理后的脂肪族疏水基团的荧光强度比常压低的原因之一。发生此原因的未知问题较多,因此有必要进一步研究。
2.5 高压处理对原肌球蛋白表面巯基基团的影响
巯基是形成二硫键的原体,两个巯基配对可形成一个二硫键。二硫键在维持蛋白质分子三级结构中扮演着重要的角色,它的形成对于蛋白质稳定其空间结构和保持生理活性具有重要的影响,是蛋白质折叠过程中的重要步骤[18]。蛋白质结构中巯基的氧化以及二硫键的断裂都会引起巯基含量的变化,其含量变化可以反映出蛋白质的变性程度。
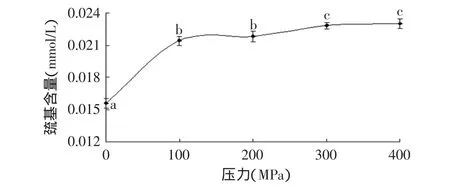
图6 高压处理后原肌球蛋白表面巯基基团含量的变化Fig.6 Change of surface sulfhydryl group of tropomyosin after high pressure treatment
从图6可以看出,随着处理压力的升高表面巯基含量增加,在100MPa时与常压相比增加了37.2%(p<0.05,100MPa时的巯基含量与常压时巯基含量的比值)。而在100MPa到400MPa之间增加较缓慢,100MPa和200MPa以及300MPa和400MPa之间得差异不显著,100MPa与300、400MPa之间差异显著。表明原肌球蛋白的巯基基团在100MPa时受压力影响较大,结构上发生了变化,而在更高的压力时变化缓慢,说明解压后这些结构变化有所恢复,因此压力对原肌球蛋白结构变化是可逆变化。此结果符合质量中心的变化。原肌球蛋白α-链的190位上有一个半胱氨酸(Cys),β-链的36位和190位上有Cys,但190位上的Cys在分子中比较不稳定[19]。受压力影响,这些原有结构发生一定程度的变化,或导致原肌球蛋白分子间的二硫键断裂形成巯基基团而增加了表面巯基含量,造成了原肌球蛋白的表面巯基基团增加。
3 结论
3.1 牛骨骼肌原肌球蛋白荧光强度随压力的升高有下降趋势,最大荧光波长发生蓝移。光谱质量中心在100MPa时与常压(0.1MPa)相比下降迅速,随着压力的继续增加下降缓慢,在100MPa和200MPa以及300MPa和400MPa之间得变化不显著。压力对原肌球蛋白结构的变化可能是可逆变化。
3.2 牛骨骼肌原肌球蛋白芳香族、脂肪族表面疏水基团在100MPa时与常压(0.1MPa)相比有下降趋势,压力继续升高时又开始缓慢上升。但不同的是芳香族表面疏水基团到300MPa时比常压有上升趋势,而脂肪族表面疏水基团比常压低。这可能与受压力影响的疏水性氨基酸数量有关。
3.3 牛骨骼肌原肌球蛋白表面巯基基团含量在100MPa时与常压(0.1MPa)相比增加了37.2%,而在100MPa和200MPa以及300MPa和400MPa之间得增加不显著。表明压力作用下原肌球蛋白分子间的二硫键断裂形成巯基,但解压后这些结构变化有所恢复,有一定程度的可逆性。
由以上结果推测:从此结果可推测100MPa以上的压力引起原肌球蛋白的结构变化,而这些变化可能是一定程度的可逆性变化。
[1]Atsushi Suzuki,Ken Kim,Yoshihide Ikeuchi.Understanding the pressure effects on postmortem muscle[J].Progress in Biotechnology,1996,13:289-298.
[2]Homma N,Ikeuchi Y,Suzuki A.Effects of high pressure treatmenton proteolytic system in meat[J].Progressin Biotechnology,1996,13:327-330.
[3]Foutune N S,Geeves M A,Ranatunga K W.Contractile activation and force generation in skeletal rabbit muscle fibers effects of hydrostatic pressure[J].The Journal of Physiologye,1994,474:283-290.
[4]Ikkai T,Ooi T.The effects of pressure on G-F transformation of actin[J].Biochemistry,1966,5(5):1551-1560.
[5]王志峰,包·格日勒图.高压处理对牛骨骼肌G-肌动蛋白结构的影响[J].食品科学,2010,31(13):6-9.
[6]Gerelt B,Zhi-feng Wang,Yamamoto S,et al.Structural changes in rabbit skeletal muscle G-Actin after highhydrostatic pressure[J].Proceeding of 56th international congress of meat science and technology,Jeju,Korea,2010:93.
[7]Chia Ling Jao,Jyh Sheng Hwang,Wen Ching Ko,et al.A kinetic study on inactivation of tilapia myosin Ca2+-ATPase induced by high hydrostatic pressure[J].Food Chemistry,2007,101:65-69.
[8]Oe M,Ohnish Kameyama M,Nakajima,et al.Muscle type specific expression of tropomyosin isoforms in bovine skeletal muscles[J].Meat Science,2007,75:558-563.
[9]孔祥臣.原肌球蛋白对肌球蛋白的作用研究[D].大连:大连医科大学,2008.
[10]徐丹.原肌球蛋白对血管平滑肌细胞游走能力影响的研究[D].大连:大连医科大学,2003.
[11]Bailey K.Tropomyosin a new asymmetric protein component of the muscle[J].Fibrit Biochem J,1948,43:271-279.
[12]Leammli UK.Cleavage of structural proteins during the assembly of the head of bacferiophage[J].Nature,1970,227: 680-685.
[13]Suzuki A,Watanabe M,Iwamura K,et al.Effect of high pressure treatment on the ultrastructure and myofibril protein of beef skeletal muscle[J].Agricultural and Biological Chemistry,1990,54:3085-3091.
[14]Ruan K,Lange R,Meersman F,et al.Fluorescence and FTIR study of the pressure-induced denaturation of bovine pancreas trypsin[J].European Journal of Biochemistry,1999,265:79-95.
[15]Boyer C,Joandel S,Ouali A,et al.Determination of surface hydrophobicity of fast and slow myosin from rabbit skeletal muscle:implication in heat-induced gelation[J].Journal of the Science of Food and Agriculture,1996,72:367-375.
[16]小幡明雄,松浦腾,福岛男.2,2-Dithiobis-(5-nitropyridine)を用いる豆乳中のSH基の吸光度定量[J].Nippon Shokuhin Kogyo Gakkaishi,1989,36:707-711.
[17]Alizadeh-Pasdar N,Li-chan,E C Y.Comparison of protein surface Hydrophobicity measured at various pH values using three different fluorescent probes[J].Journal of Agricultural and Food Chemistry,2000,48:328-334.
[18]Wittrup K D.Disulfide bond formation and eukaryotic secretory productivity[J].Current Opinion in Biotechnolgoy,1995,6:203-208.
[19]Letrer SS.Intramolecular crosslinking of tropomyosin via disulfidebond formation:Evidence forchain register[J]. Proceedings of the National Academy of Science of the United State of America,1971,72:3371-3381.
Effect of high pressure treatment on the structure of bovine skeletal muscle tropomyosin
WU Yun-na,SHA Li-na,Gerelt*
(College of Food Science and Engineering,Inner Mongolia Agricultural University,Huhhot 010018,China)
Tropomyosin was prepared from bovine skeletal muscle and then exposed to high pressures ranging from 0.1 to 400MPa.The pressure-induced structural change of tropomyosin was explored in terms of fluorescence spectrum,center of spectral mass,the surface aromatic and aliphatic hydrophobicity,and the amount of surface sulfhydryl group after releasing pressure.The fluorescence intensity and the center of spectra mass were decreased gradually with increase of pressure compared with the control(0.1MPa),and the fluorescence spectrum of tropomyosin exhibited a blue shift due to exposure to higher pressure.The amounts of surface aromatic and aliphatic hydrophobicity were reached its minimum value exposed to pressure of 100MPa and then increased gradually with the pressure increase.The amount of surface sulfhydryl group was increased greatly exposed to pressure of 100MPa and then increased gradually with the increase of pressure. Therefore,high pressure induced the structural change of tropomyosin which might be reversible.
high pressure;tropomyosin;center of spectral mass;surface hydrophobicity;sulfhydryl group
TS201.2+1
A
1002-0306(2012)03-0052-05
2011-01-20 *通讯联系人
乌云娜(1986-),女,硕士,研究方向:肉类科学。
国家自然基金项目(20676058)。
