外源激素对圆叶牵牛毛状根生长及次生代谢产物积累的影响
2012-11-02徐大卫王倩倩王鹏飞杨世海
徐大卫,王倩倩,王鹏飞,杨世海*
(1.吉林农业大学,吉林 长春 130118;2.中国药科大学,江苏 南京 210009)
外源激素对圆叶牵牛毛状根生长及次生代谢产物积累的影响
徐大卫1,王倩倩1,王鹏飞2,杨世海1*
(1.吉林农业大学,吉林 长春 130118;2.中国药科大学,江苏 南京 210009)
目的探讨不同外源激素对圆叶牵牛毛状根生长及次生代谢产物咖啡酸、咖啡酸乙酯含量的影响。方法利用增殖倍数法及高效液相色谱法测定毛状根的生长及其咖啡酸、咖啡酸乙酯的含量,从而明确各外源激素对圆叶牵牛毛状根的影响。结果2,4-D和6-BA不适合圆叶牵牛毛状根的培养。NAA、KT对毛状根有一定的促进作用,NAA最适宜的浓度为0.5 mg·L-1,KT最适宜的浓度为1.0 mg·L-1~1.5 mg·L-1。结论为圆叶牵牛毛状根大规模培养和调控次生代谢产物机理的研究奠定了基础。
外源激素;圆叶牵牛;毛状根;咖啡酸;咖啡酸乙酯
圆叶牵牛(Pharbitispurpurea(L.)Voigt)是旋花科一年生草本植物,种子可入药,称牵牛子。具有泄水通便,消痰涤饮,杀虫攻积的功能。用于水肿胀满,二便不通,痰饮积聚,气逆喘咳,虫积腹痛[1]。咖啡酸、咖啡酸乙酯是牵牛子的有效成分[2]。其中咖啡酸是重要的天然抗氧化剂[3],咖啡酸乙酯具有一定的抗炎作用[4]。在《中国药典》2005版中规定了牵牛子中咖啡酸、咖啡酸乙酯的总量不得低于0.2%,在《中国药典》2010版中取消了对牵牛子中咖啡酸、咖啡酸乙酯的含量要求。潘海峰等[5]测试了10批牵牛子,咖啡酸、咖啡酸乙酯的含量测定结果总低于0.20%,含量最多的只有0.026%。田连起等[6]研究发现生白丑、生黑丑、炒白丑、炒黑丑咖啡酸含量分别为0.016%、0.010%、0.0015%、0.0012%。可见牵牛子中咖啡酸,咖啡酸乙酯的含量非常低。然而利用毛状根技术可以生产植物次生代谢产物咖啡酸、咖啡酸乙酯,外源激素又对毛状根中次生代谢产物的的合成有不同程度的影响[7-13]。所以为了获取高产量的圆叶牵牛毛状根,并为以后的大规模培养和调控次生代谢产物机理的研究打下基础,本文探讨了不同激素对圆叶牵牛毛状根的影响。
1 仪器、试剂与材料
1.1 仪器与试剂
Agilent1100系列高效液相色谱仪(G1322A DEGASSER;G1311A QuatPump;G1318A COLCOM;G1314A VWD,chemistation system工作站);色谱柱:色谱柱为Agilent ZORBAX-C18(250 mm×4.6 mm,0.45 μm);咖啡酸、咖啡酸乙酯对照品购于中国药品生物制品鉴定所;甲醇为TEDIA公司产品,色谱级;纯净水为娃哈哈公司产品;其他试剂为分析纯。
1.2 材料
圆叶牵牛毛状根,由本实验室诱导,经吉林农业大学中药材学院杨世海教授鉴定。
2 方法
2.1 毛状根的培养
取0.1 g除菌完全、生长速度快的毛状根分别在含不同浓度的NAA、2,4-D、6-BA、KT的1/2 MS液体培养基中进行培养24 d,每个100 mL三角瓶中装培养液50 mL,温度为(27±2)℃,摇床转速为80 r·min-1,全部在暗条件下培养。以不加任何激素的1/2 MS液体培养基作为对照,考察各激素对毛状根的生长及次生代谢产物咖啡酸、咖啡酸乙酯含量的影响。
2.2 毛状根生长的测定
将收获的毛状根用蒸馏水清洗和过滤3遍,然后以布氏漏斗抽虑至无水滴下,称其鲜重(Fresh Weight,FW);再放入温度为45~50 ℃的烘箱中干燥直至其重量恒定,测其干重(Dry Weight,DW)。每次测定3瓶,取平均值,保存备用。计算公式为如下:
增殖倍数=(收获后鲜重-接种鲜重)/接种鲜重
2.3 毛状根中咖啡酸,咖啡酸乙酯的测定
2.3.1 色谱条件 色谱柱为Agilent ZORBAX-C18(250 mm×4.6 mm,0.45 μm),以甲醇为流动相A,0.04%磷酸(含2%异丙醇)为流动相B,按表1进行梯度洗脱,流速为1.0 mL·min-1,检测波长为325 nm。咖啡酸和咖啡酸乙酯的理论塔板数均不少于3 000。

表1 梯度洗脱
2.3.2 对照品溶液的制备及标准曲线的制备 精密称取咖啡酸对照品2.13 mg、咖啡酸乙酯对照品1.98 mg于100 mL容量瓶中,加甲醇溶解并定容至刻度,即得。分别精密吸取1,2,4,8,12,16,20 μL注入液相色谱仪,按上述条件进行检测,记录峰面积。以进样量为横坐标,峰面积值为纵坐标,绘制标准曲线,计算回归方程,咖啡酸的回归方程为Y=2 713 282.7X-1 982.8,r=0.999 3;咖啡酸乙酯的回归方程为Y=2 464 375.4X-2 011.8,r=0.999 6。
2.3.3供试品溶液的制备 取本品粉末(过四号筛)约2 g,精密称定,置索氏提取器中,用石油醚(60~90 ℃)回流提取2 h,弃去石油醚液,药渣挥干溶剂,加入三氯甲烷-甲醇(3∶1)混合溶液提取6 h,提取液回收溶剂至少量,转移至10 mL量瓶中,用同一溶剂洗涤容器至同一量瓶中,并稀释至刻度,摇匀即得。
2.3.4 供试品含量测定 分别精密吸取对照品溶液与供试品溶液各10 μL,注入液相色谱仪,在上述色谱条件下测定,记录峰面积,根据回归方程计算即得。
咖啡酸(咖啡酸乙酯)总产量(g)=干重(g)×咖啡酸(咖啡酸乙酯)含量
2.3.5 数据处理 本实验的测定数值均利用DPS软件进行统计分析[14]。
3 结果与讨论
3.1 2,4-D对圆叶牵牛毛状根的影响
将毛状根接种在含有不同浓度2,4-D的1/2 MS液体培养基中进行培养,24 d后测定鲜重,干重,结果如表2所示。以2,4-D的浓度为横坐标,咖啡酸、咖啡酸乙酯的总产量为纵坐标做曲线如图1所示。

表2 2,4-D对圆叶牵牛毛状根的影响
注:不同小写字母表示彼此之间存在显著性差异(P<0.05),不同大写字母表示彼此之间存在极显著性差异(P<0.01),统计分析方法为单因素统计分析。下同。

图1 2,4-D对圆叶牵牛毛状根中咖啡酸咖啡酸乙酯总产量的影响
表2中数据显示,在培养基中加入不同浓度的2,4-D时,圆叶牵牛毛状根的生长受到不同程度的影响。随着2,4-D浓度的增加,毛状根的增殖倍数减小,生长趋于缓慢,颜色也逐渐加深,愈伤化加剧。虽然2,4-D抑制毛状根的生长,但是高浓度的2,4-D明显促进咖啡酸、咖啡酸乙酯的合成。由图1中曲线也可以看出,随着2,4-D的浓度增加,咖啡酸,咖啡酸乙酯的总产量降低。综合考虑,2,4-D不适合圆叶牵牛毛状根的培养。
3.26-BA对圆叶牵牛毛状根的生长及次生代谢产物的影响
将毛状根接种在含有不同浓度的6-BA的1/2 MS液体培养基中进行培养,24 d后测定鲜重,结果如表3所示。
由表3中数据可以看出,6-BA对圆叶牵牛毛状根的生长有轻微的抑制作用,随着6-BA的浓度的增加,抑制作用渐强。6-BA对圆叶牵牛毛状根的干重及其咖啡酸、咖啡酸乙酯的含量没有明显的影响(P>0.05)。综上所述,6-BA不适合圆叶牵牛毛状根的培养。

表3 6-BA对圆叶牵牛毛状根的影响
3.3 NAA对圆叶牵牛毛状根的生长及次生代谢产物的影响
将毛状根接种在含有不同浓度的NAA的1/2 MS液体培养基中进行培养,24 d后测定鲜重,干重,结果如表4所示。以NAA的浓度为横坐标,咖啡酸、咖啡酸乙酯的总产量为纵坐标做曲线如图2所示。
在培养基中加入NAA时,低浓度NAA对毛状根的生长有促进作用,当浓度达到0.5 mg·L-1时,毛状根的生长最旺盛,生物量积累最大;当浓度高于1.5 mg·L-1时对毛状根的生长有抑制作用,但随着NAA浓度的增加,对咖啡酸、咖啡酸乙酯的积累有一定的促进作用。

表4 NAA对圆叶牵牛毛状根的影响
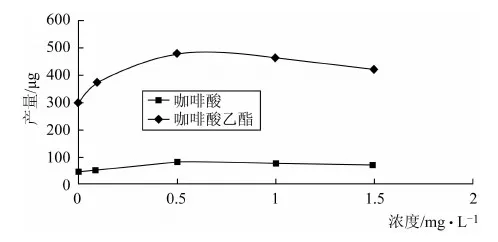
图2 NAA对圆叶牵牛毛状根中咖啡酸、咖啡酸乙酯总产量的影响
由图2可以看出,毛状根中咖啡酸、咖啡酸乙酯的总产量随着NAA浓度的增加而增加,当浓度为0.5 mg·L-1时,含量达到最大,浓度高于0.5 mg·L-1时,含量逐渐减小,但均高于未加NAA的产量高。综上所述,NAA对圆叶牵牛毛状根的生长及其咖啡酸、咖啡酸乙酯均有促进作用,最适宜的浓度为0.5 mg·L-1。
3.4 KT对圆叶牵牛毛状根的生长及次生代谢产物的影响
将发根接种在含有不同浓度的KT的1/2 MS液体培养基中进行培养,24 d后测定鲜重,结果如表5所示。
表5中数据显示,在培养基中加入不同浓度的KT,无论毛状根的生长还是毛状根中咖啡酸、咖啡酸乙酯的含量均存在差异。均呈现低浓度促进,高浓度抑制的现象。但是毛状根的增殖倍数和干重均在KT浓度为1.5 mg·L-1时达到最大值,分别为203.07倍,1.98 g,低于或高于1.5 mg·L-1时,促进作用逐渐减弱。但毛状根中咖啡酸、咖啡酸乙酯的含量均是在KT浓度为1.0 mg·L-1时达到最大,分别为0.023 7%、0.003 2%,分别是未加激素的1.27倍、1.28 倍。由图3曲线可以看出毛状根中咖啡酸、咖啡酸乙酯的总产量分别在1.5 mg·L-1,1.0 mg·L-1时含量最高434.492 1 μg、58.665 6 μg。综上所述,1.0 mg·L-1~ 1.5 mg·L-1的KT最适合圆叶牵牛毛状根的培养。

表5 KT对圆叶牵牛毛状根的影响

图3 KT对圆叶牵牛毛状根中咖啡酸、咖啡酸乙酯总产量的影响
4 小结
尽管植物的毛状根具有激素自主性,能在无激素的培养基上正常生长,但适当的加入激素仍能促进毛状根中次生代谢产物的合成。然而,激素种类,浓度不同对毛状根的作用也不同。
2,4-D、6-BA、NAA、KT均能不同程度地影响圆叶牵牛毛状根的生长及其咖啡酸、咖啡酸乙酯的积累,但是毛状根的生长和咖啡酸、咖啡酸乙酯的含量增长倍数并不同步。其中2,4-D明显抑制圆叶牵牛毛状根的生长,高浓度明显促进咖啡酸、咖啡酸乙酯的合成,但咖啡酸,咖啡酸乙酯的总产量逐渐降低;6-BA轻微抑制毛状根的生长,对毛状根的干重及其咖啡酸、咖啡酸乙酯的含量没有明显影响;NAA、KT对圆叶牵牛毛状根的生长及其咖啡酸、咖啡酸乙酯均有促进作用,最适宜毛状根的培养浓度分别为0.5、1.0~1.5 mg·L-1。
[1] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:237.
[2] 国家药典委员会.中国药典[S].一部.北京:化学工业出版社,2005:177-178.
[3] GULCN I.Antioxidant activity of caffeic acid[J].Toxicology,2006,217:213-220.
[4] 齐悦,王玉丽,张士俊,等.抗炎天然产物研究进展[J].中草药,2007,38(12):1761-1770.
[5] 潘海峰,李守拙.对2005版《中国药典》牵牛子药材含量测定问题的商榷[J].中药材,2006,29(6):640.
[6] 田连起,郑玉丽,白吉星,等.牵牛子(黑丑、白丑)炮制前后咖啡酸的含量比较研究[J].中医学报,2011,(5):387-391.
[7] 王冲之,丁家宜.不同培养基及外源激素对西洋参的生长和皂甙含量的影响[J].植物资源与环境学报,2001,10(4):1-4.
[8] 齐香君,郭乐康.外源激素对黄芩毛状根生长及黄芩苷合成的影响[J].陕西科技大学学报,2009,2:48-50.
[9] 于荣敏,马娜,严春艳,等.外源激素对何首乌毛状根生长及蒽醌类成分生物合成的影响[J].生物工程学报,2006,22(4):619-623.
[10]乔献丽,蒋曙光,吕晓芬,等.激素对转基因雪莲毛状根植株再生及类黄酮产生的影响[J].生物工程学报,2011,27(1):69-75.
[11] 杨世海,刘晓峰,果德安,等.决明毛状根诱导及激素与诱导子对毛状根生长和蒽醌类化合物合成的影响[J].中草药,2005,36(5):752-756.
[12] 周倩耘,丁家宜.植物激素对人参毛状根生长和皂苷含量的影响[J].植物资源与环境学报,2003,12(1):26-28.
[13] 刘高,饶力群,杨华.影响毛状根生长及其次生代谢产物合成因素的研究进展[J].生物技术通讯,2007,18(5):888-890.
[14] 唐启义,冯明光.DPS数据处理系统[M].北京:科学出版社,2006:57-60.
EffectofExogenousHormonesonGrowthofHairyRootandAccumulationofSecondaryMetabolitesinPharbitispurpurea
XU Da-wei1,WANG Qian-qian1, WANG Peng-fei2, YANG Shi-hai1
(1.JilinAgriculturalUniversity,Changchun130118,China;2.ChinaPharmaceuticalUniversity,Nanjing210009,China)
Objective:To explore the effects of different exogenous hormones on the growth of hairy root and the content of caffeic acid and ethyl caffeate inPharbitispurpurea.MethodsProliferation multiple and high performance liquid chromatography(HPLC) were used to measure the growth of hairy root and the content of caffeic acid and ethyl caffeate,thus make clear the effect of exogenous hormones on hairy root inPharbitispurpurea.ResultsThe exogenous of 2,4-D and 6-BA were unsuited as basic medium for hairy root inPharbitispurpurea,the exogenous of NAA and KT had certain promotion effect on hairy root.The optimum concentration of NAA was 0.5 mg·L-1,and that of KT was 1.0 mg·L-1~ 1.5 mg·L-1.ConclusionThis paper established the foundation for large-scale culture of hairy root inPharbitispurpureaand the mechanism of secondary metabolites’ regulation.
Exogenous hormones;Pharbitispurpurea;Hairy root;Caffeic acid;Ethyl caffeate
*
杨世海 ,E-mail:jlyangs@163.com
2012-04-28)
