甲硫氨基酸改性P25的可见光催化活性
2012-11-02马健
马 健
(延安市环境保护监测站,陕西 延安 716000)
TiO2是最合适的水光触媒光催化剂,由于其光催化活性高,良好的化学和生物稳定性,高能源效率,成本相对较低,无毒性,被认为是最具前途的光催化剂[1]。TiO2表面形成的羟基自由基(.OH)完全可以矿化各种污染物,甚至是在不添加化学添加剂的条件下。然而,由于其庞大的带隙,TiO2只能在紫外光(波长<387 nm)照射条件下才能被激发,这部分紫外光只占太阳光的3-5%,从而延缓了其在商业规模的应用。在开发利用可见光响应的TiO2光催化剂已经做出了很大努力。TiO2与非金属(C,N,F,S,B)掺杂就是一种最有效的方法来使TiO2从紫外光区的响应向可见光区域转移[2-5]。近年来,非金属共掺杂TiO2光催化剂的研究成为热点。例如,Sun等[6]通过钛酸四丁酯在混有硫脲和尿素的溶液中进行水解,制备了C和S共掺杂的TiO2,并进行氯酚降解实验。于占江等[7-8]以钛酸四丁酯为钛源,DL-甲硫氨酸为掺杂剂,制备了S和N共掺杂的TiO2光催化剂。Zhou等[9]将TiO2干凝胶与硫脲混合制备了C-NS共掺杂TiO2,该共掺杂TiO2在降解甲醛的试验中表现出比P25高六倍的降解效果。Ao等[10]通过结合溶胶凝胶法和表面活性助剂模板法,制备了C-N-S掺杂介孔TiO2,该催化剂表现出降解X-3B红色染料的高催化活性。Khan等[11]用火焰热分解法制备了C元素改性的TiO2,实现了TiO2光催化剂活性向可见光区的扩展。
本文采用甲硫氨基酸与P25光催化剂研磨-煅烧的方法,制备了具有可见光光催化活性的S、N共掺杂P25光催化剂。通过降解亚甲基蓝的评价实验,研究了掺杂TiO2光催化剂的光催化活性。
1 实验
1.1 试剂与仪器
甲硫氨基酸(生化级);P25(比表面积56.5 m2/g,68.5%锐钛矿相和31.5%金红石相)为德国Degussa公司生产;亚甲基蓝(分析纯)。
采用美国热电公司生产的Nicolet Almega拉曼光谱仪对制备得到的光催化剂进行分析,测试条件为:激发波长532 nm,扫描次数8次,激发能5 mW;采用紫外/可见光分光光度计(北京谱析通用仪器有限责任公司生产的TU-1900型)表征催化剂的光催化活性。
1.2 P25光催化剂的改性及活性评价
以不同比例的甲硫氨基酸和P25光催化剂放入玛瑙研钵中,研磨20 min,混合物在500℃、600℃、700℃分别煅烧1.5 h和2.0 h,制备得到甲硫氨基酸改性的P25光催化剂。
以亚甲基蓝的光降解为模型反应来评价催化剂的光催化活性。亚甲基蓝的光降解实验在自制的可见光光反应器(6只20 W日用荧光灯作为光源)中进行[12]。亚甲基蓝初始浓度为0.1 mg/L,在不同的光催化降解时间里,取出部分降解液,经离心机离心分离2 min后(2500 r/min),取上层清液,用分光光度计在波长665 nm处测定吸光度值[12]。计算亚甲基蓝脱色率(η)按照文献[12]中的方法进行。
2 结果与讨论
2.1 改性P25光催化剂的拉曼光谱分析
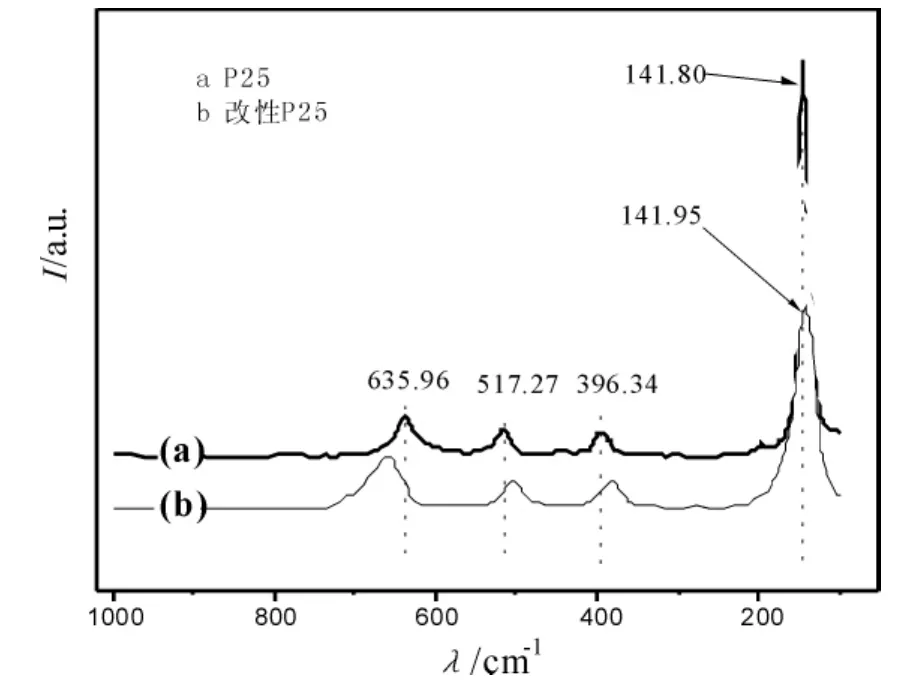
图1 P25及改性P25光催化剂的拉曼光谱
图1为P25及改性P25光催化剂的拉曼光谱对比图。催化剂的煅烧温度为700℃,煅烧时间为2.0 h,光催化剂的拉曼光谱分析结果表明,P25及改性P25光催化剂的4个拉曼峰属于锐钛矿相,但掺杂后的TiO2催化剂4个拉曼峰均发生了位移,并有宽化现象。说明S,N元素进入TiO2晶格后造成O:Ti比非计量化,正是这种氧缺位造成O-Ti-O键振动发生异常,出现拉曼谱峰的红移或蓝移以及峰宽化现象[12-13]。随着热处理温度的升高,TiO2中的锐钛矿晶体向金红石晶体转变,但拉曼光谱中没有出现金红石晶体峰,说明非金属元素的掺杂对锐钛矿相向金红石相的转变有一定程度的抑制作用[12-14]。
2.2 改性P25光催化剂的吸收光谱图
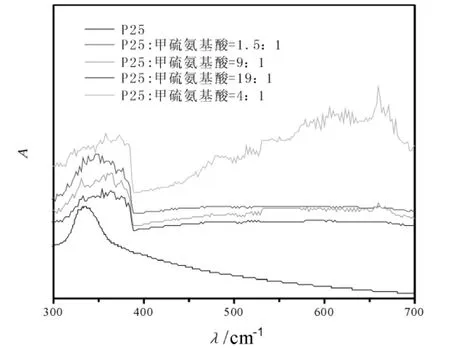
图2 甲硫氨基酸改性P25光催化剂吸收光谱
图2为甲硫氨基酸改性P25光催化剂紫外-可见光光谱图。由图2可以发现,P25与甲硫氨基酸的掺杂比例为4∶1时,其在紫外和可见光区均产生强的吸收。其它掺杂比例在可见光区的吸收并不如掺杂比例为4:1时的显著。掺杂比例为4∶1时,甲硫氨基酸改性P25光催化剂在紫外和可见光区均产生强吸收的原因:1)当掺杂的甲硫氨基酸比例小时,煅烧进入TiO2晶格中的元素较少,对TiO2晶格结构的改变也很小,难以产生足够的次能级,所以催化剂表现出对可见光的吸收很弱;而当甲硫氨基酸含量很高时,煅烧后进入TiO2晶格中的元素相应增多,对TiO2晶格的破坏会更加严重。因此,制备的掺杂光催化剂不能或较少产生可见光的强吸收[12-15]。
2.3 改性P25光催化剂降解亚甲基蓝试验
2.3.1 煅烧温度和时间对改性P25亚甲基蓝降解的影响
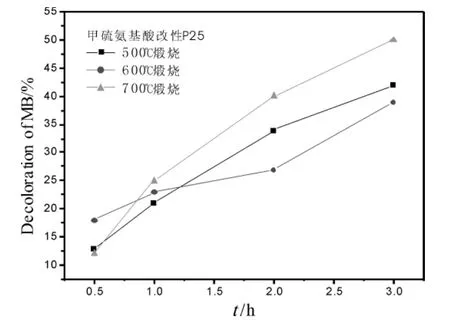
图3 煅烧温度对改性光催化剂降解亚甲基蓝的影响
图3为煅烧温度对甲硫氨基酸改性P25光催化剂对亚甲基蓝降解率的影响。煅烧温度分别为:500℃、600℃和700℃,煅烧时间为1.5 h。从图3中可以看出,在700℃煅烧1.5 h得到的改性P25,其亚甲基蓝的降解率约为50%;在600℃煅烧1.5 h的改性P25光催化剂初始亚甲基蓝降解速率高于500℃和700℃煅烧得到的光催化剂,但后期亚甲基蓝降解速率低,其最终降解率也明显低于500℃和700℃煅烧得到的光催化剂。可能是煅烧温度改变了甲硫氨基酸掺杂剂的掺杂改性历程,当在700℃煅烧催化剂时,最适合掺杂剂中的N或S元素替换P25中的氧或钛,从而嵌入P25晶格。甲硫氨基酸的存在,阻止或阻滞了P25催化剂的锐钛矿相向金红石相的相结构转变或转变速度,表现出700℃煅烧的改性催化剂比500℃、600℃煅烧的催化剂具有更高的降解率和降解速率常数(参见表1)。
图4为煅烧时间2.0 h,不同煅烧温度下制备的甲硫氨基酸改性P25光催化剂的降解亚甲基蓝曲线。由图3和图4发现,在同一煅烧温度下制备的光催化剂,其亚甲基蓝降解率呈现基本相同的变化规律,所不同的是煅烧2.0 h的改性P25光催化剂比煅烧1.5 h的催化剂具有较高的亚甲基蓝降解率,在煅烧温度为700℃,煅烧时间为2.0 h时,3 h对亚甲基蓝的降解率为54%,而P25为34%。随着煅烧时间的延长,甲硫氨基酸中的N或S元素不断地进入二氧化钛晶格中,并逐渐地与其形成完善、稳定的晶体结构,因而表现出对亚甲基蓝具有更高的降解活性或降解率。
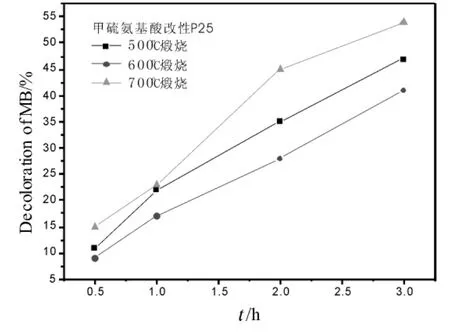
图4 煅烧温度对降解亚甲基蓝的影响(煅烧时间2.0 h)
对比图3和图4还可以发现,随着煅烧时间的增加降解率随之提高。当煅烧温度为500℃时,随着煅烧时间从1.5 h增加到2.0 h,亚甲基蓝降解率增加较大,但是随着煅烧温度的增加,亚甲基蓝降解率随煅烧时间增加而增大的趋势逐渐减弱。这说明低温(500℃)煅烧时,甲硫氨基酸中的N或S元素没有获得足够的快速进入P25晶格中的能量,当延长煅烧时间后,低能量的N或S元素能够借助时间的延长而慢慢地进入P25催化剂晶格,形成较完善的掺杂改性P25晶体,试验结果表现出煅烧2.0 h的改性P25光催化剂的亚甲基蓝降解率较之1.5 h的有较大幅度的提高;而当较高温度(600℃、700℃)煅烧时,热能对N或S元素进入P25催化剂晶格的影响显得并不重要,相反,高温带来的热能促使P25催化剂中的锐钛矿不断地向金红石相转变却成了控制光催化剂催化效率的主导因素,试验结果表现出随煅烧时间的增加,改性P25光催化剂的亚甲基蓝降解率增加较少。
2.3.2 光催化剂的光催化降解动力学
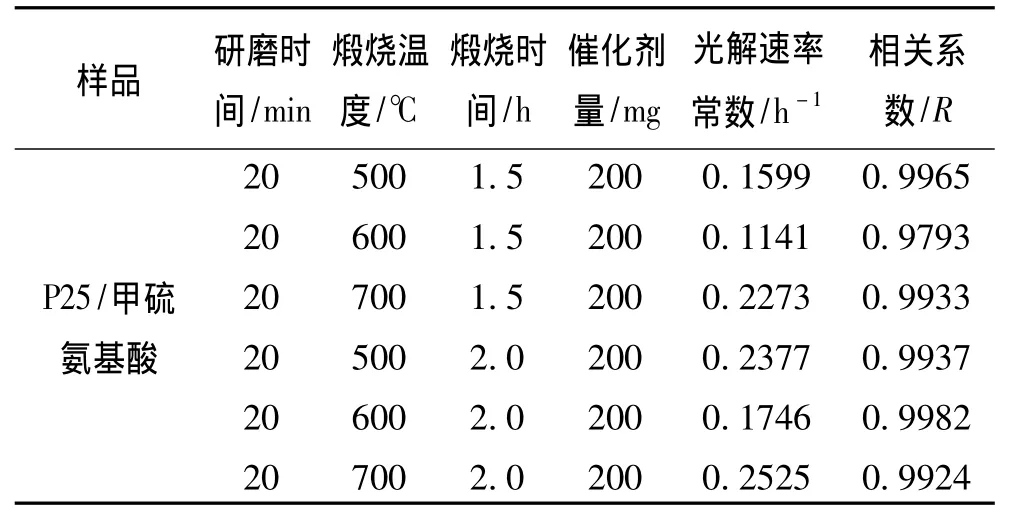
表1 甲硫氨基酸改性P25光催化剂的工艺和光解速率常数[15]
甲硫氨基酸改性P25光催化剂的光催化降解动力学计算方程采用Langmuir-Hinselwood动力学方程(L-H方程)加以描述。反应速率与反应底物浓度之间存在如下函数关系[15]:
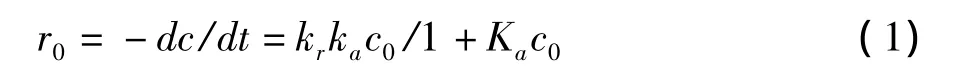
上式可以简化为表观一级反应动力学。不失一般性,亚甲基蓝光催化降解的动力学方程可用下式表示。
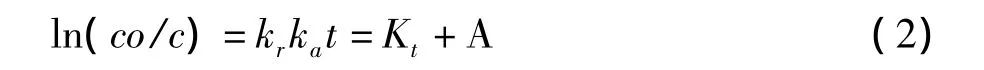
式中:r0—初始反应速率;kr—表面反应速率常数;ka—表面吸附平衡常数;K—表观反应速率常数,A—积分常数。
表1为甲硫氨基酸改性P25光催化剂的工艺参数和光解速率常数,由表1可以发现,700℃下煅烧2.0 h的甲硫氨基酸掺杂改性的P25光催化剂,具有最大的光解速率常数为0.2525 h-1。而600℃下煅烧得到的改性P25光催化剂光解速率常数最小,原因可能是600℃的煅烧温度不能促使甲硫氨基酸中的N或S元素具有足够进入P25晶格的能量,而此温度却使P25中的部分锐钛矿转变成了活性较低的金红石,造成了光解速率常数降低。
3 结论
以甲硫氨基酸为改性剂,通过研磨-煅烧的方法可实现P25光催化剂的S、N元素掺杂,从而使P25光催化剂在可见光范围具有光催化活性。对该催化剂可见光催化活性进行了评价,发现在可见光条件下,降解亚甲基蓝的实验结果表明700℃煅烧2 h得到的光催化剂的可见光活性最好,光降解3 h亚甲基蓝的降解率为54%。
[1]刘畅,暴宁钟,杨祝红,等.过渡金属离子掺杂改性TiO2的光催化性能研究进展[J].催化学报,2001,22(2):215-218.
[2]Asahi R,Morikawa T,Ohwaki T,et al.Visible - light photocatalysis in nitrogen - doped titanium oxides[J].Science,2001,293(5528):269-271.
[3]Ohno T,Mitsui T,Matsumura M.Photocatalytic activity of S -doped TiO2photocatalyst under visible light[J].Chemistry Letter,2003,32(4):364 -365.
[4]Chen D M,Yang D,Wang Q,Jiang Z Y.Effects of boron doping on photocatalytic activity and microstructure of titanium dioxide nanoparticles[J].Industry Engineering Chemistry Research,2006,45(12):4110 -4116.
[5]Wang P H,Yap P S,Lim T T.C - N - S tridoped TiO2for photocatalytic degradation of tetracycline under visible-light irradiation[J].Applied Catalysis A:General,2011,399(1 -2):252-261.
[6]Sun H,Bai Y,Cheng Y,et al.Preparation and characterization of visible-light-driven carbon sulfur-codoped TiO2photocatalysts[J].Industry Engineering Chemistry Research,2006,45(14):4971-4976.
[7]于占江,吴妮.S,N耦合掺杂TiO2柱撑蒙脱石催化剂制备[J].应用化工,2011,40(12):2129 -2137.
[8]Yu Z J.Visible light response TiO2pillared MMT porous photocatalyst[J].Journal of Shaanxi university of science & technology.2010,28(2):12 -16.
[9]Zhou M,Yu J.Preparation and enhanced daylight- induced photocatalytic activity of C,N,S - tridoped titanium dioxide powders[J].Journal of Hazardous Materials,2008,152(4):1229-1236.
[10]Ao Y,Xu J,Fu D,et al.Synthesis of C,N,S - tridoped mesoporous titania with enhanced visible light-induced photocatalytic activity[J].Microporous and Mesoporous Materials,2009,122(1 -3):1 -6.
[11]Khan SUM,Al- Shahry M,et al.Efficient photochemicalwater splitting by a chemically modified n - TiO2[J].Science,2002,297(2):243 -2245.
[12]孙鸣,于占江,张亚婷,等.P25光催化剂可见光化的改性研究[J].应用化工,2008(5):472-474.
[13]Melendres C A,Narayanasamy A,Maroni V A,et al.Raman spectroscopy of nanophase TiO2Source[J].Journal of Materials Research,1989,4(5):1246 -1250
[14]Wang Z P,Jun X U.Visible light induced photodegradation of organic pollutants on nitrogen and fluoride co-doped TiO2photocatalyst[J].Journal of Environmental Sciences,2005,17(1):76 -80
[15]赵正.N,S共掺杂纳米 P25光催化剂制备[J].重庆工学院学报(自然科学版),2009,23(6):120 -124
