痛宁胶囊对硝酸甘油型偏头痛大鼠下丘脑、脑干NOS和5-HT表达的影响
2012-11-01杨德功付秋菊黄厚才钟荣玲朱婉华田耀洲
杨德功, 付秋菊, 黄厚才, 钟荣玲, 朱婉华, 田耀洲
(1.江苏省中西医结合医院,江苏 南京 210028;2.南京中医药大学,江苏 南京 210046;3.南通良春风湿病医院,江苏 南通 226009)
痛宁胶囊是南通良春风湿病医院用于治疗偏头痛的院内制剂,其组方为孟河医派传人、国医大师朱良春教授经验名方,早在50年代即临床应用,疗效显著,随后于1963年发表于《中医杂志》,但其治疗偏头痛的机制仍不清楚,为此我们通过复制硝酸甘油型偏头痛动物模型,观察了痛宁胶囊对偏头痛大鼠下丘脑、脑干NOS及5-HT表达的影响,探讨痛宁胶囊治疗偏头痛的作用机制,为临床应用痛宁胶囊提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物与分组 SD大鼠48只,上海西普尔-必凯实验动物有限公司,许可证号:SCXK(沪)2008-0016,雌雄各半,体质量(283±23)g,随机分为空白对照组、模型组、阳性药物组、痛宁胶囊高、中、低剂量组,每组8只。
1.1.2 主要药物与试剂 痛宁胶囊,南通良春风湿病医院院内制剂,批准文号:苏药制字 Z04 001376;产品批号: 091208;硝酸甘油注射液,每1 mL含硝酸甘油5 mg,由北京益民药业有限公司生产,批准文号:国药准字H11020289,生产批号:20 100911;琥珀酸舒马普坦片,由天津华津制药有限公司生产,批准文号:国药准字 H20040700,生产批号:006909T,用蒸馏水配制成质量浓度为1 mg/mL的药液备用;兔抗 5-羟色胺抗体(Anti-5-HT),货号 bs-1126R;兔抗一氧化氮合成酶-1 抗体(神经型)(Anti-NOS-1),货号 bs-0156R,均购自北京博奥森生物技术有限公司;SABC免疫组化检测试剂盒,购自福建迈新生物技术开发公司;DAB购自美国Sigma公司;PBS缓冲液:南京医科大学实验室配制,每升中 含 8 g NaCl,0.2 g KCl,1.44 g Na2HPO4,0.24 g KH2PO4,pH调至7.4;其它试剂均为进口分装或国产分析纯。
1.2 方法
1.2.1 偏头痛模型建立及药物干预 根据Tassorelli C等[1]报道的方法,除空白对照组不作处理,其余各组动物予以大鼠皮下注射硝酸甘油10 mL/kg,制作偏头痛模型;30 min后按组灌胃给药。空白对照组和模型对照组灌胃等容积的蒸馏水,阳性药物对照组灌胃琥珀酸舒马普坦药液6 mL/kg,痛宁胶囊药液高、中、低剂量组分别以 8.64、4.32、2.16 g/kg药液灌胃。
1.2.2 灌注、取材、切片 造模后4 h,立即用10%水合氯醛300 mg/kg腹腔麻醉动物,仰卧固定,开胸,主动脉插管,剪开右心耳。首先迅速灌注无菌生理盐水200 mL,然后灌注4℃4%多聚甲醛磷酸盐缓冲液150 mL,灌注后取大鼠脑组织,在4%多聚甲醛磷酸盐缓冲液中再固定24 h,常规脱水,石蜡包埋。制备下丘脑、脑干石蜡切片。
1.2.3 免疫组化SABC法 石蜡切片常规脱蜡至水;PBS洗2遍,每遍5 min;切片浸入3%H2O2水溶液中,室温封闭10 min,以去除内源性过氧化物酶;PBS洗3遍,每遍5 min;抗原微波修复20 min;PBS洗2遍,每遍5 min;滴加正常山羊血清封闭液,室温20 min。甩去多余液体;滴加一抗,4℃过夜;PBS洗2遍,每遍5 min;滴加生物素化二抗,37℃孵育30 min;PBS洗2遍,每遍5 min;滴加试剂SABC,37℃孵育20 min;PBS洗3遍,每遍5 min;滴加0.05%DAB+0.01%H2O2,显色5~15 min;显微镜下随时观察显色反应,至阳性显色较强而背景不显色时,自来水洗,终止显色反应;苏木素衬染、透明,中性树胶封片。
1.2.4 图片分析 光镜下细胞核呈棕黄色染色者为阳性细胞。用显微镜照相系统和数码成像系统进行拍摄200倍图片,用Image ProPlus5.0.2图像分析软件测定各组每张切片上阳性细胞的平均面积。
2 结果
大鼠下丘脑、脑干经免疫组化SABC法染色后,光镜下背景为淡黄色,NOS、5-HT阳性细胞均呈棕黄色或棕褐色,多散在分布(见图1~16中红色箭头所示)。经数码成像系统和图像分析软件,得如下结果。
2.1 各组大鼠下丘脑、脑干NOS阳性细胞平均面积的比较 下丘脑:与空白对照组比较,模型对照组NOS阳性细胞平均面积显著增加,差异具有统计学意义(P<0.01)。与模型对照组比较,阳性药物对照组、痛宁胶囊高剂量组、中剂量组NOS阳性细胞平均面积均有不同程度减少,差异具有统计学意义(P<0.05或P<0.01),而低剂量差异无统计学意义。高、中剂量组分别与阳性药物对照组比较,统计学无显著性差异(P>0.05)。脑干:与空白对照组比较,模型对照组NOS阳性细胞平均面积明显增加,差异具有统计学意义(P<0.01)。与模型对照组比较,阳性药物对照组、高剂量组NOS阳性细胞平均面积均有不同程度减少,差异具有统计学意义(P<0.05),而中、低剂量组差异均无统计学意义。高剂量组与阳性药物对照组均能明显减少NOS阳性细胞平均面积,二者比较统计学无显著性差异(P>0.05)。见表1,图1~8。
表1 痛宁胶囊对硝酸甘油型偏头痛模型大鼠脑组织中NOS表达阳性细胞平均面积的影响()

表1 痛宁胶囊对硝酸甘油型偏头痛模型大鼠脑组织中NOS表达阳性细胞平均面积的影响()
注:与空白对照组比较,*P<0.05;**P<0.01;与模型对照组比较,△P<0.05;△△P<0.01;与阳性药物对照组比较,▲P>0.05。下同。
组别 动物/只剂量/(g·kg - 1)NOS平均面积/μm 2下丘脑 脑干空白对照 8 —221.35±67.68 243.10±53.81模型对照 8 — 317.52±60.34** 354.29±80.96**琥珀酸舒马普坦 8 0.006 236.67±34.05△△ 275.05±52.06△痛宁胶囊 8 8.64 232.06±34.44△△▲ 257.52±72.73△▲痛宁胶囊 8 4.32 249.39±43.06△▲ 264.997±88.60痛宁胶囊8 2.16 288.13±66.25 297.64±91.96
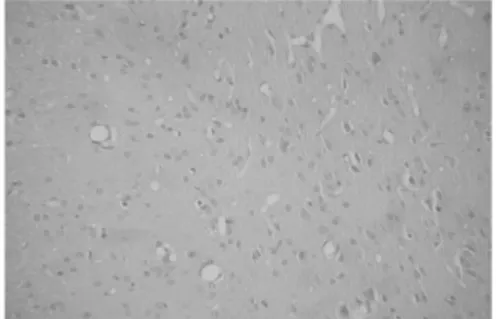
图1 偏头痛动物模型空白组下丘脑NOS阳性细胞 (×200)

图2 偏头痛动物模型模型组下丘脑NOS阳性细胞 (×200)

图3 偏头痛动物模型阳性药物组下丘脑NOS阳性细胞 (×200)

图4 偏头痛动物模型痛宁胶囊高剂量组下丘脑NOS阳性细胞(×200)
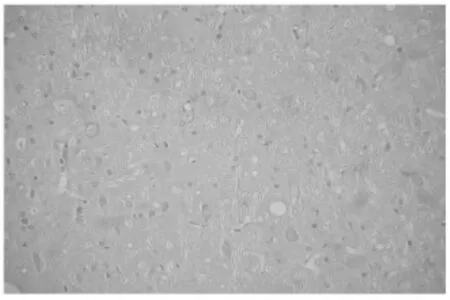
图5 偏头痛动物模型空白组脑干NOS阳性细胞 (×200)
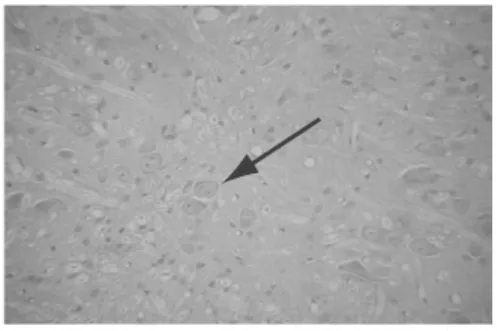
图6 偏头痛动物模型模型组脑干NOS阳性细胞 (×200)
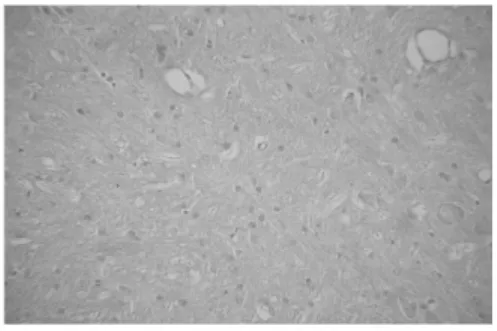
图7 偏头痛动物模型阳性药物组脑干NOS阳性细胞(×200)
图8 偏头痛动物模型痛宁胶囊高剂量组脑干NOS阳性细胞(×200)
2.2 各组大鼠下丘脑、脑干5-HT阳性细胞平均面积的比较下丘脑:与空白对照组比较,模型对照组5-HT阳性细胞平均面积显著减少,差异具有统计学意义(P<0.01)。与模型对照组比较,阳性药物对照组、高、中剂量组5-HT阳性细胞平均面积均有不同程度增加,差异具有统计学意义(P<0.05或P<0.01),而低剂量组差异无统计学意义。高剂量组、中剂量组分别与阳性药物对照组比较,统计学无显著性差异(P>0.05)。脑干:与空白对照组比较,模型对照组5-HT阳性细胞平均面积显著减少,差异具有统计学意义(P<0.05)。与模型对照组比较,阳性药物对照组、高剂量组5-HT阳性细胞平均面积均有不同程度增加,差异具有统计学意义(P<0.05),而中、低剂量组差异均无统计学意义。高剂量组与阳性药物对照组均能显著增加5-HT阳性细胞平均面积,二者比较统计学无显著性差异(P>0.05)。见表2,图9~16。
表2 痛宁胶囊对硝酸甘油型偏头痛模型大鼠脑组织中5-HT表达阳性细胞平均面积的影响 ()

表2 痛宁胶囊对硝酸甘油型偏头痛模型大鼠脑组织中5-HT表达阳性细胞平均面积的影响 ()
组别 动物/只剂量/(g·kg - 1)5-HT 平均面积/μm 2下丘脑 脑干空白对照 8 —442.62±90.87 378.31±99.00模型对照 8 — 221.24±50.42** 262.32±59.61*琥珀酸舒马普坦 8 0.006 343.55±56.54△△ 322.31±30.31△痛宁胶囊 8 8.64 381.24±36.15△△▲ 324.16±49.26△▲痛宁胶囊 8 4.32 312.03±85.65△▲ 299.83±54.91痛宁胶囊8 2.16 252.17±53.35 243.88±45.65
图10 偏头痛动物模型模型组下丘脑5-HT阳性细胞(×200)
图11 偏头痛动物模型阳性药物组下丘脑5-HT阳性细胞 (×200)
图12 偏头痛动物模型痛宁胶囊高剂量组下丘脑5-HT阳性细胞 (×200)

图13 偏头痛动物模型空白组脑干5-HT阳性细胞 (×200)

图14 偏头痛动物模型模型组脑干5-HT阳性细胞 (×200)
图15 偏头痛动物模型阳性药物组脑干5-HT阳性细胞 (×200)
图16 偏头痛动物模型痛宁胶囊高剂量组脑干5-HT阳性细胞(×200)
3 讨论
许多实验和临床研究表明,NO在偏头痛和其他血管性头痛的产生机制中起着十分关键的作用[2]。其可通过扩张血管,引发神经源性炎症,激活伤害感觉神经元的敏感性,介导机体内痛觉信号的传导,从而放大其生物学作用,致使痛觉的发生[3]。而NOS是合成NO的关键酶,可催化左旋精氨酸(L-Arg)生成瓜氨酸的同时释放出内源性NO,前者NOS活性的增高与痛敏状态的维持有密切关系[4],且NOS阳性神经元可能通过单突触或多突触连接引起自主神经核运动核激活,参与偏头痛的伴发症状如恶心、呕吐等[5]。而后者可能协同其它神经递质在疼痛刺激的中枢传递中起重要作用,不但可以激发偏头痛,而且能够维持偏头痛状态[6]。
实验中,予以皮下注射硝酸甘油后,大鼠下丘脑、脑干部位NOS表达增强,说明硝酸甘油能够诱发NOS表达,NO合成增加,而进一步参与组织的发生免疫应答和炎症反应,而予以痛宁胶囊干预后能够显著降低其表达,表明痛宁胶囊能够阻止由硝酸甘油诱发的NOS的反应,减少内源性NO的生成。
研究发现,下丘脑中含有多种 5-HT 的受体的亚型[7-8],而不同类型5-HT受体在痛觉生理和病理生理中有不同的作用,在偏头痛的发病机制中更是复杂。5-HT2A受体激动能够引起NO的生成增加,从而引起颅脑血管的扩张,致敏血管周围疼痛感受器和三叉神经血管系统中枢伤害性感受神经元,触发头痛[9]。5-HT1B/1D受体激动剂,如舒马普坦、佐米曲坦等能够选择性作用于血管平滑肌,使扩张的颅内动脉(主要是硬脑膜动脉)收缩,通过减少血管活性肽如降钙素基因相关肽(CGRP)在血管周围间隙的释放,能减轻神经源性炎症,且对脑干及上部颈髓的三叉神经尾侧核的伤害性痛觉传递有抑制作用,还能调整一氧化氮信号转导通路以及钠离子依赖性细胞代谢活动[10]。形态学研究证明5-HT1FmRNA在三叉神经节有较高分布,选择性的 5-HT1F受体激动剂lasmiditan可抑制电刺激三叉神经节诱导的硬脑膜血浆蛋白的外渗及三叉神经尾侧c-fos的表达[11],并且能够有效治疗偏头痛的急性发作[12],提示对于偏头痛急性发作,5-HT1F受体的激动是一种可能的新的治疗原则[13]。
本实验发现,硝酸甘油诱导的偏头痛大鼠脑干、下丘脑5-HT表达水平下降,而予以痛宁胶囊进行干预后,5-HT的表达水平上调,这可能是痛宁胶囊激动下丘脑部位5-HT受体亚型,使得伤害性痛觉上行传导抑制;并且刺激脑干的5-HT能神经元,激活5-HT疼痛下行调控系统。
综上所述,痛宁胶囊能够通过降低NOS的表达、上调5-HT的水平,从而调整与疼痛相关的血管活性物质及神经递质的水平,改善血管舒缩功能障碍,这可能是其治疗偏头痛的作用机制之一。
[1]Tassorelli C,Joseph S A.Systemic nitroglycerin induces Fos immunoreactivity in brainstem and forebrain structures of the rat[J].Brain Res,1995,682(1-2):167-181.
[2]Olescn J,Thomsen L L,Iversen H.Nitric oxide is a key molecule in migraine and other vascular headaches[J].Trends Pharmaeol Sci,1994,15(5):149-153.
[3]赵永烈,王玉来,高 颖,等.一氧化氮在偏头痛发病中的作用[J].中国临床康复,2006,10(7):138-139.
[4]阎雪彬,黄晓玲,黄 东.NMDA受体和NOS参与骨癌痛小鼠吗啡耐受的形成[J].中南大学学报:医学版,2010,35(5):458-463.
[5]王贺波,王建华,郭宗成,等.L-NAME减少三叉神经脊束核尾侧段和上颈髓后角c-fos和nNOS的表达[J].脑与神经疾病杂志,2008,16(4):425-427.
[6]Jansen-Olesen I, Zhou M, Zinck T, et al.Expression of inducible nitric oxide synthase in trigeminal ganglion cells during culture[J].Basic Clin Pharmacol Toxicol,2005,97(6):355-363.
[7]Hannon J,Hoyer D.Molecular biology of 5-HT receptors[J].Behav Brain Res,2008,195(1):198-213.
[8]Filip M,Bader M.Overview on 5-HT receptors and their role in physiology and pathology of the central nervous system[J].Pharmacol Rep,2009,61(5):761-777.
[9]Srikiatkhachorn A,Suwattanasophon C,Ruangpattanatawee U,et al.5-HT2Areceptor activation and nitric oxide synthesis:a possible mechanism determining migraine attacks[J].Headache,2002,42(7):566-574.
[10]Tepper S J,Rapoport A M,Sheftell F D.Mechanisms of action of the 5-HT1B/1D,receptor agonists[J].Arch Neurol,2002,59(7):1084-1088.
[11]Nelson D L,Phebus L A,Johnson K W,et al.Preclinical pharmacological profile of the selective 5-HT1Freceptor agonist lasmiditan[J].Cephalalgia,2010,30(10):1159-1169.
[12]Ferrari M D,Färkkilä M F,Reuter U,et al.Acute treatment of migraine with the selective 5-HT1Freceptor agonist lasmiditan-A randomised proof-of-concept trial[J].Cephalalgia,2010,30(10):1170-1178.
[13]Olesen J.5-Hydroxyptryptamine 1F(5-HT1F)receptor agonism.A possible new treatment principle for acute migraine attacks[J].Cephalalgia,2010,30(10):1157-1158.
