甲强龙调控CD4+CD25+Treg对狼疮肾炎治疗作用的研究
2012-10-31邵丽媛刘丽华杨青卢雪红于宏宇
邵丽媛 刘丽华 杨青 卢雪红 于宏宇
近年来发现CD4+CD25+调节性T细胞(Treg)在维持免疫耐受中发挥重要的作用,通过甲强龙治疗狼疮肾炎模型,观察狼疮肾炎小鼠狼疮症状、Treg数量和功能基因的变化,阐明中枢和外周耐受机制的异常如何参与狼疮肾炎的发生,从而为狼疮肾炎治疗寻找新的靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 6周龄(BALB/C×C57BL/6)F1(H-2d/b)代杂交鼠18只(雌性9只,雄性9只)体重(18±2)g,随机分为模型组12只和对照组6只(每组雌雄各半)。
1.1.2 试剂及仪器 FITC标记山羊抗小鼠IgG为北京中杉金桥生物技术有限公司产品。抗核抗体试剂盒为德国欧蒙公司产品。尿蛋白试纸为广州市花都高尔宝生物技术有限公司产品。FITC标记的抗小鼠CD25单克隆抗体 mAb(FITC-抗CD25 mAb)及PE标记的抗小鼠CD4 mAb(PE-抗CD4 mAb)为英国B.D.公司产品。流式细胞仪(FACSCalibur)为美国BECTON DICKINSON产品。
1.2 方法
1.2.1 小鼠模型的建立 采用慢性移植物抗宿主病(cGVHD)的方法[1]诱导狼疮肾炎小鼠模型。免疫4周后模型成功,末次免疫2周后模型组分为未治疗组和激素治疗组(每组6只,雌雄各半),治疗组每日腹腔注射甲强龙(40 mg/kg),未治疗组及对照组给予相应的生理盐水,疗程8周。
1.2.2 Treg数量的检测 胸腺、脾脏组织制备细胞悬液,取1×106个细胞用200μL的 PBS混悬,加 2μL FITC-抗 CD25 mAb和5μL PE-抗 CD4 mAb,置冰浴中 30 min,以 PBS 洗 1次。经500μL 20 g/L多聚甲醛固定后,用流式细胞仪检测。
1.2.3 Treg功能基因的检测 cDNA的逆转录采用Takara的AMV RTase,按说明书进行操作。PCR引物名称、序列、产物大小见表1。
1.2.4 尿蛋白的检测 用尿蛋白试纸蘸取小鼠尿液,与标准尿液分析试纸条的颜色进行比较,结果以“-”“+﹑++﹑+++﹑++++”表示。
1.2.5 抗核抗体的检测 采用间接免疫荧光法:按试剂盒说明操作,荧光二抗为FITC标记山羊抗小鼠IgG,荧光显微镜下观察结果。
1.2.6 小鼠肾脏病理 小鼠脱臼处死,取肾脏,留取部分新鲜组织冰冻切片,采用直接免疫荧光法检测肾脏免疫复合物。另外留取肾皮质,用100 ml/L甲醛固定后,按常规进行HE、PAS、PAM、Masson染色,显微镜下观察结果。
2 结果
2.1 一般情况 模型组小鼠末次免疫3周后逐渐出现脱毛,尿蛋白增多,并且尿蛋白逐渐增多,从末次诱导到3个月时模型未治疗组++(2只),+++(4只),模型治疗组+(3只),±(3只);而对照组为±(2只),-(4只)。
2.2 血清抗核抗体(ANA) 结果显示对照组均为阴性;模型未治疗组ANA滴度为1:640(2只),1:1000(4只),模型治疗组ANA滴度为1:100(3只),1:320(3只),见图1。
2.3 小鼠肾脏病理变化 免疫荧光结果:对照组均为阴性,模型未治疗组肾小球血管袢和系膜区有IgG沉积,模型治疗组荧光减弱,见图2。光镜下对照组小鼠肾脏病理正常,模型治疗组较模型未治疗组病理明显减轻。
2.4 各组小鼠胸腺、脾脏中CD4+CD25+Tr/CD4+T的变化见表2。
2.5 各组小鼠胸腺、脾脏中CD4+CD25+Tr功能基因的变化见表3。

图1 各组小鼠ANA的变化

图2 各组小鼠肾脏免疫荧光的变化

表1 β-actin,CTLA-4,Foxp3引物序列

表2 各组CD4+CD25+Tr/CD4+T的变化
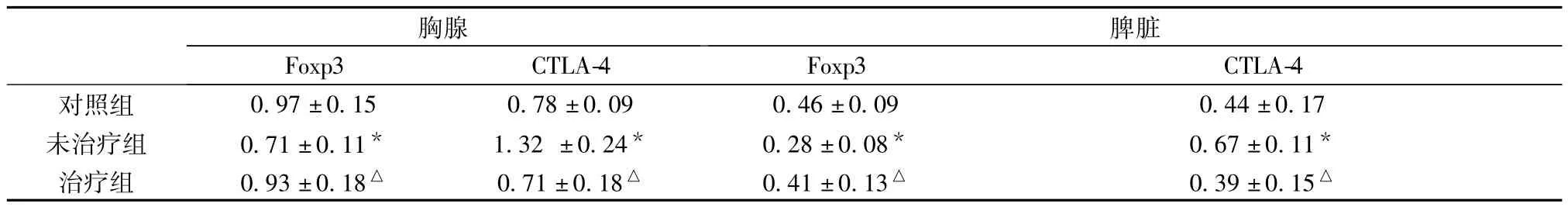
表3 各组小鼠CD4+CD25+Tr 功能基因的变化
3 讨论
系统性红斑狼疮(SLE)是一种常见多因性自身免疫病,病因和发病机制尚未完全阐明。我们采用亲代BALB/c小鼠淋巴细胞输入(C57BL/6×BALB/c)F1代小鼠产生了cGVHD,表现为脱毛,蛋白尿等症状,免疫学异常表现为血清中高滴度的抗核抗体,肾脏可见免疫复合物沉积。我们实验结果和文献报道一致,表明本实验所用的cGVHD诱导狼疮样小鼠的方法是可行的,并且狼疮样小鼠全部处于发病状态。
近年来发现的Treg具有免疫抑制作用,能抑制多种自身免疫病的发生,包括Ⅰ型糖尿病[2]、实验性过敏性脑脊髓炎、炎性肠病等。但Treg在炎症性自身免疫病(包括SLE等)中的作用还存在争议。本研究的结果显示cGVHD小鼠胸腺、脾脏中的Treg在数量上无明显差别。
Foxp3 是 CD4+CD25+Tr[3]发育和行使功能的必需转录因子,除Foxp3外,Treg表面表达一种重要的膜分子:细胞毒性T淋巴细胞相关抗原4(CTLA-4,CD152)。CTLA-4是淋巴细胞表面的一种与免疫信号传递有关的配体蛋白分子[4],它属于免疫球蛋白超家族成员,为Ⅰ型膜蛋白分子。CTLA-4与B7结合后,负调节T细胞的活化,可减缓细胞周期的进程,降低IL-2的产生,使T细胞活化增殖受到抑制,从而使免疫达到平衡状态,保持外周的免疫平衡。我们的实验结果显示cGVHD小鼠糖皮质激素治疗后SLE模型鼠中枢外周耐受异常有明显的恢复,胸腺和脾脏Treg产生数量虽无增加但功能基因Foxp3增强可能为SLE全身症状和脏器损伤恢复(肾脏好转)的原因之一。激素治疗后Treg的功能增强,而T细胞活化基因CTLA-4明显受抑制,由此可见提升Treg功能而抑制T细胞活化,可能为狼疮性肾炎新的治疗靶点。
[1] 卢雪红,彭歆,李一,等.慢性移植物抗宿主病狼疮小鼠模型的建立和淋巴细胞功能的变化.中国中西医结合肾病杂志,2008,12(9):1047-1049.
[2] Kukreja A,CostG,Marker J,et al.Multiple immuno-regulatory defects in type1 diabetes.J Clin Invest,2002,109(1):131-140.
[3] Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25):breakdown of a single mechanism of self-tolerance causes various autoimmune diseases.J Immunol,1995,155:1151-1164.
[4] David MS,Lucy SK,Walke R.The role of CD28 and cytotoxic T lymphocyte antigen(CTLA-4)in regulatory T cell biology.J Immunol Rev,2006,21(2):131-148.
