构建人Cu,Zn-SOD毕赤酵母转化子及其高表达研究
2012-10-28迟春萍时成波曹玉锋陈子杨张健锋王小杰田海山李校堃
迟春萍,时成波,曹玉锋,陈子杨,徐 军,张健锋,贾 媛,李 铮,王小杰,牛 灵,田海山,孙 彪,李校堃,*
(1.吉林农业大学生命科学学院,吉林 长春 130118;2.长春生物制品研究所,吉林 长春 130062;3.中国科学院 微生物研究所,北京 100080;4.四平华科生物技术有限责任公司,吉林 四平 136000)
构建人Cu,Zn-SOD毕赤酵母转化子及其高表达研究
迟春萍1,2,时成波2,曹玉锋2,陈子杨2,徐 军2,张健锋2,贾 媛2,李 铮2,王小杰1,牛 灵3,田海山1,孙 彪4,李校堃1,*
(1.吉林农业大学生命科学学院,吉林 长春 130118;2.长春生物制品研究所,吉林 长春 130062;3.中国科学院 微生物研究所,北京 100080;4.四平华科生物技术有限责任公司,吉林 四平 136000)
设计人Cu,Zn-SOD酵母偏爱密码子并化学合成,与pPIC9K连接,构建酵母偏爱密码子的人Cu,Zn-SOD基因真核表达载体,通过电转化和持续加压筛选毕赤酵母GS115高拷贝转化子,获得的重组高表达酵母菌株建立主种子批。经Southern blot鉴定,基因拷贝数提高2~8倍,活性检测显示提高2~4倍。重组菌的目的基因拷贝数与表达产物呈正相关;表达产物为二聚体,其分子质量为40kD左右,低糖基化,均为分泌表达。Western blot法分析,对Cu,Zn-SOD抗体具有特异性反应。转化子在培养16h后进入对数生长期,24h后进入生长稳定期;转化子培养20h左右进行诱导表达最为合适。高拷贝的3株重组菌经50次传代后插入的目的基因保持稳定;Cu,Zn-SOD转化子用正交试验筛选摇瓶的诱导表达条件,经诱导表达,Cu,Zn-SOD表达上清最高活性大于600U/mL。确立最适摇瓶培养条件为pH6.0、30℃、体积分数1.5%甲醇诱导72h测得上清的目的蛋白表达最好,表明构建了高表达菌株。
毕赤酵母GS115;Cu,Zn-SOD;电转化法;高拷贝;真核表达
自1969年,美国科学家McCord和Fridivich从牛血中发现并提取出具有防病、抗衰、提高免疫力以及美容功能的超氧化物歧化酶(superoxide dismutase,SOD)[1]。目前生产SOD有3种方法[2]:动物血提取、各种植物提取、基因工程菌中提取。由于动物源的SOD难以清除各种病毒,欧洲已从1999年颁布禁令:禁止动物血SOD用于人类。植物源的SOD同样存在外源污染、蛋白种属差异、免疫排斥、过敏反应等问题。国际SOD的最新发展是用基因重组法生产rhSOD,这是SOD领域的世界前沿技术。应用基因工程方法提取的SOD,不涉及有机溶剂处理,故产品无任何有机试剂残留,具有无外源性污染、无病毒残存、无蛋白种属差异、无免疫排斥、无过敏反应,从根本上解决了人类使用SOD的安全问题[3-4]。
本实验室人工合成出毕赤酵母偏爱的人铜锌超氧化物歧化酶(Cu,Zn-SOD)基因,通过电转化后采取G418加压筛选方法,先后构建4株转化子并进行表达分析比较。高拷贝转化子建立的主种子批为rhSOD的中试工艺提供参考。
1 材料与方法
1.1 菌株及试剂
毕赤酵母GS115、大肠杆菌(DH5α)由本实验室保存。
Cu,Zn-SOD单抗 本实验室制备;限制性内切酶Sal I、SnaB I和Not I及T4连接酶 英国Bio Labs公司;引物 紫金公司合成;DNA质粒提取试剂盒、DNA MarkerDL2000、G418活性检测试剂盒等 宝生物工程(大连)有限公司。
1.2 仪器与设备
JS-680B型凝胶成像系统 上海培清科技有限公司;PTC-1196型PCR扩增仪 美国MJ Research公司;TGL-16G高速台式离心机 上海医用分析仪器厂;V-2102PC型紫外-可见分光光度计 上海Unico公司;PHS-3C酸度计 上海精密科学仪器有限公司;CS-930薄层扫描仪日本岛津公司;蛋白电泳仪、电转仪及斑点杂交加样器美国Bio Rad公司。
1.3 培养基
YPD培养基(g/L):酵母提取物10、蛋白胨20、氯化钠0.5、琼脂粉15,葡萄糖2mmol/L,蒸馏水1000mL;BMGY培养基(g/L):酵母粉10、蛋白胨20、葡萄糖20、酵母含氮碱基1.34、生物素0.04、甘油10,磷酸盐缓冲液10mmol/L (pH6.0),蒸馏水1000mL;BMMY培养基(g/L):酵母提取物10、蛋白胨20、硫酸铜0.08、硫酸锌0.0016、葡萄糖20、酵母含氮碱基1.34、生物素0.04、甘油10,磷酸盐缓冲液10mmol/L (pH6.0),甲醇1.5%,蒸馏水1000mL。
1.4 构建pPIC9K/Cu,Zn-SOD载体
选定NCBI中的Cu,Zn-SOD 465个基因并将其密码子更换为酵母偏爱的密码子,两端加入SnaB I和Not I两个酶切位点并化学合成之。目的基因与pPIC9K用T4连接酶连接,pPIC9K/Cu, Zn-SOD用BglⅡ线性化后转化至DH5α中。
1.5 构建GS115/Cu,Zn-SOD、pPIC9K转化子
将DH5α/pPIC9K/Cu,Zn-SOD及DH5α/pPIC9K挑单颗,接种于LB培养基中,37℃培养过夜,提取质粒并并纯化后用BglⅡ线性化,以25μF电容,200Ω电阻选用1.5、1.8kV及2.2kV 3种电压电转化至感受态毕赤酵母GS115细胞,观察各组电转参数转化效率。阳性转化子用PCR筛选鉴定,设计引物序列为:AOX1上游引物:5'-GACTGGTTCCAATTGACAAGC-3',AOX1下游引物:5'-GCAAATGGCATTCTGACATCC-3'。
1.6 高拷贝GS115/Cu,Zn-SOD转化子的筛选
用最佳电转参数电穿孔转化GS115菌株,将得到的1136个菌落依次接种在0.3~4.0mg/mL不同G418质量浓度的YPD平板上。在耐受高质量浓度G418筛选阳性高拷贝转化子。
1.7 Southern blot法检测转化子拷贝数量
制备杂交探针[5]:PCR扩增重组菌SOD基因,扩增的产物回收纯化,纯化产物依DIG试剂盒进行DIG随机引物法标记。
Southern blot[5]:以相同OD600nm值培养液等体积提取4株阳性转化子基因组DNA为模板,等量点于硝酸纤维素膜上,烤干后进行杂交显色,实验重复2次。
1.8 目的基因在转化子中的传代稳定性检测
将1#、2#、3#3株转化子在YPD平板上传50代,提取基因组DNA,PCR鉴定目的基因。
1.9 重组酵母菌株生长曲线的测定
阳性转化子按1:100的接种量接种菌液到BMGY培养基中,30℃培养,每2h测定菌体密度,以OD600nm值对时间作图,绘制重组酵母菌株GS115/pPIC9K-SOD的生长曲线。
1.10 重组酵母菌株诱导表达及产物分析
挑GS115/pPIC9K、GS115空白菌及重组酵母菌到5mL BMGY培养基中,OD600nm值约6左右转入BMMY培养基,30℃摇床培养,每24h补加100%甲醇使其终体积分数为1%。在不同时间点收集离心沉淀和上清,上清液用活性检测试剂盒检测活性,表达120h后上清20倍浓缩,非变性及变性电泳检测表达产物,用Cu,Zn-SOD单克隆抗体进行Western blot分析,考马斯亮蓝法测定培养上清的蛋白含量[6]。
1.11 重组酵母菌株摇床表达条件的优化
挑GS115/pPIC9K-Cu,Zn-SOD转化子的单菌落至10mL YPD培养基,30℃培养过夜,当OD600nm值达6时按1%接种量接种于装有100mL BMGY培养基的500mL三角烧瓶中,30℃继续培养,18h后离心转至同体积的不同pH值的BMMY诱导表达培养基中,用不同温度进行诱导表达,分别在每24h留样检测并添加甲醇至不同终浓度。用试剂盒检测rhCu,Zn-SOD活性及考马斯亮蓝检测蛋白含量,在预实验基础上,按四因素三水平正交设计进行试验,每组重复3次,见表1。
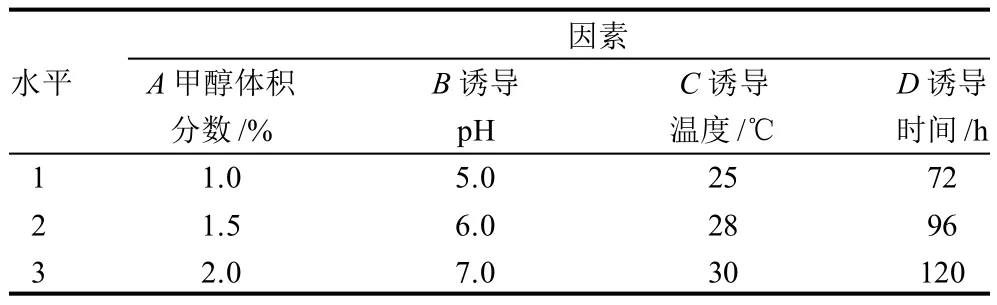
表1 Cu,Zn-SOD酵母转化子诱导表达正交试验设计Table 1 Factors and levels of orthogonal test for technological optimization of rhCu,Zn-SOD expression in GS115/pPIC9K-SOD
1.12 诱导表达4株重组SOD酵母菌
用最适诱导表达条件,即30℃摇床培养,培养基pH6.0,每24h补加100%甲醇稀释至1.5%甲醇,用活性检测试剂盒检测表达上清的活性,电泳法及考马斯亮蓝法检测上清的蛋白表达量。
2 结果与分析
2.1 构建pPIC9K/Cu,Zn-SOD载体

图1 pPIC9K/Cu,Zn-SOD载体构建图谱Fig.1 Construction of pPIC9K/Cu,Zn-SOD vector
如图1所示,465bp的Cu,Zn-SOD与9276bp的pPIC9K链接后,构建长度为9741bp的pPIC9K/Cu,Zn-SOD。

图2 pPIC9K/SOD酶切鉴定结果Fig.2 Identification of pPIC9K/SOD by restriction enzyme
由图2可知,pPIC9K/Cu, Zn-SOD质粒经SnaB I和Not I双酶切后电泳观察到9.3kb和0.45kb两个特异性条带,与预期片段长度一致,表明Cu,Zn-SOD表达载体构建成功。
2.2 电转化法转化酵母细胞的转化效率
电转时电压和电阻的设置对电转化效果的影响很大,所以优化电转参数可以提高转化效率,采用3组(第一组:25μF电容;200Ω电阻1.5kV电压;第二组:25μF电容;200Ω电阻1.8kV电压;第三组:25μF电容;200Ω电阻2.2kV电压)电转参数。从图3可知,转化效率随电压的递增而增加。

图3 3组电转参数转化酵母细胞的转化效率Fig.3 Pichia pastoris transformation efficiency of under three different electrical voltages
2.3 GS115/Cu,Zn-SOD转化子的构建及检定
以酵母的染色体作为模板,以Pichia pastoris外源基因插入部位两端的序列3'-AOX1和5'-AOX1为上下游引物,进行PCR扩增分析,PCR产物电泳结果如图4所示,转染了pPIC9K-SOD的酵母基因组染色体进行PCR扩增,在约1 0 0 0 b p左右处出现条带,与预期一致(465bp+492bp),转染了空质粒pPIC9K的酵母基因组染色体PCR扩增,作为对照,在约500bp处出现明亮的条带,与设计492bp大小一致。空质粒pPIC9K酵母PCR扩增,未见基因条带,说明实验方法成立,目的基因SOD已整合到了酵母染色体上。先后成功构建4株转化子,分别命名为0#、1#、2#、3#。

图4 pPIC9K/SOD的PCR鉴定结果Fig.4 Identification of rhCu,Zn-SOD gene in genomic DNA of recombinant yeast by PCR
2.4 转化子拷贝数检测
两次基因杂交结果经凝胶成像分析(图5)显示:1#、2#、3#菌株的目的基因拷贝数分别约为0#菌株的2、8倍和6倍。

图5 重组酵母菌株的基因杂交图谱Fig.5 Determination of rhCu,Zn-SOD gene copy number in recombinant yeast by Southern blot
2.5 转化子传代后的基因稳定性检测

图6 PCR鉴定重组酵母菌株Fig.6 Identification of rhCu,Zn-SOD gene in genomic DNA of recombinant yeast after passages
将1#、2#、3#阳性转化子的基因组DNA,用转染空质粒pPIC9K作为对照。结果如图6所示,3株转化子菌株的基因组在传代前及传代后均能扩增出大小为957bp的片段,转染的空质粒pPIC9K扩增出大小为492bp的基因片段。说明pPIC9K-SOD已经稳定整合到酵母基因组中。将该3株菌株(1#、2#、3#)冻干保存,建立中试用主种子批。
2.6 重组酵母菌株生长曲线的测定
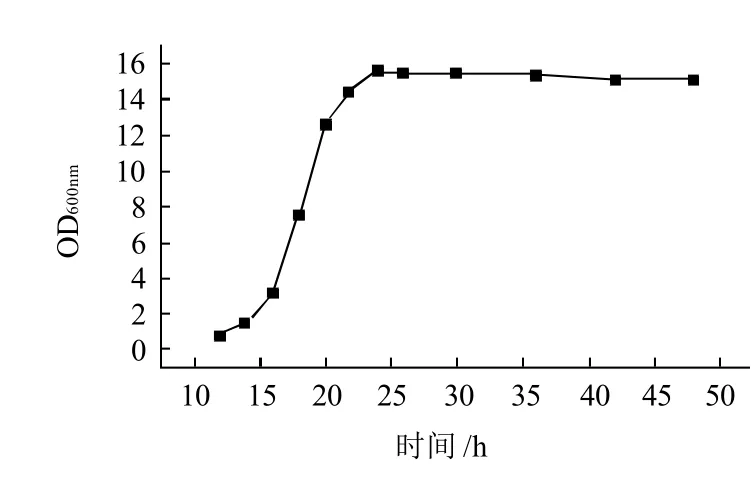
图7 GS115/pPIC9K-SOD生长曲线Fig.7 The growth curve of recombinant yeast
如图7所示,重组菌株在培养16h后进入对数生长期,24h后进入生长稳定期。重组菌株在培养20h左右进行诱导表达最为适宜。
2.7 重组酵母菌株诱导表达产物的分析

图8 重组酵母菌株诱导表达产物的免疫印迹Fig.8 SDS-PAGE analysis of recombinant rhCu,Zn-SOD protein
重组酵母菌株诱导表达非变性电泳结果如图8a所示,第1,泳道在40kD处可见明显目的蛋白带,用薄层扫描仪分析样品中目的蛋白含量占总蛋白的48.2%,活性为523U/mL,蛋白含量为102μg/mL,变性电泳(图8b)可见目的蛋白约为20kD,比理论值(16kD)高些,应为低糖基化的表达蛋白,1~4泳道变性电泳显示转染pPIC9K及pPIC9K-Cu,Zu-SOD的重组酵母菌细胞中未见分子质量20kD的蛋白带,转染pPIC9K酵母菌及空菌的诱导表达上清也未见2 0 k D的蛋白带,只能转染了pPIC9K-Cu,Zu-SOD重组酵母菌诱导表达上清可见20kD的目的蛋白带,表明该构建的转化子成功实现了分泌表达。Western blot分析表达上清,可见有特异性性反应条带。
2.8 重组酵母菌株表达条件的优化结果
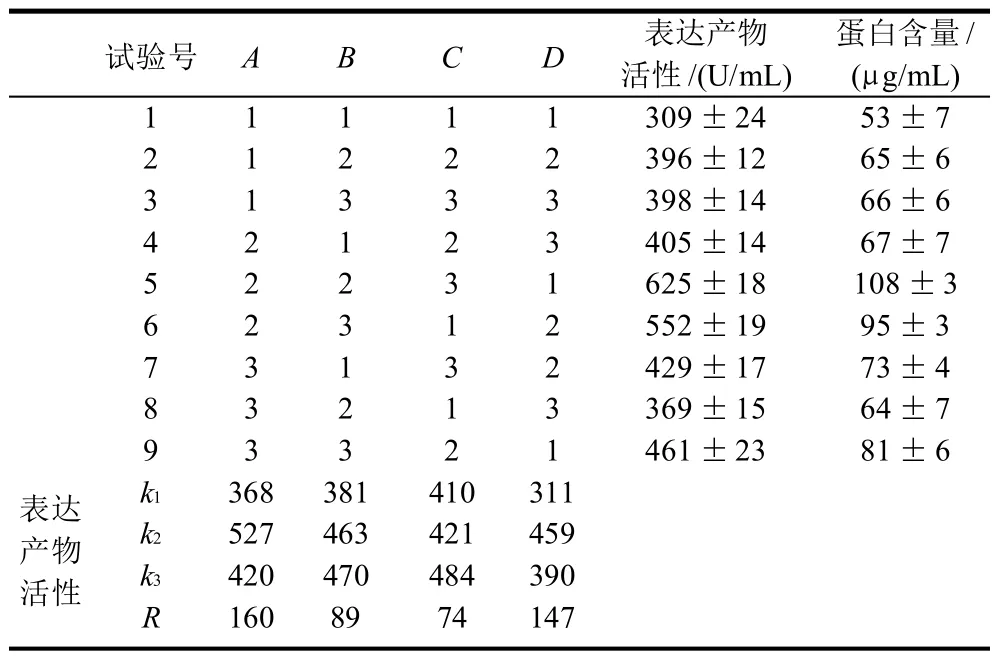
表2 重组酵母菌株表达条件的正交试验结果Table 2 Results of orthogonal test
表2直观分析可见,第5号试验组条件下测得的蛋白表达量及蛋白活性最高,即重组毕赤酵母GS115/Cu,Zn-SOD在诱导温度为30℃,pH6.0并用1.5%甲醇诱导条件下诱导72h得到的结果优于其他8个试验号,所以最佳因素组合为A2B2C3D1。由极差可知,影响重组菌株表达条件的因素顺序为A>D>B>C,甲醇的诱导体积分数影响因素最大,这也印证了甲醇是AOX1启动子的诱导表达的重要因素,即在没有甘油等碳源的情况下,酵母因有AOX1启动子而启动甲醇代谢途径。
2.9 诱导表达4株重组酵母菌结果

图9 rhCu,Zn-SOD重组酵母菌变性及非变性电泳Fig.9 SDS-PAGE analysis of rhCu,Zn-SOD protein from 4 recombinant yeast strains
由SDS-PAGE变性及非变性电泳可见构建的重组酵母菌表达产物为分子质量约20kD单体及约40kD的二聚体,沉淀中未见与分子质量相同的目的蛋白条带(图9),比较构建的4株转化子活性及表达量结果为2#>3#>1#>0#(表3)。表明构建的工程菌株的分泌产物表达量及其活性与目的基因拷贝数均呈正相关。

表3 4株转化子表达上清酶活性测定及蛋白表达量Table 3 Determination of supernatant SOD activity and protein yield of 4 recombinant yeast strains
3 结论与讨论
Marn等[7]1938年从牛红血球中分离获得氧化物歧化酶(SOD),SOD的研究历史已有70年之久。实验证实其催化原理是将底物超氧阴离子自由基催化为过氧化氢和氧气[8-9]。按酶分类,SOD属于金属酶,根据所含金属辅基的不同,可以将其分为3类:第一类存在于真菌和哺乳动物的真核细胞中[10],也存在原核生物如Haemophilus influenzae和Caulobacter crescentus[11]中的Cu,Zn-SOD;第二类存在于E.coli[12-13]和Methanobacterium bryanti[14]等原核生物内的含Fe离子的SOD(Fe-SOD);第三类存在于真核生物细胞线粒体和原核生物E.coli[15]的细胞内的含有二价Mn离子的SOD(Mn-SOD)。Cu,Zn-SOD的稳定性及含量高于Mn-SOD,使之在临床应用成为可能,又因异种SOD在临床上易过敏,故本研究选择人的SOD。
毕赤酵母P.pastoris为真核表达系统,遗传稳定,重组表达产物背景杂蛋白少,适于高密度培养表达,是一种较为理想的真核蛋白表达系统。带有分泌信号肽的毕赤酵母pPIC9K载体可将外源蛋白基因整合到毕赤酵母的基因组中,从而实现目的蛋白得分泌表达[16]。毕赤酵母中外源基因的来源对表达有很大影响,用酵母偏爱密码子编码外源基因,对于筛选高表达菌株具有较好的实践意义。采用酵母偏爱密码子合成人Cu,Zn-SOD在酵母中表达,国内外还没有报道。国外对SOD的突变体研究较多,但都在临床阶段,国内表达虽有研究,但报道不多且表达量也不能达到产业化要求。
本研究表明拷贝数与表达量呈正相关。理论上,提高拷贝数可增加外源蛋白的表达水平[17-18]。但在个别情况下,高拷贝数不利于目的蛋白的表达,这可能是由于负反馈抑制作用使分泌的蛋白因过高表达而对分泌途径形成抑制作用。故表达量的高低与基因拷贝数的关系只有从实验中得到结论[19-23]。
酵母菌在对数生长期时,生长速率最大,细胞内酶系活跃,代谢旺盛,大量蛋白得以表达。因此,酵母先在BMGY中快速生长,当处于对数生长期时,转到BMMY中进行甲醇诱导,更有利于外源蛋白的大量表达。从重组菌株的生长曲线看出,酵母菌在BMGY中培养16~24h处于对数生长期,在此期间更换BMMY培养基进行诱导最为合适。本研究构建的3株高拷贝转化子,实现了目的蛋白的高表达,为进一步探索积累了实验数据。
[1] McCORD J M, FRIDOVICH I. Superoxide dismutase: an enzymic function for erythrocu-prein(hemocuprein)[J]. Biol Chem, 1969, 244:6049-6055.
[2] 张欣. 超氧化物歧化酶(SOD)及其研究进展[J]. 内蒙古石油化工, 2010(16): 14-15.
[3] LANDIS G N, TOWER J. Cu,Zn-superoxide dismutase gene dosage and cell resistance to oxidative stress: a review[J]. Biosci Rep, 1997, 17(1): 85-89.
[4] 盛良全, 郑晓云, 闫向阳, 等. 生命体中的超氧化物歧化酶[J]. 医学基础与药学研究, 2002, 48(6): 48-53.
[5] 萨姆布鲁克J, 拉塞尔D W. 分子克隆实验实验指南[M]. 黄培堂, 译.3版. 北京: 科学出版社, 2002.
[6] 张龙翔, 张庭芳, 李令媛. 生化实验方法和技术[M]. 北京: 高等教育出版社, 1997: 138-140.
[7] MARN T, KEILIN D. Hemocuprein and hepatoprein-Cu-protein compounds of blood and liver in mammals[J]. Proc Roy Soc Ser Biol Sci,1939, 126: 303-310.
[8] McCORD J M, FRIDIVICH I. Superoxide dismutase[J]. Biol Chem,1969, 244(5): 6049-6054.
[9] McCORD J M, KEELE J B, FRIDIVICH I. Enzyme-based theory of obligate anaerobiosis: physiological function of superoxide dismutases[J]. Proc Natl Acad Sci USA, 1971, 68: 1024-1027.
[10] MISRA H P, FRIDOVICH I. Purification and properties of superoxide dismutase from Neurospora crasse[J]. Biol Chem, 1972, 247: 3410-3414.
[11] STEINMAN H M. Copper-zinc superoxide dismutase from Caulobacter crescentus CB15: a novel bacyeriocuprein from of the enmyme[J]. Biol Chem, 1982, 257: 10283-10293.
[12] MOSTEEN B, STEPHEN J. Purification and some anion biding properties of the iron-containing protein of Escherichia coli B[J]. Biol Chem,1976, 105: 4561-4570.
[13] SLYKHOUSE T O, FEE J A. Physical and chemical studies on bacterial superoxide dismutases[J]. Biol Chem, 1976, 251: 5472-5477.
[14] KIRBY T W, LANCASTER J R, FRIDOVICH I. Isolation and characterization of iron-containing superoxide dismutase of Methanobacterium bryantii[J]. Arch Biochem Biophys, 1981, 210: 140-148.
[15] KEELE J B, McCORD J M, FRIDIVICH I. Superoxide dismutase from Escherrichia coli B: a new manganese-containing enzyme[J]. Biol Chem, 1970, 245: 6176-6181.
[16] DING Yunfei, LIU Yong, DAI Changbai. Advances in Pichia pastoris expression system[J]. Chinese Bulletin of Life Sicences, 2003, 15(1):26-31.
[17] VASSILEVA A, CHUGH D A, SWAMINATHAN S, et a1. Effect of copynumber on the expression levels of hepatitis B surface antigen in the mechyltrophic yeast Pichia pastoris[J]. Protein Expr Purif, 2001, 21(1):71-80.
[18] CLARE J J, ROMANS M A, RAYMENT F B, et al. Production of mouse epidermal growth factor in yeast: high-level secretion using Pichia pastoris strains containing mutiple gene copies[J]. Gene, 1991, 105(2):205-212.
[19] 谓涛, 王红宁. 外源基因在巴斯德毕赤酵母中多拷贝整合的研究进展[J]. 生物技术通讯, 2006(3): 415-417.
[20] LOEWEN M C, DAUGULIS A J, DAVIES P L, et al. Biosynthetic production of typeⅡfish antifreeze protein fermentation by Pichia pastoris[J]. Appl Microbiol Biotechnol, 1997, 48: 451-452.
[21] SREEKRISHNA K, BRANKAMP R G, KROPP K E, et al. Strategies for optimal synthesis and secretion of heterologous protein in the methylotrophic yeast Pichia pastoris[J]. Gene, 1997, 190(1): 55-56.
[22] RONANES M A, CLARE J J, BEESLEY K M, et al. Recombinant Bordetella pertussis pertactin(P69) from the yeast Pichia pastoris: highlevel production and immunological properties[J]. Vacinne, 1991, 9(12): 901-906.
[23] 王清路, 李俏俏, 薛金艳, 等. 巴斯德毕赤酵母表达系统的特点及应用[J]. 生物技术通讯, 2006, 17(4): 640-643.
Construction and High Expression of Pichia pastoris Transformants Carrying Human Cu/Zn Superoxide Dismutase Gene
CHI Chun-ping1,2,SHI Cheng-bo2,CAO Yu-feng2,CHEN Zi-yang2,XU Jun2,ZHANG Jian-feng2,JIA Yuan2,
LI Zheng2,WANG Xiao-jie1,NIU Ling3,TIAN Hai-shan1,SUN Biao4,LI Xiao-kun1,*(1. School of Life Sciencs, Jilin Agricultural University, Changchun 130118, China;2. Changchun Institute of Biological Products,Changchun 130062, China;3. Institute of Microbiology, Chinese Academy of Science, Beijing 100080, China;4. Siping Huake Biotechnology Limited Company, Siping 136000, China)
Artificial rhCu,Zn-SOD gene was synthesized according to the amino acid sequence of human SOD with yeast preferential codons, then cloned into the eukaryotic expression vector pPIC9K, named pPIC9K/Cu,Zn-SOD. The plasmid was transformed into Pichia pastoris GS115 by electroporation and screened for high-copy transformants under the selective pressure.Three recombinant yeast strains were obtained with high expression. Gene copy number increased 2-8 folds by Southern blot identification. The expression activity increased 2-4 fold. The recombinant gene copy number was positively correlated with the SOD protein yield. The Expressed protein was secreted to the supernatant as dimmer with low degree of glycosylation. The molecular weight was about 40 kD. The product can specificity bind to the antibody of Cu,Zn-SOD. Transformants entered the logarithmic growth phase after 16 h and the stable growth phase after 24 h in culture. After 50 passages, 3 recombinant strains remained stable, indicating it could be used for industrialization production of Cu,Zn-SOD. Cu,Zn-SOD activity was determined as 600U/mL in supernatant. The high expression strain was build after the optimal shake flask culture conditions of pH 6.0,temperature 30 ℃, 1.5%(V/V) ethanol, and 72h induced.
Pichia pastoris GS115;Cu,Zn-SOD;electrotransformation;high gene copy number;ereukaryotic expression
Q78
A
1002-6630(2012)05-0218-06
2011-04-29
吉林省科学技术发展重点项目(20070924-02)
迟春萍(1963—),女,副研究员,博士研究生,主要从事基因工程药物研究。E-mail:chichunping@163.com
李校堃(1964—),男,教授,博士,主要从事生物反应器与基因药物研究。E-mail:xiaokunli@163.net
