新疆哈萨克族传统发酵酸马奶中酵母菌的分离鉴定
2012-10-28贾佳佳
李 静,贾佳佳,杨 艳,田 燕,武 运*
(新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
新疆哈萨克族传统发酵酸马奶中酵母菌的分离鉴定
李 静,贾佳佳,杨 艳,田 燕,武 运*
(新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
从新疆南山、水西沟、伊犁昭苏采集的哈萨克族传统发酵酸马奶中共分离得到酵母菌34株。采用传统形态学、生理生化特性方法对酵母菌进行鉴定,鉴定结果为Schizosaccharomyces 1株、Sehizoblastosporion 1株、Torulopsis 1株、Saccharomycodes 1株、Kloechera 9株、Kluveromyces 5株、Dekker 8株、Trichosporon 3株、Hansenula 2株、Brettanomyces 3株。利用5.8S rDNA序列同源性分析和系统发育树对菌株12号进行分子生物学鉴定,鉴定结果为:菌株12与标准菌株HQ396523.1同源性达到96%,为Kluveromyces的Kluveromyces marxianus,与传统鉴定结果一致,表明5.8S rDNA序列分析在酵母菌鉴定上的准确性。
酸马奶;酵母菌;分离鉴定;分子生物学
酸马奶(koumiss)是以新鲜马奶为原料,加入乳酸菌和酵母菌等微生物的天然发酵剂,自然发酵形成的一种酸性低乙醇含量的乳饮品[1-3]。随着生活水平的提高,人们对饮食结构的要求越来越严格[4],不仅要考虑营养价值的全面性,而且要注意被机体实际吸收利用的多少。发酵奶的营养价值和吸收利用率均比鲜奶还高,因此酸马奶酒更引起了人们的重视[5]。由于酸马奶酒有着特殊的有益微生物群,将来必定成为一种很理想的微生态制剂发挥它应有的作用,而且有可能从酸马奶酒的微生物群中筛选出对结核分枝杆菌等细菌具有高度抗菌活性的微生物来,生产新型抗生素[6-8]。酵母菌体本身也有很高的利用价值,并应用于食品工业、饲料工业及生化制药中。本实验通过对新疆哈萨克族传统发酵酸马奶中酵母菌进行分离纯化鉴定,为新疆哈萨克族传统发酵酸马奶中酵母菌菌种资源的保藏与开发利用提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
酸马奶采集于新疆南山哈萨克族牧民家自制酸马奶、水西沟哈萨克族牧民家自制酸马奶、伊犁昭苏哈萨克族牧民家自制酸马奶。
1.1.2 培养基
分离纯化用培养基:麦芽糖培养基、麦芽汁琼脂培养基、YPD培养基;鉴定用培养基:糖发酵基础培养基、硝酸盐培养基、碳源同化基础培养基、氮源同化基础培养基、无维生素基础培养基、产类淀粉培养基、产酸培养基、分解尿素培养基。
1.1.3 试剂
酵母菌基因组DNA提取试剂盒(离心柱型)、ZM404 DL2000 DNA Marker、dNTP Mixture (均为 2.5mmol/L)、EB染色液(10mg/L) 北京庄盟国际生物基因科技有限公司。
50×TAE电泳缓冲液贮液:Tris 242g,浓度为17.4mol/L、冰乙酸57.1mL,浓度为0.5mol/L EDTA (pH8.0)200mL,定容至1000mL。0.8%的琼脂糖凝胶:0.8g琼脂糖溶于100mL 0.5×TAE缓冲液中;2%的琼脂糖凝胶:2g琼脂糖溶于100mL 0.5×TAE缓冲液中。
1.2 仪器与设备
LD2X-30KA 立式电热压力蒸汽灭菌锅 上海申安医疗器械厂;HR40-ⅡA2 生物安全柜 青岛海尔特种电器有限公司;DHP-9162电热恒温培养箱、HWS26 型电热恒温水浴锅 上海一恒科技有限公司;XSP-2CA 生物显微镜 厦门Motic实业集团有限公司;LSM 510 SYSTEM 激光共聚焦显微镜 北京普瑞赛司仪器有限公司;AR2130/C型精密电子天平 梅特勒-托利多仪器(上海)有限公司;THE-82 气浴恒温振荡器 常州市国立试验设备研究所;050-810 Tgradient 48型PCR扩增仪 德国Biometra公司;DYY-6C型电泳仪 北京六一仪器厂;JY04S型凝胶成像仪 北京君意东方电泳设备有限公司;US-Patent Research型移液枪、MiniSpin型离心机 德国Eppendorf公司。
1.3 方法
1.3.1 酵母菌的分离与纯化
吸取1mL酸马奶置于装有9mL无菌生理盐水的试管中,充分振荡使其混匀。将混合后酸马奶进行倍比稀释,稀释度为 10-1、10-2、10-3、10-4、10-5、10-6,选取10-2、10-3、10-4、10-5、10-65个稀释度,用移液器吸取1mL样液,采用涂布法,将样液均匀涂布于麦芽汁琼脂培养基上,将制备好平板置于28℃恒温培养箱中培养24~48h,观察并记录菌落特征,挑取菌落较大,且呈白色或乳白色、粉色单个菌落进行简单染色,观察细胞形态,呈圆形或椭圆形、腊肠状且细胞较大者,将其接种于麦芽糖琼脂培养基,于28℃恒温培养箱中培养24~48h,重复几次纯化酵母菌,直至镜检结果为同一细胞形态后,将其接种于YPD固体培养基斜面上,恒温培养48h后,于4℃保存备用。
1.3.2 酵母菌的生理生化特性鉴定
酵母菌分离菌株主要通过繁殖方式观察、子囊孢子形成实验、掷孢子形成实验、菌丝形成实验、葡萄糖产气实验、糖发酵实验、脲酶分解实验、产酯实验、产酸实验、无维生素生长实验等生理生化特征进行鉴定[9-10]。
1.3.3 酵母菌的5.8S rDNA分析
1.3.3.1 酵母菌基因组DNA的提取
取1mL活化菌悬液,12000r/min离心1min,弃上清液,收集菌体;DNA的提取按照试剂盒说明书上的方法进行操作;然后将所提取的DNA于-20℃保存。
1.3.3.2 5.8S rDNA PCR扩增
将上述制备的基因组DNA作为PCR扩增的模板,采用50μL反应体系,用一对与ITS序列互补的引物,ITS 1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS 4(5'-TCCTCCGCTTATTGATATGG-3')对5.8S-ITS区域酵母菌DNA进行扩增。PCR扩增体系:1μL酵母菌DNA,引物ITS 1和ITS 4各1μL,ddH2O 37μL,5μL的10×Buffer(含Mg2+),4μL 的dNTP(超纯),0.25μL 的Taq DNA聚合酶(5U/μL),0.75μL的双蒸水。PCR扩增程序:98℃预变性10min;94℃变性30s,58℃退火30s,72℃延伸45min,从变性到延伸30个循环;72℃延伸10min;保温4min。4℃暂时保存,-20℃保存备用。
PCR产物经2%的琼脂糖凝胶进行电泳,电压100V,电泳液为1×TAE。电泳后,用EB染色20min,紫外灯下观察,拍照。
1.3.3.3 扩增产物测序和序列分析
5.8S rDNA扩增产物使用上海生工生物工程技术服务有限公司的UNIQ-10柱式PCR产物回收试剂盒,按说明回收、纯化目的片段。经纯度检测后,委托上海生工生物工程技术有限公司进行测序,测得的序列与NCBI数据库中一致序列进行比对及相似性分析。
1.3.3.4 系统发育分析
采用软件DNA Star和MEGA 4.1,将测得的序列与GenBank数据库中的相关种属代表菌株的5.8S rDNA 基因序列进行系统发育分析。
2 结果与分析
2.1 酵母菌分离菌株的菌落形态及细胞形态特征

图1 酵母菌的细胞形态Fig.1 Cell morphology of yeast
从新疆哈萨克族传统自制酸马奶中共分离出34株酵母菌,菌落形态呈圆形或椭圆形,表面光滑湿润或粗糙,颜色呈乳白色或乳黄色,表面凸起,边缘整齐或不规则,无性繁殖为芽殖或裂殖,细胞形态为圆、椭圆、卵圆等。
酵母菌在经YPD 培养基活化后,将制得的菌株在激光共聚焦显微镜及普通光学显微镜下,观察细胞形态,结果见图1,细胞形态符合酵母菌特征。
2.2 酵母菌分离株生理生化特性鉴定结果
采用传统形态学、生理生化特性方法对酵母菌进行鉴定,鉴定结果为: Schizosaccharomyces 1株、Sehizoblastosporion 1株、Torulopsis 1株、Saccharomycodes 1株、Kloechera 9株、Kluveromyces 5株、Dekker 8株、Trichosporon 3株、Hansenula 2株、Brettanomyces 3株。根据《食品微生物实验技术》[9]和《酵母菌的特征与鉴定手册》[10]的方法,酵母菌种属的鉴定结果见表1~4。

表1 酵母菌菌落形态及细胞形态特征鉴定结果Table 1 Description of colonial and cell morphology of isolated yeasts
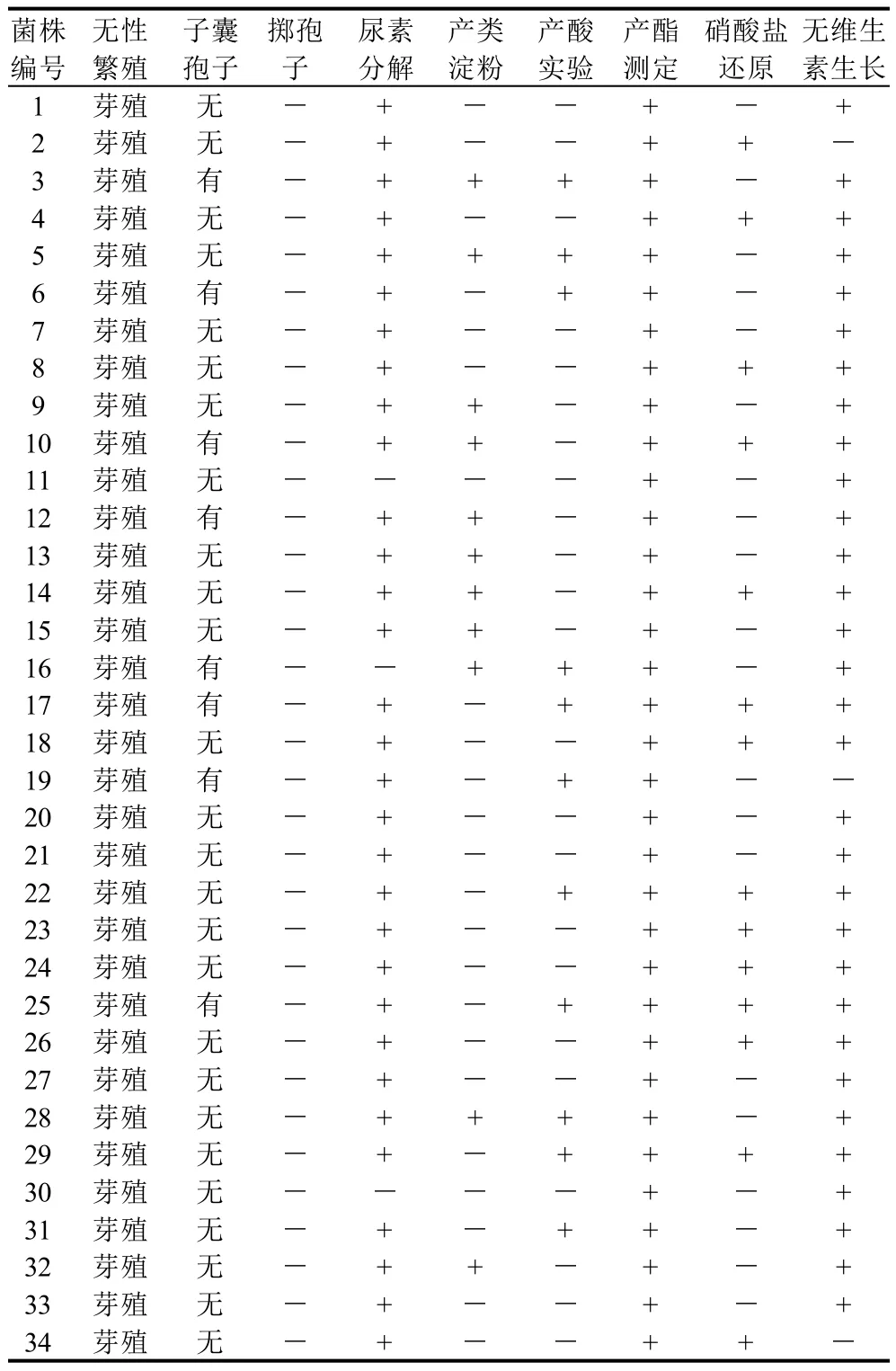
表2 酵母菌生理生化特性鉴定结果Table 2 Physiological and biochemical properties of isolated yeasts

表3 酵母菌糖发酵鉴定结果Table 3 Results of carbohydrate fermentation tests for identification of isolated yeasts

续表3

表4 酵母菌碳源、氮源同化鉴定结果Table 4 Results of carbon and nitrogen assimilation tests for identification of isolated yeasts
2.3 5.8S rDNA 分析
2.3.1 部分优势酵母菌菌株5.8S rDNA琼脂糖凝胶电泳结果
对优势酵母菌菌株进行分子生物学鉴定,通过PCR扩增该菌株的5.8S rDNA序列,用2%琼脂糖凝胶对菌株的5.8S rDNA和ITS扩增产物做电泳检测,溴化乙锭染色成像后,用凝胶成像分析系统进行拍摄,在750bp左右出现条带,可初步鉴定为酵母菌,结果如图2所示。

图2 酵母菌菌株的5.8S rDNA PCR扩增后的电泳检测图Fig.2 Agarose gel electrophoresis of amplified products of 5.8S rDNA sequences from isolated yeasts
2.3.2 部分酵母菌菌株的5.8S rDNA片段测序及入库比对结果

图3 菌株12 5.8S rDNA序列同源性分析Fig.3 Homology analysis of strain 12 and relative strains based on 5.8S rDNA sequence

图4 菌株12的系统发育进化树Fig.4 Phylogenetic tree of strain 12
将扩增成功的酵母菌菌株的PCR产物送北京华大基因公司进行测序,在NCBI数据库进行比对,选取序列最为接近的菌种。测序结果采用DNA Star软件绘制系统发育进化树,结果如图3、4所示,菌株12与标准菌株(HQ396523.1)相似率为96%,为Kluyveromyces marxianus CHY1612菌。
3 结 论
本实验从新疆哈萨克族传统自制酸马奶中分离纯化、鉴定酵母菌菌株34株,共10个属,分别为Schizosaccharomyces、Sehizoblastosporion、Torulopsis、Saccharomycodes、Kloechera、Kluveromyces、Dekker、Trichosporon、Hansenula、Brettanomyces。采用传统鉴定方法对34株菌进行种属鉴定,并对菌株12进行了5.8S rDNA序列分析。结果表明,虽然表型特征、生理生化特性是酵母菌分类的重要指标,但传统分类方法用于准确鉴定酵母菌并不容易,通常需要大量的生理生化实验[11-15],采用5.8S rDNA分析鉴定酵母菌,准确率可达96%~99%。利用5.8S rDNA序列同源性分析和系统发育进化树分析对菌株12进行了分子鉴定,鉴定结果为菌株12与标准菌株HQ396523.1同源性达到96%,与传统生理生化特性鉴定结果一致。结果表明,5.8S rDNA序列分析应于酵母菌鉴定具有准确性高、重现性好、稳定性高、鉴定速度快的特点[12],是一种区别、鉴定酵母菌很有效的方法[13-15]。
[1] 孟和毕力格, 乌日娜, 王立平. 不同地区酸马奶中乳杆菌的分离及其生物学特性的研究[J]. 中国乳品工业, 2004, 32(11): 6-11.
[2] 母智森, 赵美霞, 白英. 酸马奶中酵母菌的分离鉴定及抗菌特性的研究[J]. 内蒙古农业大学学报, 2002, 23(2): 35-38.
[3] 母智森, 白英. 酸马奶[J]. 内蒙古农业大学学报, 2003, 24(1): 116-120.
[4] 杨文华, 德慧, 张珉. 马乳及乳产品利用[J]. 内蒙古民族大学学报,2008, 14(2): 89-90.
[5] 哈斯苏荣, 阿木古楞, 芒来. 酸马奶及其医学价值[J]. 中国中药杂志,2003, 28(1): 11-14.
[6] 贺银凤, 李少英, 母智深. 酸马奶酒中微生物的分离鉴定及抗菌特性的研究[J]. 农业工程学报, 2002, 18(2): 91-95.
[7] 殷文政, 刘立一, 马玉玲. 马奶酒抑菌活性的研究[J]. 中国乳品工业,2005, 33(7): 15-17.
[8] 张积荣. 酸马奶中酵母菌的分离鉴定及发酵过程中乙醇含量变化的研究[D]. 乌鲁木齐: 新疆农业大学, 2007.
[9] 郝林. 食品微生物实验技术[M]. 北京: 中国农业出版社, 2001: 5.
[10] 巴尼特J A. 酵母菌的特征与鉴定手册[M]. 胡瑞卿, 译. 青岛: 青岛海洋大学出版社, 1991: 6.
[11] 李远, 巴吐尔, 张小燕, 等. 新疆哈萨克族传统发酵驼乳中乳酸菌的分离鉴定[J]. 中国食物与营养, 2011, 17(1): 54-58.
[12] 周春艳, 张秀玲, 王冠蕾. 酵母菌的5种鉴定方法[J]. 中国酿造, 2006(8): 51-58.
[13] 李运, 盛慧, 赵荣华. Biology生物鉴定系统在菌种鉴定中的应用[J].酿酒科技, 2005(7): 84-85.
[14] BELLOCH C E, GUILLAMON J M, SABATE S, et al. Rapid identification of wine yeast species based on RFLP analysis of the ribosomal internal transcribed spacer(ITS) region[J]. Arch Microbiol, 1998, 169: 387-392.
[15] FENN J P, SEGAL H, BARLAND B, et al. Comparison of updated Vitek Yeast Biochemical Card and API 20C yeast identification systems[J]. J Clin Microbiol, 1994, 32(5): 1184-1187.
Isolation and Identification of Yeasts from Koumiss as a Traditional Kazakh Fermented Drink in Xinjiang
LI Jing,JIA Jia-jia,YANG Yan,TIAN Yan,WU Yun.*...
(College of Food Science and Pharmaceutical Science, Xinjiang Agricultural University, Urumqi 830052, China)
In this study, 34 stains of yeasts were isolated from koumiss (a traditional fermented Kazakh drink in Xinjiang)sampled from Nanshan, Shuixigou and Zhaosu. According to the colonial morphology and biological properties, the strains were identified to consist of 1 stain of Schizosaccharomyces, 1 stain of Sehizoblastosporion, 1 stain of Torulopsis, 1 stain of Saccharomycodes, 9 stains of Kloechera, 5 stains of Kluyveromyces, 8 stains of Dekker, 3 stains of Trichosporon, 2 stains of Hansenula, and 3 stains of Brettanomyces. Strain 12 was further identified by 5.8S rDNA sequencing and phylogenetic tree analysis.The homology between the strain and Kluyveromyces marxianus was 96%. This was consistent with the results of identification based on morphological and biochemical properties, showing that yeast identification based on 5.8S rDNA sequences is accurate.
koumiss;yeast;isolation and identification;molecular biology
TS201.3
A
1002-6630(2012)05-0203-05
2011-10-30
国家公益性行业(农业)科研专项(200803033-A09011);新疆维吾尔自治区科技支疆项目(201191238);新疆维吾尔自治区重大专项(201130101-4);新疆农业大学紧缺人才专业大学生创新项目
李静(1986—),女,硕士研究生,研究方向为食品生物技术。E-mail:lijing_2010@sina.cn
武运(1965—),女,副教授,硕士,研究方向为食品生物技术与食品安全。E-mail:wuyunster@sina.com
