不同方法制备的大豆分离蛋白功能性质的比较研究
2012-10-27郑二丽杨晓泉吴娜娜
郑二丽,杨晓泉*,吴娜娜
(华南理工大学轻工与食品学院,食物蛋白工程研究所,广东 广州 510640)
不同方法制备的大豆分离蛋白功能性质的比较研究
郑二丽,杨晓泉*,吴娜娜
(华南理工大学轻工与食品学院,食物蛋白工程研究所,广东 广州 510640)
采用普通的碱溶酸沉方法、Samoto法、钙离子沉淀法制备出几种大豆分离蛋白,并对其产率、总脂含量及溶解性、乳化性等物化性质和功能性质进行系统比较。结果表明:钙离子沉淀法制备的大豆分离蛋白(Less-LP SPI)的产率是碱溶酸沉大豆分离蛋白(APP)产率的65%,但高于由Samoto法提取的7S与11S两种大豆分离蛋白产率之和;Less-LP SPI的总脂含量比APP降低了45%,由Samoto法提取的亲脂性蛋白(LP)中总脂含量达到7.48%,而7S与11S蛋白中脂含量分别为1.45%、2.36%。在功能性质上,LP的溶解性、乳化活性均比较差,7S、11S质量比1:2混合蛋白的溶解性最好,而Less-LP SPI在pH≤10时溶解性低于APP;乳化性方面,Less-LP SPI的乳化活性稍低于7S、11S质量比1:2的混合蛋白及APP,但乳化稳定性远高于后者。总体上,Less-LP SPI脂含量少、乳化稳定性好,方法简单,且可提高其货架期。
大豆分离蛋白;溶解性;乳化性;总脂含量
大豆蛋白属于优质蛋白质,在营养价值上可与动物蛋白相匹配,是人类较为安全和经济的植物蛋白质资源。按照沉降模式,可将大豆蛋白分为2S、7S、11S、15S 4种组分[1]。不少研究学者通过电泳分析7S与11S是大豆蛋白的主要成分,约占球蛋白的70%,是主要的贮存蛋白,而1987年Setsuko等[2]通过免疫印迹的方法指出7S、11S只占大豆蛋白的50%左右。Samoto等[3-4]在1998年及2006年分别从脱脂豆浆中提取出油体结合蛋白(OBAPs)及亲脂性蛋白(LP),他们指出大豆分离蛋白不仅包含β-伴球蛋白7S和球蛋白11S,还包含一部分LP,且LP在分离蛋白中的相对含量为31%。
OBAPs及LP是一组与磷脂等极性脂紧密结合的蛋白,是一种膜蛋白,有学者报道[5-7]大豆蛋白中豆腥味的产生主要是因为在脱脂豆粉中还存在一些极性脂,磷脂自动氧化生成的一些小分子物质正是影响大豆风味的挥发性成分,因此与磷脂紧密结合的蛋白(LP)是豆腥味的来源之一。磷脂是两性物质,由于磷脂的存在,使得LP蛋白具有疏水亲油性,影响了蛋白的一些功能性质,如乳化性、溶解性、起泡性、凝胶性等。因此去除亲脂性蛋白可以改善大豆蛋白风味及某些功能性质。
Samoto法主要采用热处理和pH值回调,通过3步法分离去除LP蛋白,得到优质的7S及11S蛋白,此方法首先将大豆粉在70℃干热处理2h有利于11S与LP的分离,从而可以提高11S的纯度,将分离11S后的蛋白提取液在55℃条件下加热15min后将pH值回调,这样促进了7S与LP的分离。这种方法比较繁琐且费时。
通过添加二价阳离子,然后一步法除去LP,也可得到优质分离蛋白,这种方法比较简单。已有研究探讨此方法得到的分离蛋白的风味性,但功能性质方面的研究还未见报道,因此本实验主要是将由一步法得到的分离蛋白与普通的碱溶酸沉分离蛋白、7S与11S质量比1:2的混合蛋白及LP蛋白在蛋白回收率、总脂含量及溶解性、乳化性等功能性质上进行对比,来表征一步法得到的大豆分离蛋白具有较好的乳化稳定性,为提高此蛋白质制得产品的货架期提供参考。
1 材料与方法
1.1 材料、试剂与仪器
低温脱脂豆粕(蛋白质含量53.8%、水含量8.8%、脂含量5.6%、氮溶指数85.4%、钙含量1.68mg/g豆粉)购于山东禹王有限公司,将其于4℃保存以备用。
溴酚蓝、考马斯亮蓝R-250、丙烯酰胺、N,N-二甲叉双丙烯酰胺、四甲基乙二胺(TMED)、十二烷基磺酸钠(SDS)、三羟甲基氨基甲烷(Tris) 上海博奥生物科技有限公司;氧化镧 广州市立拓有色金属有限公司;叠氮钠 上海叶舟生化科技有限公司;其余试剂均为分析纯。
DYF-500摇摆式高压万能粉碎机 温岭市林大机械有限公司;THZ-82水浴恒温振荡器 江苏金坛宏华仪器厂;DELTAT-24/LSC冷冻干燥机 德国Christ公司;ECP3000三恒电泳仪 北京市六一仪器厂;Rapid N Cube快速定氮仪 德国Elementrar公司;SevenEasy pH计 梅特勒-托利多仪器(上海)有限公司;CR22G高速冷冻离心机、Polarized Zieman原子吸收光谱仪、RF5301日立荧光光谱仪 日本Hitachi公司;UV2300紫外-可见分光光度计 上海天美科学仪器有限公司;Mastersizer 2000粒度分布仪 英国马尔文仪器有限公司;APV均质机丹麦APV公司。

1.2 方法
1.2.1 几种大豆分离蛋白样品的制备
普通酸沉分离蛋白(APP)的制备:低温脱脂豆粕经粉碎后,过60目筛,取40g以上处理所得的豆粉添加400mL水,用2mol/L NaOH调pH8.0,提取液于常温条件下搅拌2h,然后15℃、4000×g离心10min,弃豆渣,上清液用2mol/L的HCl将pH值调至4.5,搅拌30min后,15℃、2000×g离心10min,沉淀即为酸沉大豆蛋白,用去离子水重新分散并调节pH值至7.5,经过透析后进行冷冻干燥,置于4℃密封保存备用。
钙离子沉淀法提取大豆分离蛋白(Less-LP SPI):将脱脂豆粉按质量比1:10的比例加蒸馏水,用2mol/L NaOH调分散液的pH值至7.0,常温搅拌2h后加10mmol/L CaCl2溶液,置于50℃水浴锅里加热1h,冷却后调pH值至起始值,再搅拌30min,然后15℃、4000×g离心10min,弃豆渣,其后步骤同上酸沉蛋白的制备方法。所得蛋白为亲脂性蛋白比较少的分离蛋白,即Less-LP SPI。
7S、11S、LP 3种组分的制备是根据Samoto等[4]的方法稍加改进,具体步骤如下:将脱脂豆粉在70℃条件下干热2h,而后按1:10 的比例加蒸馏水,调分散液的pH值至8.0,常温搅拌2h,离心弃豆渣,将上清液调pH值至6.5,离心所得沉淀即为11S,调上清液pH值至5.0,55℃水浴15min,回调pH值至5.5,加50mmol/L的NaCl,离心得沉淀为LP组分,所得上清液用2mol/L的HCl调pH值至4.5,离心得组分为7S,将以上所得各组分用离子水重新分散并调节pH值至7.5,经过透析后进行冷冻干燥,置于4℃密封保存备用。
7S与11S的混合液按其蛋白质量比1:2的比例称取,然后溶解进行各指标的测定,其中在溶解度测定时以去离子水为溶剂,在乳化性测定时以磷酸缓冲液作为溶剂。
1.2.2 样品产率、蛋白质含量和回收率的测定
取适量样品于130℃条件下干燥3h[8],测定水分含量。采用Jung等[9]方法测定各蛋白组分的含氮量,计算蛋白质含量。
根据所得各蛋白组分的蛋白质含量、脱脂豆粉的质量和总蛋白质含量,可得各组分的蛋白质回收率,公式如式(3):

1.2.3 极性脂的测定
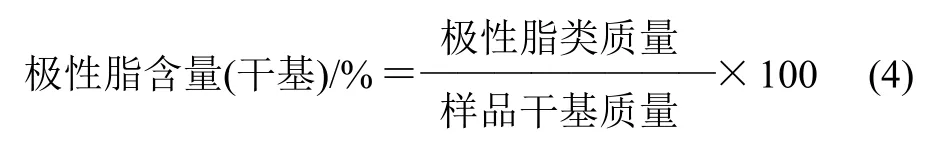
参考国标GB 2906—1982《谷物、油料作物种子粗脂肪测定方法》,采用索氏抽提法测定各组分的极性脂含量,以氯仿-甲醇体积比2:1为抽提剂。极性脂含量计算公式如式(4):
1.2.4 钙含量的测定
钙元素的含量测定按照国标GB/T 5009.92-2003《食品中钙的测定》进行。为减少实验误差,所有玻璃仪器在使用前用硝酸-水体积比1:2的混合液清洗,其后用硝酸-水体积比1:10的混合液浸泡过夜备用。精确称取0.250g样品,溶于8mL混合液(水-H2O2-硝酸体积比1:1:2)中后消化2h,待消化管中混合液透明,赶气3h至白烟完全消失。使用火焰原子吸收光谱仪,按照以下条件进行元素分析:光源为空心阴极灯,波长为422.7nm,狭缝宽为0.7nm,火焰燃气为乙炔。向待测样品中加入0.5%氧化镧以去除PO43-的干扰作用。以CaCl2标准溶液测定标准曲线,并用该曲线求得样品中钙元素的含量,钙元素的含量以每克蛋白里含有多少毫克钙表示。
1.2.5 SDS-PAGE
根据 Laemmli[10]的方法进行SDS-PAGE分析,浓缩胶和分离胶分别为12.5%和3%,考马斯亮蓝R250染色。参照Mujoo等[11]的方法辨别11S、7S及LP各亚基,11S、7S及LP组分的纯度为各自亚基的密度之和与它们3个总密度的比值。
1.2.6 溶解度测定
采用Lowry法[12]于500nm波长处测吸光度的方法测定样品溶解性:将蛋白样品溶于去离子水使其质量浓度为10mg/mL。用2mol/L NaOH或HCl溶液调pH值至3~11,室温条件下搅拌1h(在15、3、60min调节pH值)。取适量溶液于50mL离心管,20℃、10000×g离心10min后取上清液,采用福林酚法测定蛋白质含量,以牛血清蛋白为标准物制作标准曲线。蛋白质的溶解度表示为上清液蛋白质量浓度占总蛋白质量浓度的百分比。
1.2.7 乳状液的制备及其粒度分布、平均粒径大小的测定
将样品用pH值7.0的磷酸盐缓冲液配成质量浓度为5mg/mL的溶液,将溶液与玉米油按质量比9:1混合,采用APV均质机20MPa均质成乳状液[13]。乳状液样品按质量比1:1 0 0 0用去离子水稀释,采用粒度分布仪Mastersizer 2000测定乳状液中粒子大小及分布。玉米油及水的折射率分别为1.414和1.330。按式(5)分别计算表面积平均粒径(d32)及体积平均粒径(d43)。
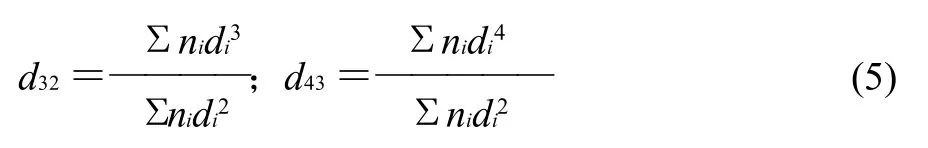
式中:ni为直径;di为脂肪球的数量。
1.2.8 乳状液贮存稳定性的测定
取5mL新制备的乳状液于10mL带有刻度及塞子的试管中,然后加几滴0.5%的叠氮钠,密封试管防止乳状液挥发。将乳状液于常温条件下放置31d,贮存中乳析程度用乳析率(CI,%)表示。

式中:hs为乳浆层的高度/mm;hE为整个乳状液的高度/mm。
1.3 统计分析
所有实验重复3次。通过方差分析(ANOVA)和线性回归模式(GLM)进行数据处理。以5%最小置信度(LSD)进行数据计算,并使用SAS系统进行均值比较。
2 结果与分析
2.1 不同方法制备的大豆分离蛋白样品的组成及分析

表1 不同方法制备的蛋白样品的产率、回收率及其组成和含量Table 1 Extraction yield, protein recovery and composition of 4 different SPIs
由表1可知,Less-LP SPI的蛋白回收率约为APP蛋白回收率的2/3,同时总脂含量也降低了45%,这表明降低的蛋白组分可能是与脂紧密结合的组分,Samoto等[4]称这种与脂紧密结合的组分为LP组分,这种组分的存在无疑影响着蛋白质的风味及一些功能性质,因此LP的去除可以在一定程度上改善蛋白的风味及特性;另外与APP相比,Less-LP SPI中蛋白含量增加,表明蛋白纯度提高,但其中Ca元素比APP中多了1mg/g蛋白,这主要是因为在用CaCl2作为沉淀剂时,会有少量的Ca2+与7S、11S蛋白的某些亚基共价结合,而形成可溶性的聚集体残留在提取的蛋白中。
由Samoto方法提取的7S、11S、LP 3种组分的蛋白回收率比为:1:1.82:1.59,且11S与7S的蛋白含量都在90%以上,而LP蛋白含量仅为85%左右,但其总脂含量达到了7.5%左右,与Samoto等[4]的研究结果一致。且7S蛋白得率与11S蛋白得率之和(19.18%)小于Less-LP SPI产品的得率(24.60%),但脂的含量变化不大,这说明由Samoto提取的优质蛋白得率较少。
2.2 SDS-PAGE电泳
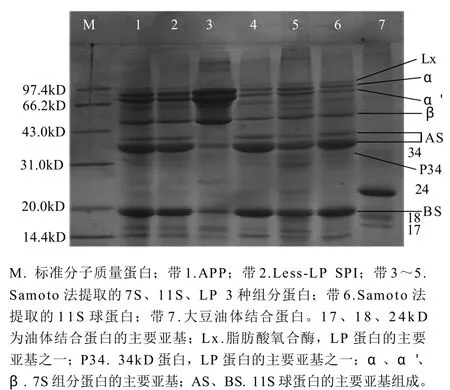
图1 不同方法提取所得大豆分离蛋白的SDS-PAGE图谱Fig.1 SDS-PAGE of 4 different SPIs

样品 7S 11S LP Less-LP SPI 37.71±0.17b 55.02±0.92b 7.86±0.52c APP 34.34±0.83b 50.57±1.36c 15.09±0.47b 7S 72.45±1.57a 23.98±0.86d 3.57±0.15d 11S 24.68±0.37c 66.25±1.27a 9.30±0.27c LP 28.70±0.81c 48.26±0.64c 23.04±0.39a
由图1可知,APP中含有较多的P34、Lx及P24亚基,通过Quantity one软件分析(表2),APP样品中7S、11S、LP 3种组分的相对含量分别为:34.34%、50.57%、15.09%,相对来说,Less-LP SPI样品中7S、11S成比例的增加,分别为37.71%、55.02%,而其LP组分相对含量仅为APP中LP相对含量的52%,结合表1中产率的变化,可进一步表明造成Less-LP SPI产率减少的蛋白组分很大部分是LP。由Samoto法提取的7S、11S的蛋白含量都在90%以上,可看出这两种蛋白样品中LP的相对含量较少,而LP蛋白样品中LP组分的含量达到了23.04%。
2.3 溶解度

图2 不同分离蛋白的溶解度曲线Fig.2 Solubility of 4 different SPIs
由图2可知,4种不同的分离蛋白在等电点附近溶解度都较低,偏离等电点溶解度开始增加,且7S、11S质量比1:2混合蛋白的溶解度最高,而LP的溶解度相比较低(≤60%),这主要是因为LP中含有较多的与蛋白紧密结合的磷脂等极性脂的存在,使得其在水中大多以乳状液的形式存在,这与Samoto等[4]证实的LP溶解性最差的结果一致;Less-LP SPI的溶解度低于APP(尤其在pH7~8时),原因可能是由于Less-LP SPI中含有较多的钙(比APP多1.03mg/g pro)影响了蛋白的溶解度,Scilingo等[14]研究表明每克蛋白添加1.23~5mg Ca会造成7S的α与α′亚基以Ca2+为桥梁形成可溶性聚集,使得其溶解度降低。但在较高的pH值下,Less-LP SPI的溶解度要高于APP的溶解度,这可能是因为高的pH值影响了Ca2+与蛋白质的结合。
2.4 乳化性
样品的乳化特性用表面积平均粒径d32与体积平均粒径d43来表征,d32的大小可反应乳状液的乳化活性,d32越小,乳化活性越好,d43用来表征粒径的变化,进而反应乳化稳定性。2.4.1 乳化活性
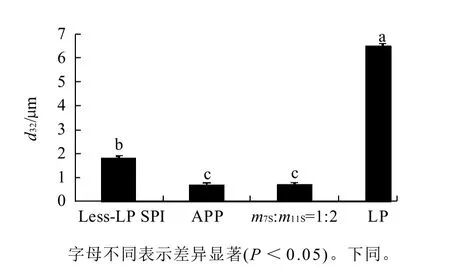
图3 4种样品乳状液表面积平均粒径的大小Fig.3 Average diameter of the particles on the surface of fresh emulsion formed by 4 different SPIs
由图3可知,4种分离蛋白的d32大小依次为:APP<m7S:m11S=1:2混合蛋白<Less-LP SPI<LP,表明APP的乳化活性高于Less-LP SPI的乳化活性,这与其溶解度及表面疏水性(h0(APP)=1432.2>h0(Less-LPSPI)=964.0)变化是一致的,这主要是因为Less-LP SPI中含有少量Ca2+的存在(对比APP),Ca2+的存在使得蛋白质表面电荷减少,导致其降低油水界面表面张力的能力下降,造成油滴之间相互作用,形成大的表面积粒径;A PP与7S、11S质量比1:2混合蛋白的乳化活性无显著性差异(P≥0.05);LP的乳化活性最差。曲家妮等[15]也证明LP的乳化活性很低。原因一方面可能是因为LP蛋白的溶解性太差,影响蛋白分子迅速迁移吸附到油滴表面,另一方面,LP的表面疏水性低,也很难吸附到油滴表面,而油滴表面高的蛋白浓度是形成小粒径颗粒的重要因素[16],从而使油滴粒径增大,乳化活性有所降低。
2.4.2 乳化稳定性
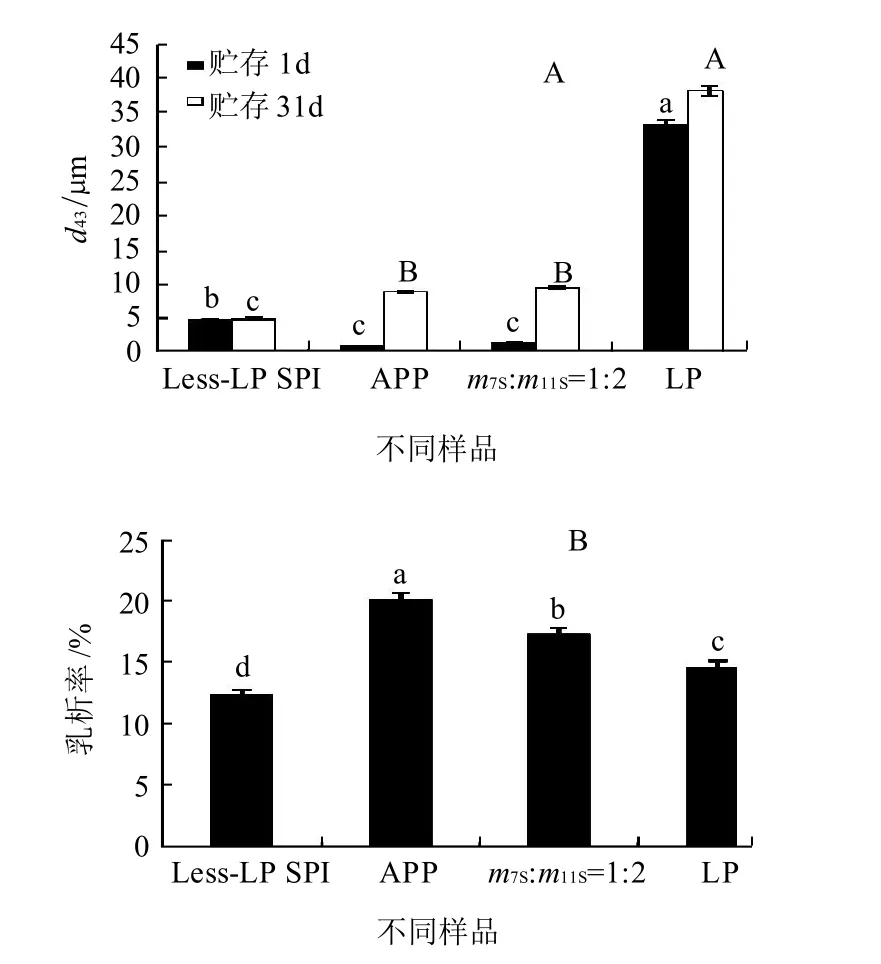
图4 贮存第1天及第31天4种样品乳状液d43的变化(A)及第31天时乳状液的乳析率(B)Fig.4 Change in particle sizes of emulsion formed by 4 different SPIs during storage for 1 days and 31 days and the creaming index of emulsion on the 31st day
为了分析4种分离蛋白所形成乳状液的乳化稳定性,将乳状液在常温条件下放置31d后测定其d43及乳析率的变化,结果如图4所示。对比4种分离蛋白所制乳状液在第1天时d43的大小,这与d32一致,即LP所制乳液的d43最大,其次为Less-LP SPI,而APP与m7S:m11S=1:2混合蛋白所形成乳状液的d43无显著性差异(P>0.05);APP及7S、11S质量比1:2混合蛋白所形成乳状液在31d后d43发生了明显的变化,但由Less-LP SPI所形成的乳状液的d43变化不大,B图中由Less-LP SPI制备的乳状液乳析率的变化最小,这些结果均表明Less-LP SPI具有良好的乳化稳定性。

图5 常温条件下贮存第1天及第31天Less-LP SPI(A)及APP(B)乳状液的粒径体积分布变化图Fig.5 Change in droplet size distribution of emulsion formed by Less-LP SPI (A) and APP (B)
由图5可知,经过31d常温贮存的Less-LP SPI所制乳状液的粒径分布稍向大粒径偏移(图5A),但偏移不大,而由APP形成的乳状液中粒径分布明显向大粒径偏移(图5B),且后面的小峰转化为大峰,可能在贮存中乳状液很不稳定发生了聚集,但这需要电子显微镜观察进一步认证。
3 结 论
3.1 以CaCl2为沉淀剂所提的分离蛋白(Less-LP SPI)蛋白回收率比APP降低了1/3,但样品的纯度提高,同时脂的含量减少了大约1.71%,通过SDS-PAGE分析所降低的蛋白组分可能是LP蛋白组分;由Samoto法提取的7S、11S蛋白含量在90%以上,且蛋白纯度高,脂含量低,而LP样品的蛋白含量为85.08%,脂的含量达到了7.48%。
3.2 由于Ca2+的作用,Less-LP SPI样品在中性条件下表面疏水性及在pH<10时溶解性均低于APP,7S、11S质量比1:2混合蛋白具有更好的溶解性,LP样品的溶解性最差,在高pH值下小于60%。从乳化性分析可看出,虽然Less-LP SPI样品乳化活性小于APP及7S、11S质量比1:2混合蛋白,但它具有较好的乳化稳定性,用此蛋白做产品可提高样品的货架期。
[1] ANG H G, KWIK W L. Develop of soymilk: a review[J]. Food Chemistry, 1985, 17(4): 235-250.
[2] SETSUKO I, FUMIO Y. Determination of glycinin and beta-conglycinin in soybean proteins by immunological methods[J]. Agricultural and Food Chemistry, 1987, 35(2): 200-205.
[3] SAMOTO M, MIYAZAKI C, KANAMOR J, et al. Improvement of the off-flavor of soy protein isolate by removing oil-body associated proteins and polar lipids[J]. Bioscience Biotechnology Biochemistry, 1998, 62(5): 935 - 940.
[4] SAMOTO M, MAEBUCHI M, CHIAKI M, et al. Abundant proteins associated with lecithin in soy protein isolate[J]. Agric Food Chem,2007, 102(1): 317-322.
[5] ANDERSON R L. Acid-sensitive soy proteins affect flavor[J]. Journal of Food Science, 1976, 41(8): 293-298.
[6] KALINAKI A, WEISEMANN J M, MATTHEW B F, et al. Molecular cloning of a protein associated with soybean oil bodies that is similar to thiol proteinases of the papain family[J]. The Journal of Biological Chemistry, 1990, 265(10): 13843-13848.
[7] WU Nana, WANG Lijun, YANG Xiaoquan, et al. Comparisons of flavor volatiles and some functional properties of different soy protein products[J]. Journal of the American Oil Chemists, 2011, 88(10):1621-1631.
[8] AOAC. Official methods of analysis of the association of official analytical chemists[M]. 16th ed. Washington, D C, USA: Association of Official Analytical Chemists, 1995: 10.
[9] JUNG S, RICKERT D A, DEAK N A, et al. Comparison of kjeldahl and dumas methods for determining protein contents of soybean products[J].Am Oil Chem Soc, 2003, 80(20): 1169-1173.
[10] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680- 6851.
[11] MUJOO R, TRINH D T, NG P K W. Characterization of storage proteins in different soybean varieties and their relationship to tofu yield and texture[J]. Food Chemistry, 2003, 82(2): 265-273.
[12] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the folin-phenol reagent[J]. Biol Chem, 1951, 193(1): 265-275.
[13] BURGAUD I, DICKINSON E, NELSON P V. An improved high pressure homogenizer for making fine emulsions on a small scale[J].International Journal of Food Science and Technology, 1990, 25(4): 39-46.
[14] SCILINGO A A, ANM C. Characterization of soybean protein isolates.The effect of calcium presence[J]. Am Oil Chem Soc, 2004, 81(1): 63-69.
[15] 曲家妮, 杨晓泉. 大豆蛋白组分功能性质的比较研究[J]. 中国粮油学报, 2010, 25(6): 25-30.
[16] TOMAS A, PAQUET D, COURTHAUDON J L. Effect of fat and protein contents on droplet size and surface protein coverage in dairy emulsions[J]. Journal of Dairy Science, 1994, 77(2): 413-417.
Comparison of Functional Properties of Soybean Protein Isolates Prepared by Different Methods
ZHENG Er-li,YANG Xiao-quan*,WU Na-na
(Research and Development Center of Food Proteins, College of Light Industry and Food,South China University of Technology, Guangzhou 510640, China)
Several soybean protein isolates (SPI) were prepared by acid precipitation, Samoto method and calcium-precipitation method, respectively. The characteristics including protein yield, total lipid content, solubility and emulsification of these SPIs were investigated. Our results showed that the yield of calcium-precipitation protein (Less-LP SPI) was lower than that of acid precipitation protein (APP), but higher than 7S, 11S extracted by Samoto fractionation procedure. The lipid content of Less-LP SPI was decreased by 45% when compared with that of APP. The lipid content of lipophilic protein (LP) obtained from Samoto fractionation was 7.48%, but the lipid contents in 7S and 11S were 1.45% and 2.36%, respectively. The Samoto LP-rich fraction had inferior solubility and emulsifying properties. Less-LP SPI had lower solubility (pH ≤ 10) and emulsifying activity than APP, while Less-LP SPI had superior emulsion stability. In summary, Less-LP SPI has lower lipid and better emulsion stability and therefore can improve the shelf life of foods.
soy protein isolate;solubility;emulsification;lipid content
TS201.21
A
1002-6630(2012)15-0107-06
2011-07-06
广东省重大科技专项(2009A080209001)
郑二丽(1986—),女,硕士研究生,研究方向为粮食、油脂与植物蛋白工程。E-mail:erli1225@163.com
*通信作者:杨晓泉(1965—),男,教授,博士,研究方向为大豆蛋白的开发利用。E-mail:fexqyang@163.com
