鲈鱼风干成熟过程中脂质分解氧化规律
2012-10-25刘昌华章建浩
刘昌华,章建浩*,王 艳
(南京农业大学食品科技学院,国家肉品质量与安全控制工程技术研究中心,教育部肉品加工与质量控制重点实验室,农业部农畜产品加工与质量控制重点开放实验室,江苏 南京 210095)
鲈鱼风干成熟过程中脂质分解氧化规律
刘昌华,章建浩*,王 艳
(南京农业大学食品科技学院,国家肉品质量与安全控制工程技术研究中心,教育部肉品加工与质量控制重点实验室,农业部农畜产品加工与质量控制重点开放实验室,江苏 南京 210095)
以鲈鱼(perch)为原料进行腌制风干成熟,通过分析测定加工过程中鲈鱼肌肉脂肪组成、脂肪酶及脂肪氧合酶(LOX)活力、硫代巴比妥酸值(TBARS)和过氧化值(POV)变化情况,探究其脂质分解氧化规律。结果表明:鲈鱼肌肉风干过程中总脂肪含量显著降低(P<0.05),中性脂质、磷脂含量在加工过程中显著下降(P<0.05),游离脂肪酸(FFA)含量显著上升(P<0.05),棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)、二十碳五烯酸(C20:5)和二十二碳六烯酸(C22:6)是FFA的主体成分;酸性脂肪酶、中性脂肪酶和磷脂酶活力在加工过程中总体上都呈显著下降趋势(P<0.05),且磷脂酶活力下降幅度最大,中性脂肪酶活力始终显著高于其他两种酶(P<0.05);而LOX活力持续下降,POV和TBARS值在整个加工过程中都呈现先增大后减小的变化趋势,说明风干成熟后期较高的温度能促进脂质氧化产物进一步分解,加速风味物质的形成。
鲈鱼;风干成熟;脂肪酶;脂肪氧合酶;脂质分解氧化
鲈鱼作为我国高档淡水鱼品种之一,其养殖量每年都在增加;鲈鱼肉质较嫩,脂肪含量较高,且骨刺较少,适宜进行深加工。我国不同地区风鱼制作基本采用腌制风干工艺,如腌腊鱼[1]、风干武昌鱼[2]、风干鲈鱼[3];鲈鱼在腌制风干过程中,食盐渗透导致水分流失,含盐量逐渐升高,盐分浓缩效应影响肌肉内源酶活力。
目前国内外对传统畜产品脂质分解氧化进行了比较详细的研究,Zhang Jianhao等[4]研究结果表明金华火腿风干成熟过程中提高风干后期成熟温度,能加速脂质分解氧化,有利于成品风味形成并降低脂质氧化指标;Jin Guofeng等[5]研究发现干腌培根加工过程中,尤其是腌制阶段,较高盐分抑制酸性脂肪酶、磷脂酶的活力,但能提高脂肪氧合酶(lipoxygenase,LOX)的活力。LOX水解游离脂肪酸(free fatty acid,FFA)生成醛类、酮类等挥发性成分,醛类、酮类等挥发性成分在样品风味形成过程中有重要作用[6-7]。水产品含有丰富的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA),与饱和脂肪酸(saturated fatty acid,SFA)相比,PUFA在加工和贮藏过程中不饱和脂肪酸更易发生分解和氧化,目前有关不同烹饪方法对水产品脂质分解氧化影响有较多报道[8],而水产品风干过程中有关脂肪酶及LOX活力变化对脂质分解氧化的影响目前并未见报道。本研究以鲈鱼为原料,采用干腌、风干成熟工艺制作风鱼产品,系统研究加工过程中脂肪组成和含量,脂肪酶活力、LOX活力以及脂质氧化指标的变化情况,分析评价其对脂质分解氧化情况的影响,探究鲈鱼风干成熟过程中脂质分解氧化规律,为鲈鱼风干产品脂质氧化和品质控制提供理论基础。
1 材料与方法
1.1 材料与试剂
从超市购买新鲜鲈鱼,宰杀清洗加入适量料酒,沥干,4℃条件下冷却。
测定中所用常规试剂均为分析纯,所用生化试剂均购自美国Sigma公司。
1.2 仪器与设备
SPX-250型恒温恒湿箱 上海博迅实业有限公司医疗设备厂;722型可见光光度计 上海精密科学仪器有限公司;Allegra 64R型高速冷冻离心机 美国Beckman公司;IKAT18basic型高速分散机 德国IKA公司;DHG-9030A型电热恒温鼓风干燥箱 上海一恒科技有限公司;SENCO R-21型旋转蒸发器 上海申胜生物技术有限公司;JA2003电子天平 上海天平仪器厂;气相色谱系统(配AS3000自动进样器和Xcalibur色谱工作站) 赛默飞世尔科技公司;UV-2450紫外分光光度仪 日本岛津公司;Spectra Max M2e酶标仪 美国分子仪器公司。
1.3 方法
1.3.1 样品的制备
随即抽取3条鲈鱼作为原料对照组进行分析检测,剩余鲈鱼用2.5g/100g的食盐腌制,采用在4℃、相对湿度85%~90%条件下腌制2d;然后在控温控湿培养箱中按照表1工艺参数风干成熟。分析于主要工艺点随机抽取3条鲈鱼鱼样品,取肌肉将其切碎、混匀,用不透光真空袋真空包装,-18℃条件下冷藏备用。

表1 鲈鱼风干加工过程中的取样工艺点Table 1 Sampling points during the processing of dry-cured perch
1.3.2 理化指标测定
1.3.2.1 水分含量测定
按GB/T 9695.15—2008《肉与肉制品 水分含量测定》方法进行。
1.3.2.2 食盐含量测定
按GB/T 9695.8—2008《肉与肉制品 氯化物含量测定》方法进行。
1.3.2.3 pH值测定
精确称取10g肉样于80mL离心管中,然后加10mL蒸馏水用高速分散机匀浆1min,匀浆结束后用pH计立即测定匀浆物的pH值,重复测定3次。
1.3.3 脂肪氧化指标测定
1.3.3.1 过氧化值(peroxide value,POV)测定
参照GB/T 5538—2005《动植物油脂过氧化值测定》方法。
1.3.3.2 TBARS值测定
按照Salih等[9]的方法进行测定。一定量样品解冻,称取5g于80mL离心管中,加25mL 20%三氯乙酸(TCA)和20mL 水,在冰水浴中用高速分散机以3000r/min匀浆60s,静置1h,然后在2000r/min、4℃条件下离心10min、过滤,滤液用双蒸水定容到50mL,然后取2mL滤液加2mL 0.02mol/L硫代巴比妥酸(TBA)在沸水浴中反应20min,取出用流动水冷却5min,于532nm波长处测定吸光度。空白样:取25mL 20% TCA用双蒸水定容到50mL,然后取2mL滤液加2mL TBA。TBARS值的测定以丙二醛(MDA)为标准品,结果以每千克样品中MDA的毫克数来表示,记为mg MDA/kg。
1.3.4 总脂肪的提取
根据Folch等[10]方法。取5.0g肌肉切碎,称取2.0g于离心管加25mL的氯仿-甲醇溶液(体积比2:1),匀浆60s转移到带塞量筒中定容到40mL,静置0.5h过滤除去蛋白、结缔组织,加0.22倍体积的盐水(根据肌肉中水分含量估算加入量,使氯仿、甲醇、水体积比8:4:3(有利于提取脂质),3000r/min离心15min,吸净上层液体(水、甲醇、离子杂质),剩余液体转移至平底烧瓶,用旋转蒸发器在40℃水浴5~10min真空蒸干溶剂,残留物于-20℃贮存备用。
1.3.5 游离脂肪酸分离及气相色谱(GC)分析
根据Garcia Regueiro等[11]方法分离游离脂肪酸并稍作修改。称取30~60mg脂肪,溶解于5mL的氯仿-甲醇溶液中,然后用100mg的氨丙基硅柱分离,先用5mL的氯仿-异丙醇溶液(体积比2:1)洗出中性脂质,再用5mL质量分数2%乙酸-乙醚溶液洗出游离脂肪酸,最后用5mL甲醇-盐酸溶液(体积比9:1)洗出磷脂。洗脱过程中分别用事先干燥、称过质量的10mL离心管收集各部分脂质,并用氮气吹干其中的溶剂,然后再分别称其质量,计算出各部分脂质在总脂肪中的百分含量。
GC条件:DB23柱石英毛细柱(60m×0.25mm,0.25μm);进样口温度240℃,火焰离子检测器(FID)温度240℃,升温程序:90℃保持2min,以10℃/min升至180℃,保持5min;以5℃/min升至240℃,保持12min;载气(N2)流速1mL/min,压力60kPa,进样量1μL;分流比70:1。
1.3.6 脂肪酶的提取及其酶活力测定
1.3.6.1 酶液提取
参照Hernondez等[12]的方法,稍作改动。一定量样品于室温下解冻,精确称取5.000g样品,加入25mL浓度为50mmol/L、pH7.5磷酸缓冲液(含乙二醇双四乙酸(EGTA)浓度为5mmol/L)。在冰水浴中用高速分散机于25000r/min均浆4×10s,然后在冰水浴中匀速搅拌30min,之后于4℃、10000r/min离心20min,用玻璃纤维过滤除去上层脂肪,并用抽提缓冲液定容到25mL,对该液采用双缩脲法测其蛋白质含量,分析酶活力。
1.3.6.2 中性脂肪酶活力测定
参照Vestergaard等[13]方法,稍作修改。量取0.1mL酶提取液加入到2.8mL pH7.5的0.22mol/L Tris-HCl缓冲液(含有0.05g/100mL Triton X-100)中,之后加入0.1mL、1.0mmol/L的4-甲基伞形酮油酸酯作底物,于37℃保温30min,立即于冰水浴中冷却,并用酶标仪于λex=3 28 nm、λem=455nm波长处测荧光度。空白样采用同体积的提取酶所用的缓冲液代替酶液。
1.3.6.3 酸性脂肪酶活力测定
采用Vestergaard等[13]的方法。量取0.1mL酶提取液加入到2.8mL pH5.0的0.1mol/L磷酸氢二钠-0.05mol/L柠檬酸缓冲液(含有0.05g/100mL Triton X-100和0.8mg/mL牛血清白蛋白(BSA))中,之后加入0.1mL、1.0mmol/L的4-甲基伞形酮油酸酯作底物,于37℃保温30min,立即用0.5mL、1mol/L的盐酸终止反应,用酶标仪在λex=328nm、λem=455nm波长处测荧光度。空白样同样采用同体积的提取酶所用的缓冲液代替酶液。
1.3.6.4 磷脂酶活力测定
采用Motilva等[14]的方法,稍作修改。量取0.1mL酶提取液加入到2.8mL、pH5.0的0.1mol/L磷酸氢二钠-0.05mol/L柠檬酸缓冲液(含有150mmol/L的氟化钠,0.05g/100mL Triton X-100和0.8mg/mL BSA)中,之后加入0.1mL、1.0mmol/L的4-甲基伞形酮油酸酯作底物,于37℃保温30min,立即用0.5mL、1mol/L的盐酸终止反应,用酶标仪在λex=350nm、λem=445nm波长处测荧光度。空白用同体积的提取酶所用缓冲液代替酶液。
酶活力采用标准曲线法进行计算,分别用以上3种酶测定所用缓冲液配制系列浓度的4-甲基伞形酮溶液作标准曲线,1个酶活力单位定义为:在37℃条件下,1g酶蛋白在1h内产生1nmol的4-甲基伞形酮为1个酶活力单位(U)。
1.3.7 LOX提取及其活力测定
参照Gata等[15]的方法。
1.4 数据统计分析
利用Origin8.0作图,用SAS 8.2(SAS Institute Inc.,Cary, North Carolina,USA)统计软件进行方差分析,不同平均值之间利用Fisher’s最小显著差异法(LSD)进行差异显著性检验。
2 结果与分析
2.1 鲈鱼风干成熟过程中主要理化指标的变化
由表2可以看出,鲈鱼风干工艺过程中水分含量呈下降趋势,到风干成熟结束,样品水分含量为45.35%,相比原料下降了42.05%,鲈鱼肌肉中的水分在腌制及风干前期因食盐的渗透作用而析出,水分含量下降,且腌制期间下降速度显著(P<0.05),风干中后期下降速度缓慢;鲈鱼风干过程中水分丧失导致鲈鱼肌肉中水分活度降低,水分活度对酶促反应有重要影响,一方面影响酶促反应底物的可移动性[16],另一方面影响酶的构象[17]。鲈鱼风干后期水分丧失很快,水分活度也会伴随大幅降低,使肌肉中的溶解氧含量降低[18],可能对脂质氧化具有一定的阻滞作用。
表2 鲈鱼风干加工过程中理化指标变化(±s,n=3)Table 2 Change of physico-chemical indices in dry-cured perch during processing (±s,n=3)

表2 鲈鱼风干加工过程中理化指标变化(±s,n=3)Table 2 Change of physico-chemical indices in dry-cured perch during processing (±s,n=3)
注:以肌肉为基质;同行上标字母不同表示差异显著(P<0.05)。
5.5水分含量/% 77.40±0.48a 72.07±2.18b 65.72±2.09c 59.17±0.39d 46.17±3.25e 45.35±2.45e pH 6.58±0.04a 6.52±0.01ab 6.51±0.02ab 6.46±0.04bc 6.40±0.03c 6.39±0.04c盐分含量/% 0.10±0.02f 1.69±0.04e 2.51±0.00d 2.80±0.00c 3.88±0.04b 3.98±0.06a理化指标 工艺时间/d 0 2 3 4 5
pH值在腌制及风干成熟阶段下降显著(P<0.05),由原料(pH6.58)到风干成熟结束(pH6.39)相对下降了0.19,与Nakagawa等[19]在鲭鱼片干燥过程pH值变化基本一致,工艺过程中脂肪水解,FFA积累导致pH值下降[20],另外鲈鱼肌肉中碳水化合物水解,乳酸、磷酸积累也会使pH值下降[21];食盐是水产品加工最常用的添加剂,对产品的风味及理化品质有着非常重要的影响。鲈鱼肌肉中NaCl含量在整个工艺过程中呈上升趋势,腌制阶段由于食盐渗透而显著增加,干燥阶段随水分丧失而进一步增加,变化显著(P<0.05),最终样品盐分含量为3.98%。
2.2 鲈鱼风干成熟过程中肌肉脂肪酶活力及脂肪组成的变化

图1 鲈鱼风干过程中脂肪酶活力变化情况Fig.1 Change of hydrolytic enzymes in dry-cured perch during processing
由图1可知,鲈鱼风干成熟过程中脂肪酶活力均呈下降趋势且变化显著(P<0.05),中性脂肪酶和酸性脂肪酶活力在工艺时间0~2d阶段无显著变化(P>0.05),工艺后期中性脂肪酶和酸性脂肪酶活力下降趋势明显(P<0.05),样品中酸性脂肪酶、中性脂肪酶活力相比于原料分别下降了69%和39%;磷脂酶的活力在整个工艺过程中显著降低(P<0.05)。鲈鱼整个加工过程中中性脂肪酶的活力高于酸性脂肪酶和磷脂酶活力,腌制过程中中性脂肪酶活力无显著变化(P>0.05),而酸性脂肪酶和磷脂酶活力显著降低(P<0.05),可能是腌制过程中盐分升高,对酸性脂肪酶和磷脂酶活力有一定的抑制作用,Andres等[22]认为一定范围内,盐分对脂肪质水解有一定的促进作用,可能是盐分含量对中性脂肪酶活力有益,这也就解析了中性脂肪酶活力在腌制阶段并没有显著下降;鲈鱼肌肉中性脂肪酶活力始终高于酸性脂肪酶和磷脂酶活力,表明中性脂肪酶在鲈鱼脂肪水解中起主要作用。
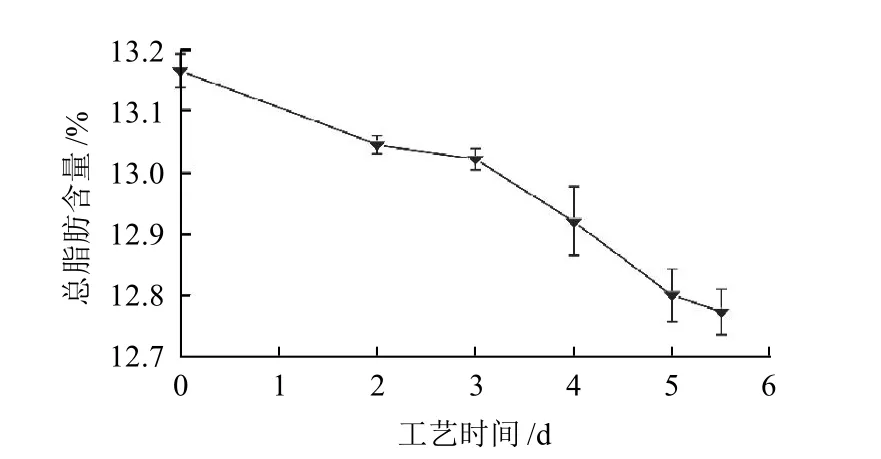
图2 鲈鱼风干工艺过程中总脂肪含量变化Fig.2 Change of total lipid in dry-cured perch during processing

图3 鲈鱼风干工艺过程中脂肪组成变化情况Fig.3 Change of lipid compositions in dry-cured perch during processing
如图2所示,鲈鱼肌肉总脂肪含量在腌制、风干成熟阶段显著下降(P<0.01),到风干成熟结束样品中总脂肪含量为12.77%,相对原料阶段下降了2.96%,说明鲈鱼风干工艺过程中脂质发生了强烈分解;从图3可知,中性脂质在鲈鱼总脂肪中占主导地位,腌制和风干阶段含量由63.45%显著下降至55.85%(P<0.05);磷脂含量在腌制过程中显著上升(P<0.05),风干阶段呈下降趋势;总游离脂肪酸含量在工艺前3 d显著上升(P<0.05),风干后期趋于平缓无显著变化,说明风干后期脂肪酸氧化速率与脂质分解速度趋于一致。
鲈鱼风干工艺工程中肌肉FFA含量变化是个动态过程,一方面磷脂和甘油酯分解生成FFA,FFA含量增加,另一方面FFA氧化成小分子风味化合物,其含量减少。鲈鱼风干过程中肌肉游离脂肪酸含量的变化见表3,饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)含量在风干过程中有显著变化(P<0.05),鲈鱼肌肉中FFA含量在工艺过程中呈上升趋势;鲈鱼工艺过程中温度的升高使鲈鱼肌肉中水分含量显著降低(P<0.05),氯化钠含量显著升高(P<0.05),高盐会抑制脂肪分解酶活力,影响脂质分解速率,间接提高了脂肪氧化速率, FFA含量从工艺时间4d起无显著变化(P>0.05)。
棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)、二十碳五烯酸(C20:5)和二十二碳六烯酸(C22:6)是FFA的主体成分,从表3可以看出,在鲈鱼风干结束时分别占∑FFA的23.95%、14.69%、17.01%、15.42%和21.22%。SFA含量在风干1d时达到最大值,风干后期基本维持不变,整个风干过程中SFA含量与原料相比增加了3.50%,其中棕榈酸(C16:0)变化较大,增加了2.26%;MUFA含量在鲈鱼风干过程中呈上升趋势,样品总MUFA含量增加了2.23%,其中油酸(C18:1)增加最多,为2.16%; PUFA含量在鲈鱼风干过程中呈显著上升趋势(P<0.05),风干结束时PUFA含量与原料相比增加了5.84%,主要是二十二碳六烯酸(C22:6)和和二十碳五烯酸(C20:5)在风干过程中含量显著上升,这些多不饱和脂肪酸是鱼类中所特有的FFA,饮食中合理摄入有利于人类健康。这些变化除了取决于脂肪分解程度之外,与FFA氧化、成酯反应密切相关,这是因为FFA既是脂质分解一级产物,又是二级反应如脂质氧化和脂质与蛋白质之间反应等的前体物质,第二级反应是形成风味物质的主要反应。FFA与脂质氧化产生的醇发生反应生成的挥发性酯,可以赋予样品果香甜味的特征,长链的脂肪酸所产生的酯则会产生一种更具脂香特征的风味[23],因此FFA组成和含量对风鱼特征性风味具有重要贡献。
2.3 鲈鱼风干成熟过程中脂质氧化变化
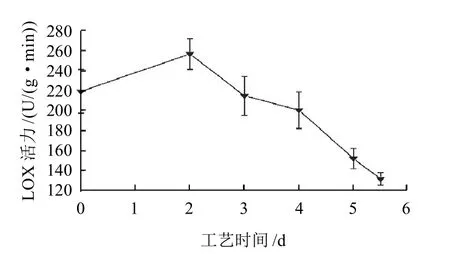
图4 鲈鱼风干工艺过程中LOX活力变化情况Fig.4 Change of lipoxygenase activity in dry-cured perch during processing
由图4可知,脂肪氧合酶的活力在腌制阶段呈上升趋势(P<0.05),腌制结束达到最大值256.07U/(g·min),腌制过程中LOX活力迅速增加,与腌制过程中水分渗出,盐分含量升高有关,因为在一定浓度范围内,盐分对LOX活力有促进作用。风干成熟阶段呈下降趋势,样品风干成熟结束时样品中脂肪氧合酶的活力比原料中脂肪氧合酶的活力降低了54.79%。

图5 鲈鱼风干工艺过程中脂质氧化情况Fig.5 Change of lipid oxidation in dry-cured perch during processing
由图5可知,鲈鱼风干成熟过程中POV值和TBARS值变化趋势基本一致,POV值变化波动比较大,在腌制及风干成熟阶段(风干成熟5.5d)显著上升(P<0.01),到风干成熟阶段第4天时达到了整个加工过程的最大值14.81meq/kg,这与Pacheco-Aguilar等[24]对沙丁鱼0℃贮藏过程中变化趋势基本一致,样品POV值低于感官可接受标准(POV值≤20meq/kg)。鲈鱼风干成熟过程中POV值呈先上升后下降变化趋势,一方面说明脂肪氧合酶活力虽下降但活力依然很高,对鲈鱼风干过程中脂质氧化有重要影响,另一方面说明脂质氧化包括酶促氧化和非酶促氧化,因为相比酶促氧化的底物特异性,非酶促氧化没有底物特异性[25],且可以被风干过程中温度、光、金属离子等因素诱导[10],因而非酶促氧化可能在鲈鱼风干成熟过程中对脂质氧化有重要贡献。郇延军等[26]对传统金华火腿加工过程中脂质的氧化情况研究也发现由LOX引起的酶促氧化对整个氧化的贡献率不到20%,大部分的氧化还是非酶促氧化。

表3 鲈鱼风干工艺过程肌肉中FFA含量的变化Table 3 Change of free fatty acid contents in muscle of dry-cured perch during processing
TBARS值在腌制、风干初期中显著上升(P<0.05),风干后期显著下降(P<0.05),终样品的TBARS值为2.99mg MDA/kg;风干成熟后期TBARS值显著降低,说明此阶段二级氧化产物醛类物质的分解速率高于氧化产物生成速率,更多醛类物质参与小分子风味化合物的形成,可知风干后期是风鱼特征性风味积累的重要阶段。鲈鱼腌制阶段POV值和TBARS值都显著增加,说明腌制阶段脂肪就开始剧烈的分解氧化反应,到风干第4天POV值和TBARS值达到最大,后随着温度升高,脂质氧化产物的形成速率小于降解速率,氧化产物发生进一步降解生成酸类物质、内酯等风味成分,POV值和TBARS值开始降低,说明风干后期高温可以加快脂质氧化速率,促进风味化合物的形成。
3 结 论
鲈鱼腌制风干成熟工艺过程中理化指标(水分、盐分、pH值)变化影响肌肉内源酶活力,并对脂质水解氧化有显著影响。3种脂肪酶活力在鲈鱼腌制风干成熟过程中都呈持续下降趋势,且中性脂肪酶活力高于酸性脂肪酶和磷脂酶活力,是主要的脂肪分解酶。鲈鱼腌制风干过程中中性脂和磷脂相对含量在加工过程中显著降低(P<0.05),游离脂肪酸(∑FFA)特别是多不饱和脂肪酸EPA和DHA含量显著上升(P<0.05),其中棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)、二十碳五烯酸(C20:5)和二十二碳六烯酸(C22:6)是FFA的主体成分。脂肪氧合酶对脂质氧化有重要作用,其活力在整个加工成熟中呈下降趋势,但POV值和TBARS值在鲈鱼风干成熟过程中均先上升后下降,说明风干后期高温可以加快脂质氧化产物的分解,促进风鱼特征性风味化合物形成,同时降低脂质氧化,进一步推测非酶促氧化在鲈鱼风干成熟过程中脂质氧化也有重要贡献。
[1] 谭汝城. 腌腊鱼生产工艺优化及其对风味影响的研究[D]. 武汉: 华中农业大学, 2004.
[2] 邹建春, 赵俊仁, 张蓉. 风干武昌鱼中微生物变化及理化性质的分析[J]. 安徽农业科学, 2010, 38(28): 16024-16025; 16028.
[3] 张会丽, 余翔, 张弘. 鲈鱼风干成熟工艺及对蛋白质水解和感官品质影响[J]. 食品科学, 2010, 31(16): 47-51.
[4] ZHANG Jianhao, JIN Guofeng, WANG Jiamei. Effect of intensifying high-temperature ripening on lipolysis and lipid oxidation of Jinhua ham[J]. LWT-Food Science and Technology, 2011, 44(2): 473-479.
[5] JIN Guofeng, ZHANG Jianhao, YU Xiang, et al. Lipolysis and lipid oxidation in bacon during curing and drying-ripening[J]. Food Chemistry,2010, 123(2): 465-471.
[6] TRIQUI R, REINECCIUS G A. Changes in flavor profiles with ripening of anchovy (Engraulis encrasicholus)[J]. Journal of Agricultural and Food Chemistry, 1995, 43(7): 1883-1889.
[7] WOOD J D, RICHARDSON R I, NUT G R, et al. Effects of fatty acids on meat quality: a review[J]. Meat Science, 2004, 66(1): 21-32.
[8] GLADYSHEV M I, SUSHCHIK N N, GUBANENKO G A, et al. Effect of way of cooking on content of essential polyunsaturated fatty acids in muscle tissue of humpback salmon(Oncorhynchus gorbuscha)[J]. Food Chemistry, 2006, 96(3): 446-451.
[9] SALIH A M, AMITH D M, PRICE J F, et al. Modified extraction 2-thiobarbituric acid method for measuring lipid oxidation in poultry[J].Poultry Science, 1987, 66: 1483-1488.
[10] FOLCH J, LEES M, STANLENY G H S. A sample method for the isolation and purification of total lipids from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509.
[12] HERNANDEZ P, NAVARRO J L, TOLDRA F. Lipid composition and lipolytic enzyme activities in porcine skeletal muscles with different oxidative pattern[J]. Meat Science, 1998, 49(1): 1-10.
[13] VESTERGAARD C S, SCHIVAZAPPA C, VIRGILI R. Lipolysis in dry-cured ham maturation[J]. Meat Science, 2000, 55(1): 1-5.
[14] MOTILVA M J, TOLDA F, FLORES J. Assay of lipase and esterase activities in fresh pork meat and dry-cured ham[J]. Zeitschrift fur Lebensmittel Untersuchung und-Forschung, 1992, 195(5): 446-450.
[15] GATA J L, PINTO M C, MACS P. Lipoxygenase activity in pig muscle: purification and partial characterization[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2573-2577.
[16] VARLET V, PROST C, SEROT T. Volatile aldehydes in smoked fish:Analysis methods,occurence and mechanisms of formation[J]. Food Chemistry, 2007, 105(4): 1536-1556.
[17] JONSDOTTIRA R,LAFSDOTTIR G, CHANIE E, et al. Volatile compounds suitable for rapid detection as quality indicators of cold smoked salmon(Salmo salar)[J]. Food Chemistry, 2008, 109(1): 184-195.
[19] NAKAGAWA R, NOTO H, YASOKAWA D, et al. Microbiological and chemical changes during the industrial soft-drying process of “migakinishin,, herring[J]. Journal of Japanese Society for Food Science and Technology, 2007, 54(1): 26-32.
[20] SHAH A K M A, TOKUNAGA C, KURIHARA H, et al. Changes in lipids and their contribution to the taste of migaki-nishin (dried herring fillet) during drying[J]. Food Chemistry, 2009, 115(3): 1011-1018.
[21] VISESSANGUAN W, BENJAKUL S, YARCHAI M, et al. Changes in lipid coposition and fatty acid profile of Nham, a thai fermented pork sausage[J]. Food chemistry, 2006, 94(4): 580-588.
[22] ANDRES A I, CAVA R, MARTIN D, et al. Lipolysis in dry-cured ham:influence of salt content and processing conditions[J]. Food Chemistry,2005, 90(4): 495-896.
[23] KARSTEN H, PIA L, LOTTE F, et al. Dynamic headspace gas chromatography/mass spectrometry characterization of volatiles produced in fish oil enriched mayonnaise during storage[J]. Journal of Agricultural and Food Chemistry, 2000, 48 (10): 4858-4867.
[24] PACHECO-AGUILAR R, LUGO-SANCHEZ M E, ROBLESBURGUEO M R. Postmortem biochemical and functional characteristic of Monterey sardine muscle stored at 0 ℃[J]. Journal of Food Science,2000, 65(1): 40-47.
[25] MORRISSERY P A, SHEEHY P J A, GALVIN K, et al. Lipid stability in meat and meat products[J]. Meat Science, 1998, 49(1): 73-86.
[26] 郇延军, 周光宏, 徐幸莲, 等. 金华火腿生产过程中脂质氧化及脂肪氧合酶变化特点研究[J]. 食品科学, 2008, 29(3): 60-64.
Lipolysis and Lipid Oxidation in Perch during Curing and Air Drying Ripening
LIU Chang-hua,ZHANG Jian-hao*,WANG Yan
(National Central of Meat Quality and Safety Control, Key Laboratory of Meat Processing and Quality Control, Ministry of Education,Key Laboratory of Agricultural and Animal Products Processing and Quality Control, Ministry of Agriculture, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Perch was used as the material to prepare dry-cured perch through dry-salting and drying-ripening process. In order to explore the rule of lipolysis and lipid oxidation during the preparation process, the change of lipid compositions, lipase,lipoxygenase (LOX), thiobarbituric acid reactive substance value (TBARS) and peroxide value (POV) in perch muscle samples were measured. The results showed that lipid compositions revealed a significant decrease (P<0.05) in neutral lipid and phospholipids, and a significant increase in free fattty acid (FFA) (P<0.05). Palmitoleic acid(C16:0), stearic acid(C18:0), oleic acid(C18:1), eicosapentaenoic acid(C20:5) and docosahexaenoic acid(C22:6) were major fatty acids. The activities of three lipases exhibited a significant decrease during preparation process (P<0.05), among which phospholipase activity had the largest decline. Neutral lipase always showed higher activity than acidic lipase and phospholipase (P<0.05), while LOX activity revealed a gradual decrease during drying-ripening period. Both POV and TBARS value exhibited an initial increase and then a final decrease in the whole process. Therefore, high temperature in the post-drying process could effectively promote the hydrolysis of lipid-oxidized products and accelerate the development of flavor.
perch;drying-ripening;lipase;lipoxygenase;lipolysis and lipid oxidation
TS254.1
A
1002-6630(2012)05-0013-06
2011-09-02
2009年国家公益性农业科研专项项目(200902012)
刘昌华(1987—),男,硕士研究生,研究方向为畜产品加工与质量控制。E-mail:2009108069@njau.edu.cn
*通信作者:章建浩(1961—),男,教授,博士,研究方向为畜产品加工与质量控制。E-mail:nau_zjh@njau.edu.cn
