Chelex法结合环介导间接聚合酶链式反应检测肉制品单增李斯特菌
2012-10-25边传周刘仲敏
郑 鸣,边传周,刘仲敏
(1.郑州牧业工程高等专科学校,河南 郑州 450011;2.河南省科学院生物研究所有限责任公司,河南 郑州 450008)
Chelex法结合环介导间接聚合酶链式反应检测肉制品单增李斯特菌
郑 鸣1,边传周1,刘仲敏2
(1.郑州牧业工程高等专科学校,河南 郑州 450011;2.河南省科学院生物研究所有限责任公司,河南 郑州 450008)
目的:建立肉制品中单增李斯特菌环介导间接聚合酶链式反应检测体系,实现快速检测。方法:采用Chelex法从肉制品中分离模板DNA,根据单增李斯特菌hlyA基因的保守区设计两条探针,将探针标记于报告基因(大豆Lectin基因)的两端,此标记的报告基因与待测靶基因经杂交、缺口补平、环化后,采用反向聚合酶链式反应扩增报告基因,实现对靶基因的检测。结果:该检测体系检出限低于100CFU/g(mL),且与其他食源性致病菌的检测无明显交叉反应,对200份肉制品进行检测,阳性率为2.5%,与传统细菌分离检测结果完全相符。结论:环介导间接聚合酶链式反应可以快速、灵敏、特异检测肉制品中单增李斯特菌污染。
环介导间接聚合酶链式反应;肉制品;单增李斯特菌
单增李斯特菌是常见的食源性致病菌,可引起食源性李斯特菌病,致死率高达30%以上[1-4],被列为21世纪对我国人民卫生健康具有重大影响的12种病源微生物之一。自从单增李斯特菌引起的食品中毒事件被首次确认以来[5-6],人们就致力于对其检测方法的研究[7-9]。传统分离培养和鉴定技术需要1~2周时间,人力物力花费大,不适宜实际检验工作的需要,因此单增李斯特菌的检测需要更灵敏、简便的分子生物学检测技术。本实验在传统聚合酶链式反应(polymerase chain reaction,PCR)基础上建立一种全新的PCR检测技术,即环介导环间接PCR,旨在建立一种快速、准确检测食品中单增李斯特菌的方法,以提高对细菌性食物中毒突发公共卫生事件快速反应能力及加入WTO对外食品贸易发展的新需要。其基本原理(图1)是:将两段相邻的特异性探针分别连接在一段无关的报告基因首尾两端,带探针的报告基因可通过首尾探针序列与待测模板互补杂交,从而使其首尾末端靠近,杂交体单链缺口经DNA聚合酶补平、耐热连接酶修复封闭,使报告基因DNA成环;再采用报告基因中间的序列为引物,反向扩增含探针的环状报告基因而实现对病原菌的间接检测。
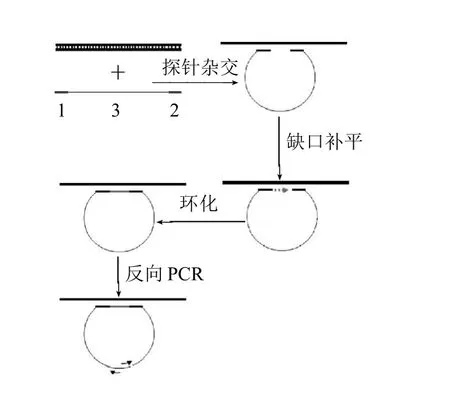
图1 环介导间接PCR基本实验原理Fig.1 Principle of loop-mediated indirect PCR
1 材料与方法
1.1 材料与仪器
鲜猪肉、鲜牛奶 郑州市购;单增李斯特菌标准株 中国食品药品检定研究院;单增李斯特菌分离株、肠毒性大肠埃希菌分离株、沙门氏菌分离株、大肠埃希氏菌O157∶H7分离株、志贺氏菌分离株和霍乱弧菌分离株 河南省科学院生物研究所微生物保藏中心(分离鉴定并保存),质粒pMD18-T- Lectin和大肠杆菌JM109则由本实验室保存。
Chelex-100 resin 美国bio-rad公司;ExTaq美国Takara公司;TSBYE 北京经科宏达生物公司;引物的合成有上海生工生物工程公司完成。
1.2 方法
1.2.1 细菌培养及计数
将霍乱弧茵则接种于碱性蛋白胨溶液(含蛋白胨5mg/mL,NaCl 10mg/mL、pH8.3)中,单增李斯特菌标准株、分离株及其他菌种均接种于TSBYE,37℃摇床培养过夜。取单增李斯特菌标准株培养液1mL,用无菌生理盐水进行10倍梯度稀释,涂布于TSA平板,37℃培养24h后计数。
1.2.2 人工污染样品的制备
采集市售鲜猪肉25g和鲜牛奶25mL(污染前利用传统培养法检测证实不含单增李斯特菌),加入无菌生理盐水至250mL,匀浆后加入单增李斯特菌标准株培养液,污染程度依次为 10-1、1、101、102、103、104、105CFU/mL,形成人工污染的样品。
1.2.3 模板DNA的制备
取5mL细菌培养液,12000×g离心5min弃上清液,沉淀中加入6% Chelex-100 resin 56℃水浴20min,旋涡振荡2min,煮沸8min,旋涡振荡2min后立即置冰上冷却5min,14000×g、4℃离心5min,上清液用作PCR模板;对于人工污染的肉制品匀浆液,取5mL样品,先经22μm的膜过滤,收集滤液进行下步的模板DNA制备操作。
1.2.4 环介导间接PCR扩增体系建立
1.2.4.1 报告基因的制备
采用常规PCR以质粒pMD18-T-Lectin为模板扩增大豆Lectin基因片段用作检测的报告基因,所用引物的5′端进行磷酸化修饰,上游引物序列:GGAATGGTGGAGAA CGGTAATTCAAGAAGCCTCATCACA;下游引物序列:GATGGACGATGTGAAATGAGCTTTCACCAGGGTTT AGTT,其中斜体部分为特异性探针,PCR反应体系总体积50μL,其中引物10pmol、dNTPs 0.25mmol/L、MgCl21.5mmol/L、质粒DNA模板1μL;Taq酶1.5U。扩增程序95℃预变性5min后,按下列程序扩增35个循环,95℃变性30s,50℃退火30s,72℃延伸30s。PCR产物用1.2%的琼脂糖凝胶进行电泳检测,同时进行胶回收纯化特异性探针耦联的报告基因。
1.2.4.2 报告基因环化及反向PCR
取单增李斯特菌标准株DNA溶液和制备好的特异性探针耦联的报告基因进行报告基因环化及反向PCR扩增,用于反向PCR扩增的引物为报告基因中间序列,P1:TATC CGG CGTGGTAAACT;P2:CCTCCAACCATGAAACTT,反应体系为30μL,其中引物10pmol,dNTPs 0.3mmol/L,10×TaqDNA Ligase Reaction Buffer 3μL,10×ExTaqBuffer 3μL,TaqDNA Ligase 0.3μL,Ex Taq 0.20μL,报告基因和标准株DNA溶液各3μL。反应分3步进行:首先,进行95℃变性5min;之后按95℃ 50s、60℃ 8min进行5个循环;最后按95℃ 30s、52℃ 30s、72℃ 30s进行25个循环,PCR结束后立即进行琼脂糖凝胶电泳检测,并进行PCR产物克隆测序,序列测定由上海生工生物工程公司完成。
1.2.5 环介导间接PCR检测体系的评估
特异性实验:以制备的各种菌株的DNA作为模板进行环介导间接PCR检测,PCR反应体系及反应条件同1.2.4.2节,PCR产物用1.2%的琼脂糖凝胶进行电泳检测,并进行T/A克隆,序列测定由上海生工生物工程公司完成。
敏感性实验:取单增李斯特菌标准株培养液,用无菌生理盐水稀释成 101、102、103、104、105、106、107、108CFU/mL,然后采用Chelex法制备模板DNA,进行环介导间接PCR反应,检测反应的灵敏度。
人工污染样品的环介导间接PCR检测:将上述不同污染程度的鲜肉和牛奶样品采用Chelex法进行模板DNA制备,进行环介导间接PCR扩增,PCR反应体系及反应条件同1.2.4.2节。
1.2.6 环介导间接PCR检测应用
将200份肉制品样品各25g进行环介导间接PCR检测和传统微生物检测,比较二者之间的符合率。
2 结果与分析
2.1 环介导间接PCR扩增体系的建立
2.1.1 报告基因的标记
以pMD18-T-Lectin质粒作为模板进行PCR扩增,电泳检测发现,在250~500bp之间可见一清晰条带(图2),与378bp的预期片段大小相符,将此片段回收进行克隆测序,结果发现两端为特异性探针序列,中间序列为大豆Lectin基因片段(图3),由此说明特异性探针耦联的报告基因制备成功。
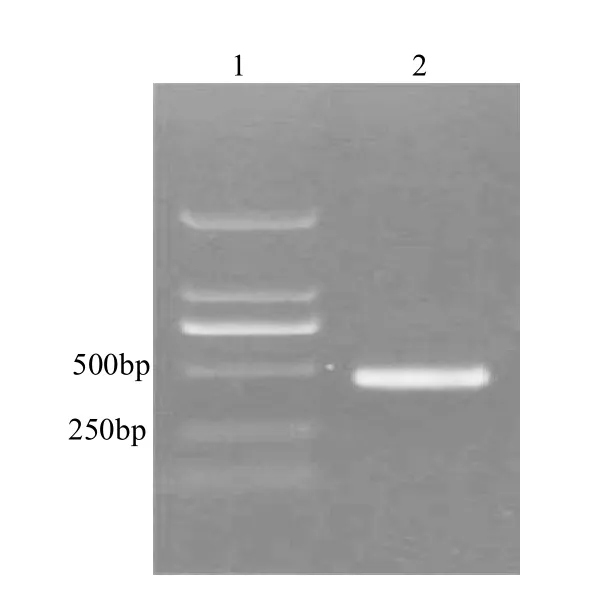
图2 报告基因的标记Fig.2 Label result of reporter gene

图3 标记的报告基因序列Fig.3 Sequence of the labeled reporter gene
2.1.2 报告基因环化及反向PCR
单增李斯特菌标准株的DNA与报告基因的DNA经过杂交、修复、连接环化及反向PCR扩增后,电泳结果发现在500bp附近有一清晰条带(图4),与预计的PCR产物440bp大小相符,将该PCR产物进行测序分析,结果显示该PCR产物两端为大豆Lectin基因片段,而中间为单增李斯特菌hlyA基因片段,与设想完全一致,由此可说明该方法可行。
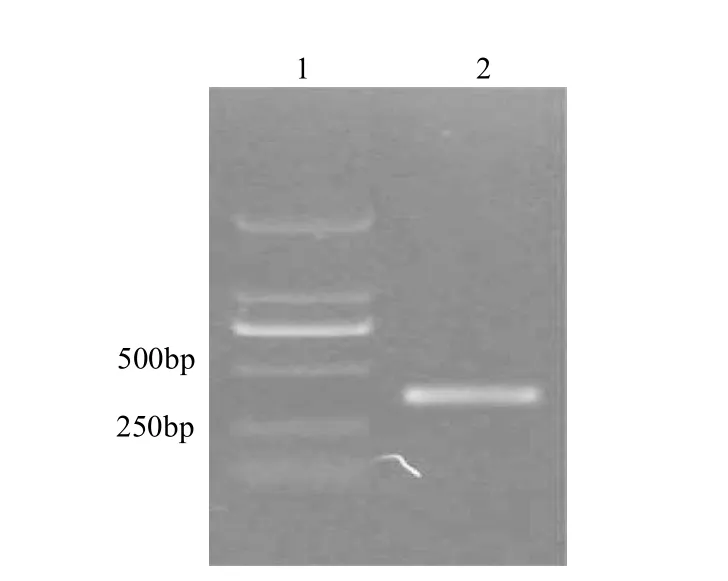
图4 报告基因的反向PCR扩增结果Fig.4 Reverser PCR result of the reporter gene
2.2 环介导间接PCR扩增体系的评估
2.2.1 特异性实验
以不同菌株的DNA作为模板进行环介导间接PCR扩增,琼脂糖电泳检测,结果如图5所示,单增李斯特菌标准株及分离株在500bp处均有特异性扩增片段,与440bp的预期片段相符,而其他非单增李斯特菌则检测不到特异性扩增片段,将该片段进行测序分析,结果显示该PCR产物两端为大豆Lectin基因片段,而中间为单增李斯特菌hlyA基因片段,与设想完全一致。由此说明该方法特异性较高,符合实验要求。

图5 环介导间接PCR特异性分析Fig.5 Specificity analysis result of loop-mediated indirect PCR
2.2.2 敏感性实验
用Chelex法从单增李斯特菌标准株培养液不同浓度稀释液制备的模板DNA,进行环介导间接PCR扩增检测,结果菌液浓度为10CFU/mL时仍然可以检测到目的片段(图6),因此环介导间接PCR对单增李斯特菌的灵敏度可达到10CFU/mL。

图6 环介导间接PCR敏感性分析Fig.6 Sensitivity analysis result of loop-mediated indirect PCR
2.2.3 人工污染样品的PCR检测
按照1.2.4节的方法,用Chelex法直接从污染样品中分离DNA,进行环介导间接PCR检测,用1.2g/100mL的琼脂糖凝胶电泳检测,结果如图7所示,人工污染的鲜肉和牛奶检测的灵敏度均为10CFU/mL,与纯菌悬液检测的灵敏度相当,通过计算可知该方法对鲜肉制品和牛奶制品检测的灵敏度可达100CFU/g(mL)。
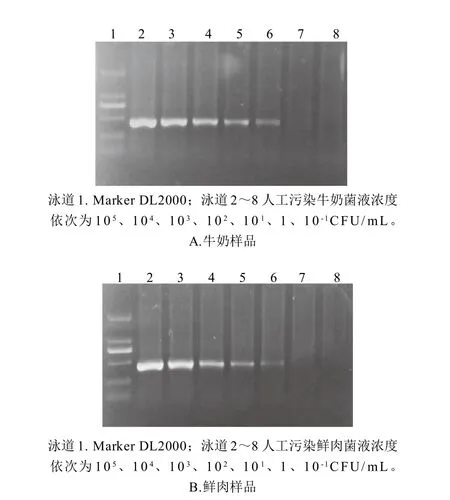
图7 人工污染样品的环介导间接PCR检测结果Fig.7 Detection result of the artificially contaminated samples by the loop-mediated indirect PCR
2.3 环介导间接PCR检测应用
将采购的200份不同肉制品进行单增李斯特菌环介导间接PCR检测,共检测出阳性样本5份,阳性率为2.5%,环介导间接PCR检测结果采取传统的培养法进行验证,结果完全一致,两种方法检测的符合率为100%,结果见表1。
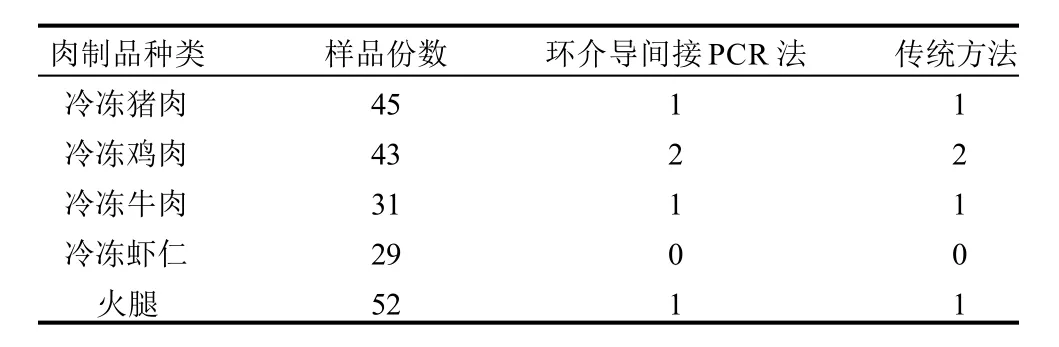
表1 各种肉制品检测结果Table 1 Detection result of meat products
3 讨 论
本实验通过一步链置换反应,将靶基因的检测转换为报告基因的检测,由于用到的报告基因为大豆Lectin基因,其与各种食源性致病菌遗传背景差异大,避免了因污染而导致的假阴性和假阳性,扩增背景单一,与肠毒性大肠埃希菌、沙门氏菌、大肠埃希氏菌O157∶H7、志贺氏菌和霍乱弧菌等食源性微生物的检测无交叉反应,特异性好。另外,由于各种肉制品成分复杂,且含有较强的PCR扩增强抑制因子,使得PCR检测单增李斯特菌灵敏度受样本影响大[10-11],为了获得理想而稳定的检测灵敏度,文献报道的各种PCR检测方法均需要对样品进行增菌[12-13],检测时间长。本实验采用Chelex结合膜过滤分离模板DNA,Chelex-100是一种离子交换树脂,可螯合金属离子,防止高温对DNA损伤,在碱性和煮沸条件下促使DNA从细胞中释放出来,从而达到既可保护DNA又能减少PCR扩增抑制因子的目的,提高了PCR检测灵敏度。在不增菌的情况下,利用该技术对模拟的鲜肉和牛奶样品检测灵敏度与纯菌液检测灵敏度无异,均低于10CFU/mL,对应于鲜肉制品和牛奶制品检测的灵敏度为100CFU/g(mL),符合国际上对食源性单增李斯特菌的检测要求,在保证检测灵敏度的基础上缩短了检测时间;对送检的200份肉制品进行检测,检出阳性样本5份,与传统方法检测结果一致,但工作量大幅降低,实现了对单增李斯特菌特异、灵敏和快速检测,为致病菌的快速排查,防止受到污染的食品扩散,阻止可能的单增李斯特菌爆发性流行提供了可靠的保证。
[1] ERICSSON H, STALH,ANDSKE P. PCR detection ofListeriamonocytogenesin ‘gravad’ rainbow trout[J]. Int J Food Microbiol, 1997,35(3)∶ 281-285.
[2] SAMELIS J, METAXOPOULOS J. Incidence and principal sources ofListeriaspp. andListeria monocytogenescontamination in processed meats and a meat processing plant[J]. Food Microbiol, 1999, 16(5)∶465-477.
[3] BULA C J. An epidemic of food-borneListeriosisin Western Suitzertand[J]. Clin infect Dis, 1995, 20(1)∶ 66-72.
[4] PECCIO A, AUTIO T, KORKEALA H, et al.Listeria monocytogenesoccurrence and characterization in meat-producing plants[J]. Lett Appl Microbiol, 2003, 37(3)∶ 234-238.
[5] DALTON C B, AUSTIN C C, SOBEL J, et al. An outbreak of gastroenteritis and fever due toListeria monocytogenesin milk[J]. N Engl J Med, 1997, 336(2)∶ 100-105.
[6] FARBER J M, PETERKIN P I.Listeria monocytogenes, a food-borne pathogen[J]. Microbiol Rev, 1991, 55(3)∶ 476-511.
[7] 丁建英, 韩剑众. 食品中单增李斯特菌的存在现状及检测方法研究进展[J]. 食品研究与开发, 2008, 29(12)∶ 171-174.
[8] FUKUSHIMA H, TSUNOMORI Y, SEKI R. Duplex real-time SYBR Green PCR assays for detection of 17 species of food- or waterborne pathogens in stools[J]. J Clin Microbiol, 2003, 41(11)∶ 5134-5146.
[9] KLEIN D. Quantification using real-time PCR technology∶ applications and limitations[J]. Trends Mol Med, 2002, 8(6)∶ 257-260.
[10] 孙唏, 吴建中, 张宁, 等. 荧光实时定量PCR检测单核李斯特菌方法学建立及应用[J]. 实用预防医学, 2005, 12(3)∶ 496-497.
[11] 刘仲敏, 郑鸣,王永芬. 食源性单增李斯特菌的实时定量PCR检测[J]. 食品与发酵工业, 2007, 33(5)∶ 100-104.
[12] BHAGWAT A A. Simultaneous detection ofEscherichiacoli O157∶H7,Listeria monocytogenesandSalmonellastrains by real-time PCR[J].Food Microbiol, 2003, 84(2)∶ 217-224.
[13] ROSSEN L P, NORSKOY K, HOLMSTROM K, et al. Inhibition of PCR by components of food samples, microbial diagnostic assays and DNA-extraction solutions[J]. Food Microbiol, 1992, 17(1)∶ 37-45.
Detection ofL. monocytogenein Meat Products Using Chelex DNA Extraction Combined with Loop-Mediated Indirect PCR
ZHENG Ming1,BIAN Chuan-zhou1,LIU Zhong-min2
(1. Zhengzhou College of Animal Husbandry Engineering, Zhengzhou 450011, China;
2. Biology Institute Co. Ltd., Henan Academy of Sciences, Zhengzhou 450008, China)
Objective∶ To develop a loop-mediated indirect PCR method for rapid detection ofL.monocytogenein meat products.Methods∶ Chelex-100 resin was used to directly extract template DNAs from meat products. Two probes targeted the conserved region ofhly Agene ofL.monocytogenewere designed according to the published sequences and used to label the Lectin gene fragment of soybean (reporter gene). After hybridization with target genes, gap filling and cyclization, the reporter gene was amplified by PCR for detecting the target genes. Results∶ The developed detection system showed a detection limit of lower than 100 CFU/g (mL) and had no obvious cross-reactivity with other foodborne pathogenic bacteria. The positive rate of 200 meat product samples was detected to be 2.5%, which was consistent with the result obtained by traditional bacterial separation. Conclusion∶The loop-mediated indirect PCR method allows the rapid, sensitive and specific detection of L.monocytogene contamination in meat products.
loop-mediated indirect PCR;meat products;L. monocytogene
TS201.3
A
1002-6630(2012)10-0190-05
2011-05-11
河南省重点科技攻关项目(092102110073)
郑鸣(1975—),男,讲师,硕士,研究方向为微生物遗传学。E-mail:floatingzm@163.com
