不同生长阶段鹿茸中胶原含量比较及提取条件优化
2012-10-25赵玉红金秀明王珊珊
赵玉红,金秀明,王珊珊
(东北林业大学林学院食品科学系,黑龙江 哈尔滨 150040)
不同生长阶段鹿茸中胶原含量比较及提取条件优化
赵玉红,金秀明,王珊珊
(东北林业大学林学院食品科学系,黑龙江 哈尔滨 150040)
以梅花鹿鹿茸为原料,研究不同生长阶段鹿茸中胶原含量及胶原提取效果并确定适宜提取条件。采用胃蛋白酶法提取胶原,采用Box-Behnken中心组合试验设计优化胶原提取条件。结果表明:二杠茸中胶原含量和得率均高于毛桃茸和三杈茸,分别为65.8mg/g和4.53%;胶原提取适宜工艺条件为提取时间52h、酶用量5%、液料比23:1(mL/g),在此条件下鹿茸胶原得率为5.92%。
鹿茸;胶原;提取;优化
胶原是一种结构蛋白,呈纤维状,是动物体内含量最多、分布最广的蛋白质。存在于结缔组织、皮肤、骨骼、内脏细胞间质及肌腔、韧带等部位,具有支撑器官、保护机体的功能[1]。研究表明胶原具有其他物质不可比拟的低抗原性、生物相容性和降解性[2],与人体生长、衰老息息相关,被广泛用于化妆品、生物医学、制药和食品等领域[3-4]。目前,生产胶原的原料主要是陆生哺乳动物(以猪、牛为主)的皮和骨,但因安全性和宗教禁忌等问题,制品的应用范围受到限制,因此,国际上胶原的提取开始转向从海洋等水生动物中提取。鹿茸是鹿科动物梅花鹿或马鹿的雄鹿未骨化密生茸毛的幼角[5],其在医药领域备受青睐。《神农本草经》中记载鹿茸“味甘、性温、主漏下恶血,寒热惊痢,益气强志,生齿不老”[6]。对多种鹿茸品系中化学成分的分析表明,鹿茸中粗蛋白质含量占干质量50%以上,而胶原是鹿茸中含量最高的蛋白质[7]。鹿茸不仅具有生长速度快、可再生的特点,而且具有广泛药理作用,因此鹿茸作为胶原提取原料不仅具有其他原料无法比拟的特点,而且可作为陆生动物源胶原蛋白的有益补充。李银清等[8]采用醇提法制备鹿茸胶原对大鼠成骨细胞有明显的促贴壁和增殖作用,对去势雌性大鼠骨质疏松症具有一定的治疗作用。徐云凤等[9]采用胰蛋白酶水解制备鹿茸胶原蛋白,并正交优化提取条件得胶原收率为12.52%。本实验采用胃蛋白酶法提取鹿茸胶原,比较不同生长阶段鹿茸中胶原含量的差异,并对胃蛋白酶法提取鹿茸胶原的工艺条件进行优化,为鹿茸胶原的研究和利用提供依据。
1 材料与方法
1.1 材料与试剂
梅花鹿茸(毛桃、二杠、三杈茸) 黑龙江省大庄园集团;胃蛋白酶、MD-44透析袋 美国Sigma公司;L-羟脯氨酸 北京索莱宝生物科技有限公司;冰乙酸、NaCl(均为分析纯) 南京建成生物科技有限公司。
1.2 仪器与设备
PHS-3C数显pH计 上海雷磁仪器厂;TDA-8002数显恒温水浴锅 苏州威尔实验用品有限公司;TDL-5LM-W低温离心机 湖南星科科学仪器有限公司;722可见分光光度计 上海光谱仪器有限公司;ALPHA1-2真空冷冻干燥机 德国Christ公司。
1.3 方法
1.3.1 胶原的提取纯化
工艺流程:鲜鹿茸→预处理→鹿茸粉末→胃蛋白酶法提取胶原→盐析→透析→冷冻干燥→鹿茸胶原。
取一定量鹿茸粉末,用10倍体积的0.1mol/L NaOH溶液4℃浸泡24h,蒸馏水洗至中性。固形物溶于0.5mol/L醋酸溶液,加入一定量胃蛋白酶,4℃条件下提取72h,10000r/min低温离心20min,上清液于4℃保存备用。所得沉淀重复提取两次。合并上清液,即为鹿茸胶原粗提液。向胶原粗提液中加入氯化钠至浓度为2mol/L,盐析过夜,10000r/min低温离心30min,弃去上清液,将析出的胶原液移入透析袋中,透析48h[10-11]。冷冻干燥,得鹿茸胶原。
1.3.2 鹿茸中胶原含量及得率测定
羟脯氨酸是胶原的特征氨基酸,通过测定羟脯氨酸的含量,并乘以相应的系数就可以求得胶原的含量[12]。故可采用比色法测定鹿茸中的羟脯氨酸含量来计算胶原的含量。鹿茸中羟脯氨酸约占胶原总量的10%[8],因此本实验中换算系数为10。
1.3.2.1 羟脯氨酸标准曲线的绘制
配制羟脯氨酸标准溶液质量浓度分别为0.5、1.0、1.5、2.0μg/mL。取不同质量浓度的上述溶液各4.00mL,加入20mL具塞试管中。加氯胺T溶液2mL,摇匀后于室温放置20min。加入显色剂2mL,摇匀,塞上塞子于60℃恒温水浴中保温20min后取出,迅速冷却,在波长560nm处测定吸光度。蒸馏水作为空白对照[13],得标准曲线:y=0.0815x+0.0004,R2=0.9986。
1.3.2.2 鹿茸中胶原含量测定
取样品溶液4mL至试管中,加入6mol/L的盐酸4mL,在酒精喷灯上封口,放入110℃恒温干燥箱中水解24h,冷却。取4mL分别加入20mL具塞试管中,加氯胺T溶液2mL,摇匀后于室温放置20min。加入显色剂2mL,摇匀,塞上塞子于60℃恒温水浴中保温20min后取出,迅速冷却,在波长560nm处测定吸光度。根据回归方程计算出样品中羟脯氨酸含量,并由样品中羟脯氨酸含量计算样品中胶原含量,公式如下[14]:

式中:A为标准曲线测得的溶液中羟脯氨酸的含量/(μg/mL);m为取样品的质量/g;10为胶原水解为羟脯氨酸的系数。
1.3.2.3 鹿茸胶原得率计算
根据1.3.2.2节所得鹿茸中胶原含量,计算胶原得率。

1.3.3 鹿茸胶原提取的单因素试验
分别选取提取时间、酶用量和液料比进行单因素试验,在其他因素相同情况下,考察某一因素对鹿茸胶原提取率的影响。固定项为提取时间48h、酶用量5%、液料比20:1(mL/g)。提取时间分别为12、24、36、48、60h;酶用量分别为3%、4%、5%、6%、7%;液料比分别为10:1、20:1、30:1、40:1、50:1(mL/g)。
1.3.4 鹿茸胶原提取条件优化
在单因素试验基础上,采用Box-Behnken中心组合试验设计,选取提取时间、液料比和酶用量进行二次旋转多元回归试验,获得最佳提取条件,因素水平见表1。
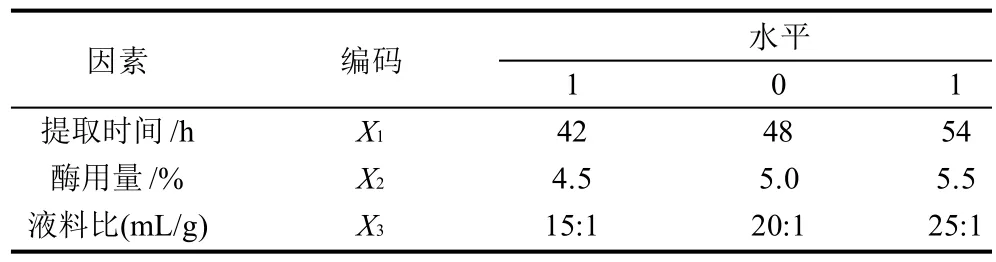
表1 二次旋转多元回归试验因素和水平编码值Table 1 Factors and levels of response surface experiments
1.3.5 数据统计分析
所有试验数据重复测定3次,所得结果为“平均值±标准差”,采用Excel 2003及SAS 9.0数学统计软件对数据件进行分析。
2 结果与分析
2.1 不同生长阶段鹿茸胶原含量比较
通过测定鹿茸中羟脯氨酸的含量计算鹿茸不同生长阶段胶原的含量,同时,根据1.3.2.3节方法计算出不同生长阶段胶原得率,结果如表2、3所示。表2 不同生长阶段鹿茸中胶原含量
Table 2 Collagen contents of velvet antlers at different growth stages

注:肩标字母不同表示差异显著(P<0.05)。下同。
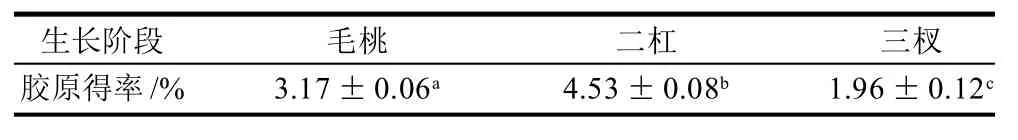
表3 不同生长阶段鹿茸中胶原得率Table 3 Collagen yields of velvet antlers at different growth stages
由表2可知,二杠茸中胶原含量最多,毛桃茸次之,三杈茸胶原含量最少,且二杠茸与毛桃和三杈茸中胶原含量差异显著(P<0.05)。由表3可知,不同生长阶段鹿茸胶原得率与胶原含量变化趋势相同,可推断鹿茸胶原提取效率没有受到不同阶段鹿茸原料差异的影响,不同生长阶段鹿茸结构没有影响提取效果。因此,在胶原提取工艺的研究上,二杠茸更为适合。
2.2 单因素试验
2.2.1 提取时间对胶原得率的影响
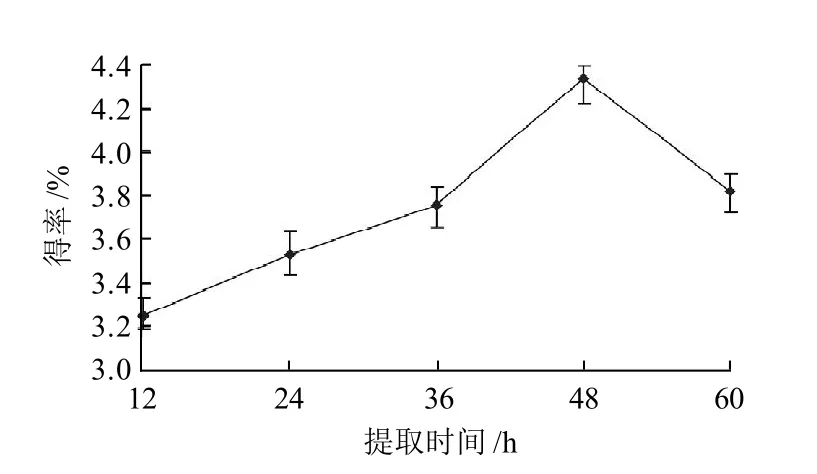
图1 提取时间对鹿茸胶原得率的影响Fig.1 Effect of extraction time on yield of antler collagen
由图1可知,提取时间为48h时,胶原得率最高。当提取时间小于48h时,酶解反应不完全,胶原未全部溶于水中,得率随提取时间增加而增加;当提取时间大于48 h时,酶反应过度,部分蛋白质分解成氨基酸,使胶原得率下降[15]。所以提取时间采用48h。
2.2.2 酶用量对胶原得率的影响
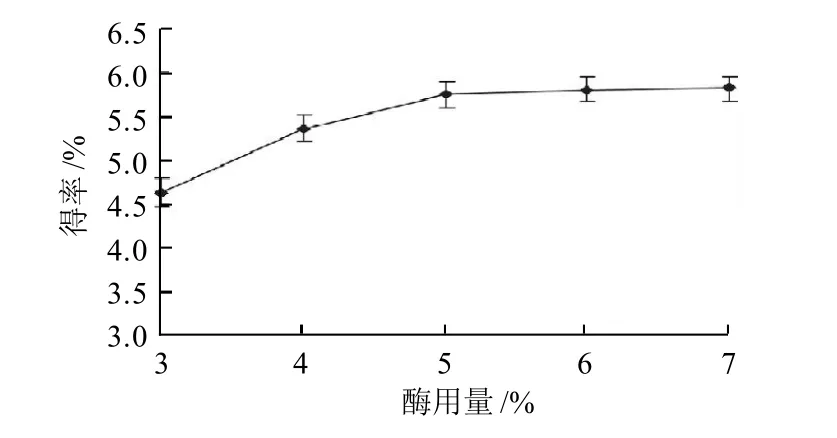
图2 酶用量对鹿茸胶原得率的影响Fig.2 Effect of enzyme addition on yield of antler collagen
如图2可知,随着酶用量的增加,得率不断增大,当酶用量大于5%时,得率基本不变。这是由于,酶用量为5%时,原料中胶原基本全部溶出,此后,增加酶用量得率也不会继续上升。因此,为节省试验成本,酶用量选择5%。

图3 液料比对鹿茸胶原得率的影响Fig.3 Effect of liquid-solid ratio on yield of antler collagen
2.2.3 液料比对胶原得率的影响由图3可知,当液料比小于20:1(mL/g)时,随着提取液增加,胶原得率呈上升趋势;当液料比为20:1时,得率达到最大,此后,随着提取液体积增加,得率变化不大。这是由于当液料比为20:1时,相同溶解状态下,胶原已基本全部溶出,再增加提取液的量不会使得率增加。因此,为提高试验效率,液料比确定为20:1。
2.3 胶原提取条件优化
2.3.1 Box-Behnken试验结果及分析

表4 Box-Behnken试验分析方案及结果Table4 Box-Behnken design and experimental results
根据表4数据,以胶原得率为响应值,运用SAS 9.0数据处理软件对数据进行响应面分析,因子经回归拟合得回归方程,其显著分析及方差分析分别见表5、6。

表5 回归系数显著性分析Table 5 Significant regression coefficient analysis
由表5可知,方程一次项X1和X2显著,X3影响不显著,说明各因素中,提取时间和酶用量对胶原得率影响较大,液料比对胶原得率影响不大。二次项均显著,交互项中,X1X3、X2X3影响显著,X1X2影响不显著,说明各试验因素对响应值不是简单的线性关系,而是呈二次抛物面关系。同时,可得出各因素对鹿茸胶原得率的影响顺序为提取时间>酶用量>液料比。
由表6可知,模型回归极显著(P<0.0001),R2=97.55%,说明该回归方程拟合较好,自变量与响应值之间线性关系显著,可用于试验理论预测。失拟为0.7224>0.05,不显著。表明该方程试验误差小,可用此模型对回归方程进行检验。
2.3.2 响应面图形分析
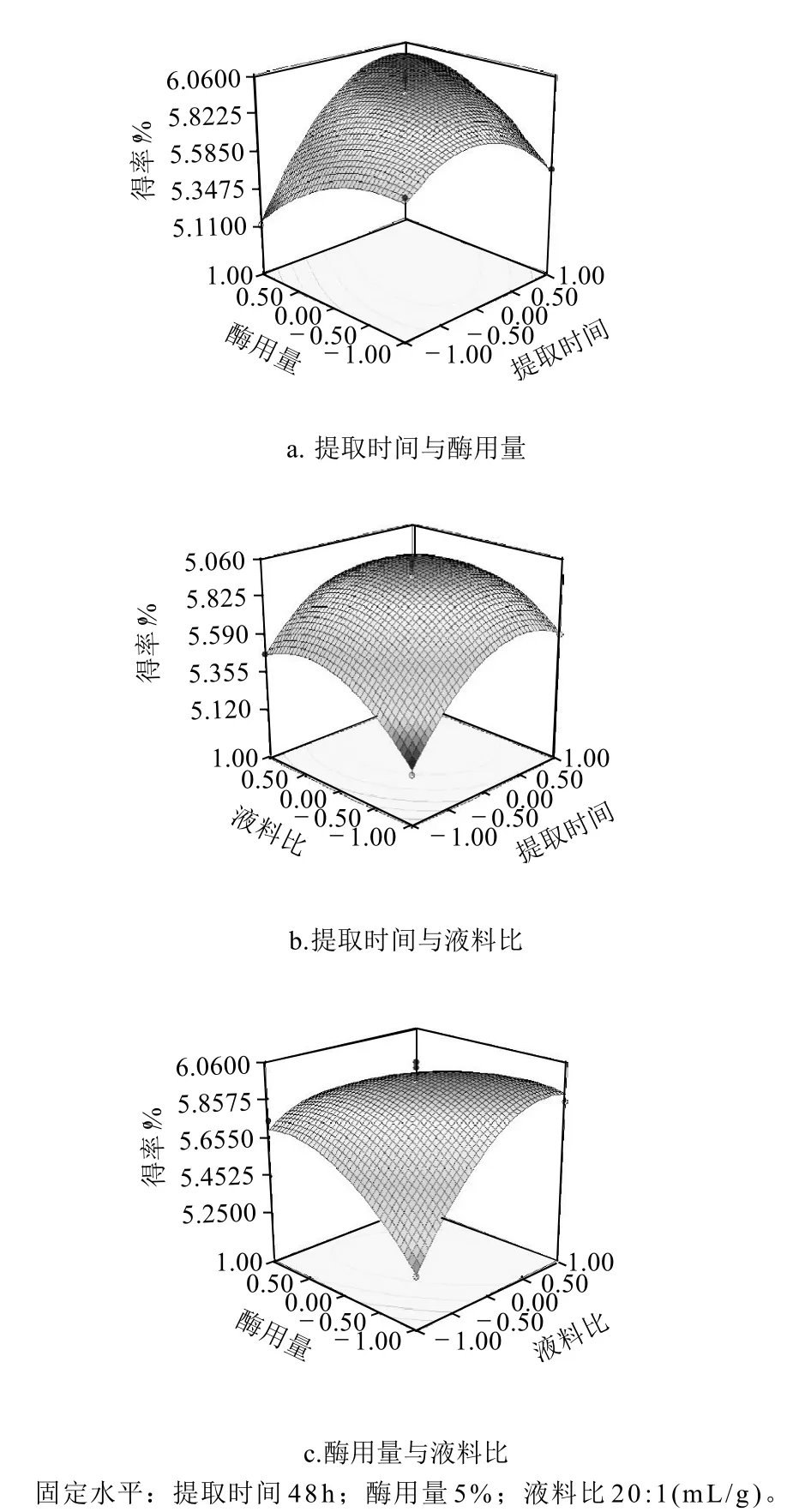
图4 各两因素交互作用对鹿茸胶原得率影响的响应面图Fig.4 Response surface plots of collagen yield and enzyme addition,liquid-solid ratio
由图4a可知,提取时间和酶用量对鹿茸胶原得率的影响均呈抛物线形,随着提取时间和酶用量同时增大,胶原得率呈先增加后降低的趋势,即在提取工艺中适当增加提取时间和酶用量可以提高胶原得率。同时,提取时间曲面斜率大于酶用量曲面斜率,可知提取时间对胶原得率的影响大于酶用量。由图4b可知,随着提取时间和液料比增加,胶原得率达到最大值,此后随着两者的增加,得率有所下降。因此,应选取合适的提取时间和液料比。提取时间曲面斜率大于液料比,可知提取时间对胶原得率的影响大于液料比。由图4c可知,酶用量和液料比在分别达到某一点后,胶原得率变化不明显,所以控制酶用量和液料比在最佳范围。
对回归方程求一阶偏导,求得最佳点编码值分别为X1=0.6768、X2=-0.1740、X3=0.6885,理论最佳值为提取时间52.06h、酶用量4.91%、液料比23.44:1(mL/g)。鹿茸胶原得率理论预测值可达到6.02%。考虑到实际操作条件,最佳试验条件确定为提取时间52h、酶用量5%、液料比23:1(mL/g)。在此条件下进行验证实验,胶原得率为5.92%。可见,试验结果与模型拟合良好,该方程能真实地反应各因素对胶原得率的影响。
3 结 论
本实验采用胃蛋白酶法提取鹿茸胶原,比较不同生长阶段鹿茸中胶原含量和胶原得率,证明二杠茸高于毛桃茸和三杈茸(P<0.05),更适合作为鹿茸胶原提取的原料。采用响应面法优化二杠鹿茸胶原提取条件,确定适宜提取工艺条件为提取时间52h、酶用量5%、液料比23:1(mL/g),在此条件下胶原得率为5.92%。
[1] 钟朝辉, 李春美, 梁晋鄂, 等. 鱼鳞胶原蛋白提取工艺的优化[J]. 食品科学, 2006, 27(7): 162-166.
[2] 郑淼, 周亚丹, 赵敏. 东北林蛙皮中胶原蛋白含量的测定及提取工艺[J]. 东北林业大学学报, 2008, 36(7): 81-83.
[3] 钱丽丽, 高学敏, 王淳. 具有中医特色的保健食品研发优势分析[J].中华中医药杂志, 2009, 24(6): 697-701.
[4] OGAWA M, PORTIER R J, BELL J, et al. Biochemical properties of bone and scale collagens isolated from the subtropical fish black drum(Pogonia cromis) and sheephead seabream (Archosargus probatocephalus)[J]. Food Chemistry, 2004, 88(4): 495-50.
[5] 齐艳萍. 鹿茸的化学成分及对肝损伤的修复作用[J]. 甘肃中医, 2010,23(1): 61-63.
[6] 晋大鹏, 胡志帅, 陈书明. 鹿茸的化学成分及其生物活性研究进展[J]. 山西中医学院学报, 2009, 10(2): 67-68.
[7] BYONGTAE J, SUNGJIN K, SANGMOO P, et al. Effect of antler growth period on the chemical composition of velvet antler in sika deer(Cervus nippon)[J]. Mammalian Biology, 2008, 74(5): 374-380.
[8] 李银清. 梅花鹿茸胶原的分离提取及活性研究[D]. 长春: 长春中医药大学, 2007.
[9] 徐云凤, 赵雨, 张鹤, 等. 酶解法制备鹿茸胶原蛋白的工艺研究[J].中华医药杂志, 2011, 26(1): 53-55.
[10] 张文涛. 霞水母中胶原蛋白的分离及理化活性初探[D]. 无锡: 江南大学, 2008.
[11] 庄永亮, 赵雪, 张朝辉, 等. 海蜇伞布胶原蛋白的提取及其理化性质[J]. 食品科学, 2009, 30(13): 89-92.
[12] LIN Y K, LIN T Y, SU H P. Extraction and characterization of telopeptidepoor collagen from porcine lung[J]. Food Chemistry, 2011, 124(4):1583-1588.
[13] 王红道, 郑云峰, 黄晓丽, 等. 比色法测定乳制品中羟脯氨酸含量[J].科技信息, 2009(25): 422-423.
[14] 刘磊. 海蜇胶原蛋白的提取、纯化及理化性质研究[D]. 无锡: 江南大学, 2009.
[15] 马俪, 王晓丹, 程贺, 等. 响应面法优化酶法提取鳕鱼皮中胶原蛋白条件[J]. 中国酿造, 2010(9): 83-85.
Collagen Content of Velvet Antlers at Different Growth Stages and Optimization of Extraction Process
ZHAO Yu-hong,JIN Xiu-ming,WANG Shan-shan
(Department of Food Science, College of Forestry, Northeast Forestry University, Harbin 150040, China)
Velvet antlers were selected as raw materials to extract collagen using enzyme pepsin. Collagen contents at different growth stages were also compared. Results showed that content and the yield of collagen in two branched antler were 65.8 mg/g and 4.53%, respectively, which were significantly higher than three branched antler (P<0.05). Factors of extraction time, enzyme addition and liquid-solid ratio were chosen to research the effects on yield of collagen and Box-Behnken experiment was designed to optimize the extraction conditions. The results showed that extraction time for 52 h, enzyme addition with 5%, liquid-solid ratio at 23:1 (mL/g) were the optimal conditions, the yield of collagen in two-branched antler was 5.92%.
antler;collagen;extraction;optimization
TS201.7
A
1002-6630(2012)10-0067-05
2011-04-18
黑龙江省教育厅科学技术研究指导项目(11553036)
赵玉红(1968—),女,副教授,博士,研究方向为林特产品精深加工。E-mail:zhaoyuhong08@hotmail.com
