蛹虫草发酵产虫草素的培养条件研究
2012-10-25汤佳鹏柳依婷
汤佳鹏,柳依婷,赵 强,董 伟,朱 俐
(南通大学航海医学研究所生化与药学研究室,江苏南通 226001)
蛹虫草发酵产虫草素的培养条件研究
汤佳鹏,柳依婷,赵 强,董 伟,朱 俐
(南通大学航海医学研究所生化与药学研究室,江苏南通 226001)
研究外源添加物,麸皮、玉米芯、腺苷等对蛹虫草液体发酵合成虫草素的影响,结果表明,发酵5d后加入3g/L腺苷,虫草素的产量最高。当腺苷添加量大于4g/L时,虫草素对腺苷的得率维持在25%,虫草素产量最大能达到1.62g/L。通过分析菌丝体生长与虫草素合成的动力学关系,发现虫草素的合成属于部分生长偶联型发酵。当振荡发酵4d后,静置发酵7d,虫草素的产量达到1.60g/L,产率达到145.5mg/L/d。这一蛹虫草合成虫草素的发酵工艺具有潜在的工业应用价值。
蛹虫草,虫草素,腺苷,振荡-静置培养
虫草菌素(cordycepin),即3'-脱氧腺苷,有多种生物学活性,如抗肿瘤、抗增殖、抗转移、抗菌、抗病毒、免疫调节和抗炎等[1-2]。最近十年,以虫草菌素作为治疗药物的靶向研究取得重大进展。这些研究包括虫草菌素在各种癌症上的应用,特别是白血病[3],还有非洲锥虫病[4]和血管成形术引起的再狭窄[5]以及虫草菌素衍生物体内抗氧化的作用等。目前研究的蛹虫草液体深层发酵技术均基于将绝大部分虫草素分泌至胞外的蛹虫草菌株,其中中国工业微生物菌种保藏管理中心的Cordyceps militarisCICC No.14014就具有该特性。近年来,国内外对蛹虫草菌株的诱变筛选和虫草素的发酵条件优化做了大量研究,但虫草素产量依然较低[6]。为了提高液体深层发酵法的虫草素产量,我们对液体深层培养的方式进行了优化研究,旨在寻找一种适合蛹虫草菌株特性的工业化生物合成虫草素的工艺。
1 材料与方法
1.1 材料与仪器
蛹虫草Cordyceps militarisCICC No.14014 购自中国工业微生物菌种保藏管理中心;斜面培养基马铃薯汁200g/L,葡萄糖20g/L,琼脂15g/L,KH2PO43g/L,MgSO4·7H2O 1.5g/L,VB1微量,121℃灭菌20min;基础发酵培养基 葡萄糖42g/L,蛋白胨10g/ L,酵母膏 6g/L KH2PO40.5g/L,MgSO4·7H2O 0.5g/L,K2HPO40.5g/L,调节 pH至 6.00,121℃灭菌15min。
ES-315全自动灭菌锅 山东新华医疗器械厂; GNP-9080隔水式恒温培养箱 上海三发科学仪器有限公司;SW-CJ-1BU超净工作台 苏州安泰空气技术有限公司;HYG-A全温摇瓶柜 太仓市实验设备厂;PHS-3E酸度计 上海精科雷磁仪器厂;高效液相色谱仪LC-20AD 日本岛津。
1.2 实验方法
1.2.1 发酵接种方法 将菌种接种到斜面培养基,在25℃培养6~7d。待菌株长满斜面后,将斜面的孢子用50mL已灭菌的基础发酵培养基刮下,一并倒入250mL三角瓶,在25℃,180r/min振荡培养4d,制得种子液。将培养好的种子液以10%(V/V)接种量接到发酵培养基中,进行发酵培养。
1.2.2 检测方法 将培养一定时间的样品离心(10000r/min 10min)后,取上清液用纯水稀释6倍,振荡混匀,留作检测腺苷和虫草素。离心沉淀经2次水洗,在110℃烘干至恒重,测定菌丝体干重。
发酵液中的腺苷和虫草素的含量通过高效液相色谱法测定[7]。色谱条件:色谱柱:Ultimate AQ-C18(4.6mm×250mm,5μm),流动相:甲醇∶磷酸盐溶液(10mmol/L KH2PO4溶液)=15∶85,柱温40℃,流速1mL/min,进样量20μL,检测波长为260nm。
1.2.3 麸皮、玉米芯添加对虫草素合成的影响 培养基配方对虫草素的产量影响较大。因此,大量的蛹虫草发酵研究与培养基优化有关。特别是麸皮,含有丰富的微量元素以及维生素等,还具有价格便宜、容易获得的优点,是优良的培养原料。因此,本研究考察了麸皮和玉米芯的添加对虫草素产量的影响。
在基础发酵培养基中加入4、8、12、16、20g/L的麸皮或玉米芯粉,按照1.2.1的方法接种后,在25℃,180r/min振荡培养10d后测定发酵液中虫草素的浓度。
1.2.4 腺苷最佳补料时间 已接种三角瓶在25℃,180r/min的全温摇瓶柜中振荡培养。分别在发酵的第4、5、6、7、8d在三角瓶中加入腺苷,浓度为3g/L。在加入腺苷后2d进行取样,每天取样一次,连取3d,检测腺苷与虫草素的含量,根据色谱结果判断最优的腺苷添加时间。
1.2.5 腺苷添加量对虫草素合成的影响 三角瓶接种步骤同1.2.1,在25℃,180r/min振荡培养,培养至第5d,分别补加腺苷2、3、4、5、6g/L继续振荡培养。然后在补加腺苷后的第2、4、6d,分别取样检测虫草素的含量。
1.2.6 振荡培养时间对两步法发酵产虫草素的影响
三角瓶接种步骤同1.2.1,在25℃,180r/min振荡培养。培养4、5、6、7d后,将三角瓶转移至25℃恒温培养箱静置培养。静置培养7d后测定发酵液中虫草素的浓度及菌丝体干重。
2 结果与讨论
2.1 麸皮、玉米芯对虫草素产量的影响
图1显示的是在基础发酵培养基中加入麸皮和玉米芯粉对虫草素合成的影响。加入8g/L玉米芯粉使得虫草素产量有显著提高,达到0.19g/L。这可能是由于玉米芯粉中含有蛹虫草菌丝体生长和虫草素合成所需的营养物质,例如糖和蛋白等。但总体来讲,麸皮和玉米芯的加入对虫草素的产量极为不利。特别是麸皮的加入,使得虫草素的产量仅为0.03~0.10g/L。而李瑞雪等将3%麸皮加入蝉拟青霉发酵的液体培养基,发酵4d虫草素含量达到36.7mg/L[7]。这可能是由于发酵菌株不同造成的,蛹虫草属于寄生真菌,蛋白酶活性较强。而麸皮和玉米芯中含有3%~6%的植酸,植酸能够络合金属离子,导致蛋白酶活性下降。而且,蛹虫草菌体中可能缺乏植酸酶。因此,麸皮和玉米芯粉不但不能促进虫草素的合成,而且能通过抑制菌体对蛋白的消化吸收抑制虫草素合成活性。因此,若采用谷物原料进行蛹虫草固态发酵或者液体发酵均应先去除其中的植酸,这样才能不影响菌丝体的生长和虫草素的积累。
2.2 蛹虫草菌丝体生长与虫草素合成的关系
图2显示的是菌体量和虫草素的变化曲线。在有氧振荡培养的条件下,蛹虫草的生长延迟期较短,对数生长期菌丝体生长速率快,在第4d附近即达到最大菌体量(25.03g/L),其对数生长期的菌体生长速率达到12.06g/L/d。虫草素的合成是在培养至第2d以后才开始进行的,说明在此之前,菌丝体中合成虫草素的相关酶系还不健全或是缺乏某一重要辅因子。培养3d后,虫草素的合成以恒定的速率积累,在第 9d时达到 0.51g/L,虫草素合成效率为0.057g/L/d。由图2可知,虫草素的合成与菌体生长是部分分离的。因此,虫草素发酵模式属于部分生长偶联型发酵。
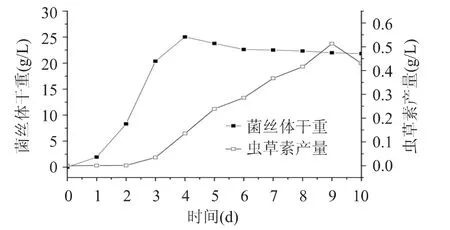
图2 菌丝体生长曲线与虫草素的积累进程曲线Fig.2 The growth curve of C.militaris and the process of cordycepin production
2.3 腺苷补料时间对虫草素合成的影响
众多的研究已表明,虫草素的直接合成前体是腺苷[8],而腺苷是通过嘌呤核苷酸的合成途径合成的。在深层液体发酵中,蛹虫草菌丝体的形态不断变化,同时其代谢特性也在发生变化。因此,腺苷的加入时间对腺苷的转化、虫草素的合成具有明显影响。
如图3所示,加入3g/L腺苷后的第2d开始连续3d监测发酵液中虫草素产量的变化。第4d加入腺苷,在第7d时,虫草素产量达到最高,为0.63g/L,比未加腺苷的最高产量0.51g/L多23.5%,说明腺苷的加入能够促进虫草素的合成。第5d加入3g/L腺苷,虫草素积累量最大,发酵至第9d时为0.91g/L,比0.51g/L提高78.4%,而且有不断增加的趋势。过了第5d,加入腺苷,虫草素的积累开始下降。至第8d时,加入3g/L腺苷,虫草素的积累仅为0.3~0.4g/L,比未加入腺苷的还低。因此,腺苷补料时间在整个发酵过程中的起着至关重要的作用,当发酵至第5d时添加3g/L腺苷,虫草素的积累能够达到最大。这进一步证明了虫草素的合成属于部分生长偶联型,虫草素的最佳合成时机应该滞后于最大菌体量出现的时间。由图2可知,最大菌体量出现的时间为第4d,而从图3可知第5d加入腺苷最有利于虫草素积累,因此从图2和图3判断这一滞后的时间大约是1d。而在最佳补料时间之前加入腺苷,腺苷可能对菌体生长有一定的抑制,继而影响虫草素的合成;在最佳补料时间之后加入腺苷,由于有氧条件下,菌体代谢速率较快导致葡萄糖等底物快速消耗,此时已无足够能量和还原力供给腺苷向虫草素的转化,使得虫草素的积累不高。

图3 腺苷补料时间对虫草素合成的影响Fig.3 Effect of adenosine addition time on cordycepin production
2.4 腺苷添加量对虫草素合成的影响
很多文献报道了腺苷的加入对虫草素积累的作用。文庭池等对添加前体促进虫草素合成做了深入的研究,发现单独添加8g/L腺苷,虫草素浓度达到0.68g/L,但是剩余腺苷浓度也较大,达到0.4g/L。而2g/L腺苷和16g/L谷氨酰胺组合添加胞内虫草素含量达到了0.74g/L,菌丝体产量也达到28.5g/L;1g/L腺苷和2g/L甘氨酸组合添加虫草素含量达到了1.09g/L[9-10]。因此,我们考察了在最优添加时间下,腺苷添加量对虫草素积累的影响。
如图4所示,发酵7d后,6g/L的腺苷加入对菌丝体产虫草素的酶系有一定的抑制作用,虫草素的积累仅为0.5g/L。但是随着发酵的继续进行,发现加入4g/L腺苷的虫草素积累速率较小。而腺苷加入量小于4g/L和大于4g/L的实验组虫草素均有较大的虫草素积累速率,而且这一分布类似“V”形曲线。发酵11d后,加入6g/L腺苷的实验组虫草素积累达到1.62g/L,优于1.09g/L。
由图5可知,发酵5d后,大于4g/L腺苷加入量的实验组,虫草素对腺苷的得率控制在25%附近。推测形成“V”形曲线的可能原因是由于当腺苷的浓度大于4g/L时,整个发酵过程受到酶反应平衡的控制;但当腺苷浓度低于4g/L时,虫草素对腺苷的得率不会对酶反应产生明显影响,虫草素的合成可以达到很高的得率。当腺苷浓度为2g/L时,虫草素对腺苷的得率达到67.0%。这一现象进一步说明了腺苷在虫草素合成中的双重作用。一方面腺苷作为虫草素的直接转化前体,可以不断合成虫草素;另一方面,当腺苷浓度超过4g/L,虫草素对腺苷的得率有可能阻止该反应平衡向虫草素合成方向移动。

图4 发酵5d添加腺苷对虫草素产量的影响Fig.4 Effect of adenosine on cordycepin production during 5 days of fermentation

图5 发酵5d后添加腺苷对虫草素得率的影响Fig.5 Effect of adenosine on the yield of cordycepin on 5 days of fermentation
2.5 振荡培养时间对两步法发酵产虫草素的影响
Shih等人比较了振荡培养与振荡-静置两步培养,提出了先振荡后静置的发酵策略。经过Box-Behnken实验设计和响应面优化,最终虫草素产量达到2214.5mg/L,产率为92.3mg/L/d[11]。随后,刘艳芳等人也对蛹虫草的静置发酵进行了深入研究。纯静置发酵有利于虫草素的产生和积累。在添加0.5g/L腺嘌呤的条件下静置发酵28d,虫草素产量达到2.05g/L,产率达到73.2mg/L/d[12]。而且,崔建东等在研究了不同培养方法对北冬虫夏草生长和多糖合成的影响后,发现两阶段发酵方法(摇动培养加静止培养)对于虫草多糖的合成效果也是最好的,通过响应面优化的方法获得两阶段发酵培养的最佳工艺,并建立了适合虫草两阶段发酵合成多糖的模型。虫草多糖的最大产量分别是摇动培养和静止培养的1.5倍和2倍[13]。表1显示的是振荡发酵时间对虫草素产量的影响,发现振荡发酵4d后静置发酵,虫草素产量最大,能够达到1.6g/L,产率达到145.5mg/L/d。虫草素的产率比之前的研究分别提高 57.6% (92.3mg/L/d[11])和98.8%(73.2mg/L/d[12])。

表1 振荡培养时间对两步法发酵产虫草素的影响Table 1 Effect of the shake-culture time on cordycepin production using two-step fermentation
3 结论
本文通过对外源添加物以及发酵方式的研究,发现了腺苷的加入时机和加入量与虫草素合成的关系。当腺苷加入量大于4g/L时,虫草素得率维持在25%,体现了该酶反应平衡的关系。另外,通过菌丝体生长曲线的绘制,发现虫草素合成与菌丝体生长之间存在部分偶联。而且,通过振荡-静置发酵实验得到当菌丝体量达到最大时(振荡发酵4d),改用静置发酵(7d),获得的虫草素产量和产率分别达到1.6g/L和145.5mg/L/d。该虫草素产率在同类型发酵中是最高的。
[1]Ng TB,Wang HX.Pharmacological actions of Cordyceps,a prized folk medicine[J].J Pharm Pharmacol,2005,57(12): 1509-1519.
[2]Paterson RRM.Cordyceps-A traditional Chinese medicine and another fungal therapeutic biofactory[J].Phytochemistry,2008,69 (7):1469-1495.
[3]Thomadaki H,Tsiapalis CM,Scorilas A.The effect of the polyadenylation inhibitor cordycepin on human Molt-4 and Daudi leukaemia and lymphoma cell lines[J].Cancer Chemother Pharmacol,2008,61(4):703-711.
[4]Vodnala SK,Ferella M,Lunden-Miguel H,et al.Preclinical assessment of the treatment of second- stage african trypanosomiasis with cordycepin and deoxycoformycin[J].Plos Neglect Trop D,2009,3(8):1-13.
[5]Chang W,Lim S,Song H,et al.Cordycepin inhibits vascular smooth muscle cell proliferation[J].Eur J Pharmacol,2008,597 (1/3):64-69.
[6]薛俊杰,张劲松,刘艳芳,等.发酵法生产虫草素研究进展[J].食用菌学报,2011,18(3):100-104.
[7]李瑞雪,胡飞,陈安徽,等.蝉拟青霉高产虫草素菌株液体培养工艺的研究[J].徐州工程学院学报,2007,22(10): 23-30.
[8]Kredich NM,Guarino AJ.Studies on the biosynthesis of cordycepin[J].Biochim Biophys Acta,1961,47:529-534.
[9]文庭池,雷帮星,康冀川,等.添加前体促进蛹虫草发酵生产菌丝体和虫草菌素的研究[J].食品与发酵工业,2009,35 (8):49-53.
[10]文庭池,康冀川,雷帮星,等.前体及营养物提高蛹虫草虫草菌素产量的研究[J].食品科学,2010,31(5):175-179.
[11]Shih IL,Tsai KL,Hsieh C.Effects of culture conditions on the mycelial growth and bioactive metabolite production in submerged culture ofCordyceps militaris[J].Biochem Eng J,2007,33(3):193-201.
[12]刘艳芳,唐庆九,顾俊杰,等.北冬虫夏草深层发酵高产虫草素工艺的优化[J].上海农业学报,2010,26(3):26-30.
[13]崔建东,张思,齐红彦.冬虫夏草多糖合成两阶段培养的设计与优化[J].食品工业科技,2012,33(2):182-184,188.
Study on culture condition of cordycepin fromCordyceps militarisfermentation
TANG Jia-peng,LIU Yi-ting,ZHAO Qiang,DONG Wei,ZHU Li
(Department of Biochemistry and Pharmacy,Institute of Nautical Medicine,Nantong University,Nantong 226001,China)
Effects of exogenous additives,such as wheat bran,corn cob and adenosine on cordycepin production in a submerged culture ofCordyceps militariswere investigated.The results showed that the addition of 3g/L of adenosine on the fifth day of fermentation was superior to other day.When addition amount of adenosine exceeds 4g/L,the yield of cordycepin on adenosine was about 25%and the maximal cordycepin production reached 1.6g/L.The dynamics between growth of mycelium and the cordycepin synthesis were analyzed.The fermentation was mixed-growth associated.The optimum values for cordycepin production were shaken for 4d followed by 7d static culture.The maximum cordycepin production and productivity reached 1.60g/L and 145.5mg/L/d,respectively.It was indicated that the new culture technology obtained in this work possessed a high potential for the industrial production of cordycepin ofCordyceps militaris.
Cordyceps militaris;cordycepin;adenosine;shake-static culture
TQ920.6
A
1002-0306(2012)21-0181-04
2012-03-30
汤佳鹏(1981-),男,博士,助理研究员,主要从事发酵工程及代谢调控研究。
江苏省自然科学基金(BK2011392);南通市应用研究计划(AS2011021)。
