芡种壳乙醇提取物组成及其抗氧化稳定性分析
2012-10-25徐幸莲周光宏李春保
张 汆,徐幸莲,周光宏,李春保,李 玲
(1.南京农业大学教育部肉品加工与质量控制重点实验室,江苏南京 210095;
2.滁州学院生物与食品工程学院,安徽滁州 239000)
芡种壳乙醇提取物组成及其抗氧化稳定性分析
张 汆1,2,徐幸莲1,*,周光宏1,李春保1,李 玲1
(1.南京农业大学教育部肉品加工与质量控制重点实验室,江苏南京 210095;
2.滁州学院生物与食品工程学院,安徽滁州 239000)
研究以乙醇为溶剂,从芡种壳中得到两种提取物:A和B,采用HPLC-UV法对其中多酚组分进行了分析,并对其在不同条件下的抗氧化稳定性进行了研究。结果显示,芡种壳提取物A和B中均含有丰富的多酚物质(763.65、517.04mg/g),主要多酚物质是:没食子酸(314.0、281.4mg/g)、儿茶素类、芦丁(54.68、44.81mg/g)和少量绿原酸。抗氧化稳定性分析结果表明,芡种壳提取物对高压灭菌、紫外线和强碱性环境均非常敏感,尤其是碱性条件下,其抗氧化活性(还原力和DPPH·清除活性)几乎损失殆尽;在强酸性条件下,其还原力和DPPH·清除活性不仅不会降低,反而显著增加。因此,芡种壳提取物可以添加到一些酸性食品中。
芡种壳提取物,抗氧化活性,稳定性
芡实是睡莲科(Nymphaeaceae)芡属植物(Euryale Salisb.exDC.)芡(Euryale ferox)的种仁,俗称“鸡头米”,是中国传统的中药原料和滋补食材,除具有“补肾、健脾、养胃”等中医理论功效外,还具有抗氧化[1-2]、修复心肌局部缺血[3]的功效。芡种子外有一层木质种壳(厚度1~2mm),约占其种子质量的40%~50%,是芡米加工中的主要副产物,年产量过万吨,目前尚未开发利用。目前,国内外有关芡实的研究较少,主要集中在营养组分分析[4-5]、生理活性[6-8]以及加工[9]等方面,对其副产物利用方面的研究很少。邓宇等[10]、王和才等[11]先后在芡果皮中检测到丰富的鞣质。孙文凯等[12]研究发现,芡种壳提取物显示出很强的体外抗氧化活性。张汆等[13]研究显示,芡种壳中含有丰富的多酚物质,目前,有关芡种壳中多酚物质的相关研究还未见有文献报道。多酚物质是一类植物次生代谢产物,在自然界各种植物组织中广泛存在。植物多酚物质一般具有多种生理活性,如抗菌、抗炎、抗氧化等,现已广泛用于生物、医药、食品等领域,典型代表如茶多酚[14]、葡萄和葡萄籽多酚[15]、苹果多酚[16]、石榴皮多酚[17]等。不同来源的多酚物质,生理活性差异很大。为进一步利用芡种壳资源,该研究拟采用溶剂浸提法,从芡种壳中制备两种多酚提取物,对其理化性质和化学组分分析的基础上,对其抗氧化稳定性进行分析,为其作为天然抗氧化剂在食品领域的应用提供依据。
1 材料与方法
1.1 材料与仪器
芡实 由安徽省天长市胜达芡实专业经济合作社提供,新鲜芡果实于2010年10月采收后,取出种子,手工剪开种壳,收集芡种壳,并于40℃烘箱内干燥后,粉碎(过100目筛网),装入聚乙烯自封袋内,于4℃冰箱内贮藏,备用;DPPH·(1,1-二苯基-2-苦肼基自由基) 纯度>97.0%,梯希爱(上海)化成工业发展有限公司;茶多酚(TP) 纯度98%,无锡市世纪生物药业有限公司;芦丁、没食子酸、绿原酸、儿茶素等标准品 中国药品生物制品检定所;高效液相色谱用甲醇、乙酸等试剂 色谱纯;其他常规试剂 分析纯,国药集团上海试剂公司。
CP124S型分析天平 德国 Sartorius公司; FW135型粉碎机 天津泰斯特;L550型大容量离心机 湖南湘仪;LGJ-10B型冷冻干燥机 北京四环; RE-85Z型旋转蒸发仪 郑州科工贸;DGX-9073BC-1型电热鼓风干燥箱 上海福玛;UV-2450PC型紫外-可见分光光度计 日本岛津;KQ-300DE型数控超声波发生器 昆山市超声波仪器有限公司;GKYS型无菌操作台 苏净集团苏州安泰公司;精密微量移液器(100-5000μL) 德国Eppendorf;WH-2型微型旋涡混合仪 上海沪西;M2e型酶标仪、Waters e2695 HPLC高效液相色谱仪、Waters 2489 UV-visible检测器 美国。
1.2 实验方法
1.2.1 芡种壳提取物制备 取芡种壳粉100g,加入500mL无水乙醇,于20℃下超声浸提30min。抽滤,滤渣用无水乙醇浸提2次,合并滤液,减压回收溶剂后,真空冷冻干燥48h,即得芡种壳提取物(A)。提取A后剩余的滤渣加入500mL 50%乙醇水溶液,采用上述方法浸提,得到芡种壳提取物(B)。两种提取物分别装入棕色瓶内,-20℃低温贮藏,备用。
1.2.2 提取物中常规组分分析 总酚含量:采用Folin-Ciocalteus(FC)试剂法测定[18];总糖含量:采用苯酚-硫酸法测定[19];蛋白质含量:采用凯氏定氮法测定。
1.2.3 提取物中多酚组分分析 将提取物A和B分别溶于甲醇和 50%甲醇水溶液中,浓度调整为1000μg/mL,滤液经0.45μm膜过滤后,用于 HPLC分析。
高效液相色谱(HPLC)条件:Waters e2695液相色谱仪,Waters 2489 UV-visible检测器,Sunfire C18柱(5μm,4.6mm×250mm)。流动相为甲醇∶1%乙酸(30∶70,v/v),流速1.0mL/min,检测波长280nm,进样量5μL,柱温35℃。
1.2.4 提取物抗氧化性分析 总还原力测定:采用铁氰化钾比色法,参照Chatchawan Chotimarkorn等[20]的方法测定。DPPH自由基(二苯代苦味肼基自由基)清除活性分析:采用比色法,参照Seok Hyum Nam等[21]和Chang W.Choi等[22]的方法测定。
配制不同浓度的芡种壳提取物和茶多酚(TP)、维生素C(VC)。分别经过高压灭菌、紫外照射、酸和碱处理,比较处理前后各样品还原力和清除DPPH自由基活性的变化,评价其抗氧化稳定性。
抗氧化稳定性:定义为样品处理前后抗氧化活性的变化,以其抗氧化活性损失的百分率表示。
1.3 数据处理
采用Excel和DPSv7.55数据处理软件对数据进行分析,采用多重比较法进行显著性分析(显著性水平p<0.05)。实验数据均重复测定3次,取平均值,表示为平均值±标准差(Mean±SD)。
2 结果与分析
2.1 芡种壳提取物组分分析
分析结果表明,芡种壳中含有丰富的总酚(183.17mg/g,干基),芡种壳提取物A和B中的总酚含量分别为:763.65、517.04mg/g(干基),不含蛋白质类物质(表1),其紫外吸收光谱与茶多酚(TP)很相似,均在212nm和278nm处有强吸收,说明提取物A和B中主要组分应为多酚类物质。此外,两种提取物中总糖含量接近,但是采用HPLC法又检测不到任何游离单糖,故推测A、B所含组分分子中可能含有遇酸可水解的糖苷键,如单宁和芦丁。
采用乙醇和50%乙醇水溶液依次提取,提取物总得率达20%以上,其中总酚含量也较高,因此,在产业化应用方面具有一定的开发价值。
目前,国内外未见有关芡实中多酚物质的文献报道,这为本实验中多酚标准物质的选择带来一定困难,只能准备一些植物中最常见的多酚物质作为本实验的标准物质。根据HPLC-UV法分析结果,结合各标准物质及其紫外吸收光谱特性,初步分析表明,芡种壳提取物中主要多酚物质为没食子酸、芦丁和少量绿原酸,TP中主要含有没食子酸、儿茶素、绿原酸和表儿茶素。此外,在保留时间2.85min附近还有1~2个较强的吸收峰,因缺乏相应的标准物质,尚不能定性是何种物质(表2和图1),尚需做深入分析。在提取物A和B中均检测出较丰富的芦丁组分,其分子结构中就含有糖基,该结果与前述推测是一致的(表1)。
2.2 抗氧化稳定性分析
高压、高温、紫外、强酸和强碱性条件在食品加工中经常会涉及到,因此,为了解两种芡种壳提取物在上述条件下的稳定性,本研究以提取物的体外抗氧化活性为主要指标,对其在上述条件下的变化进行分析。
2.2.1 高温高压灭菌条件 模拟高压灭菌(High pressure sterilization,HPS)条件,将不同浓度的提取物溶液在121℃高压灭菌器内处理20min后取出,测定其灭菌前后抗氧化活性(总还原力和DPPH·清除活性)变化,同时与同浓度的茶多酚(TP)和维生素C (VC)比较。结果显示,经灭菌处理,两种提取物和TP、VC溶液的还原力均显著降低,损失率均超过50%,最高损失率达81.42%(A,1.0mg/mL)。不同提取物溶液浓度对其总还原力损失的影响不同,在较低浓度时,提取物A和B溶液的总还原力损失率较小,而TP和AA的损失率反而更高(表3)。两种芡种壳提取物的DPPH·清除活性在灭菌处理前后变化不显著(p<0.05),这可能与两种抗氧化活性评价方法的原理有关[23]。上述结果也表明,仅凭一个抗氧化方法难以对提取物的抗氧化稳定性作出全面评价。
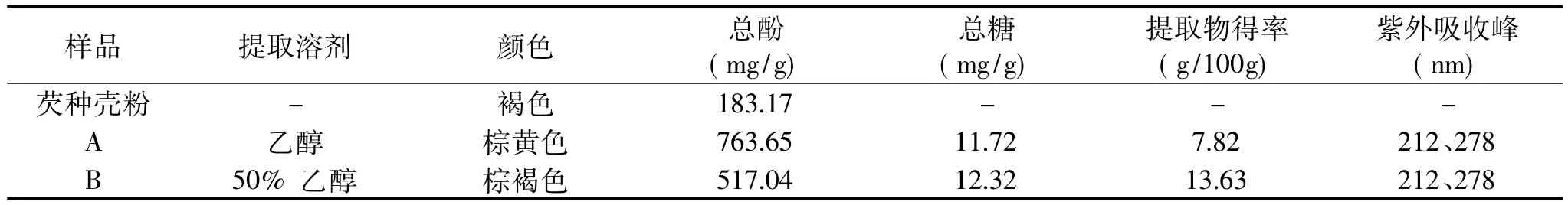
表1 芡种壳提取物理化性质分析Table 1 The compositions analysis of extracts

表2 芡种壳提取物和茶多酚中主要多酚组分含量Table 2 The major polyphenols compositions of EFS extracts and tea polyphenols
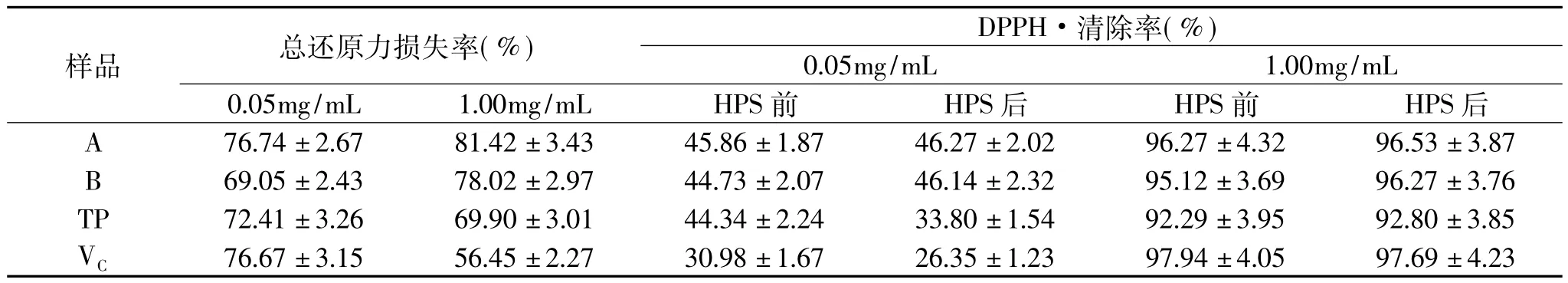
表3 高压灭菌处理对芡种壳提取物总还原力的影响Table 3 Total reducing power and DPPH·scavenging activities of EFS extracts treated with HPS
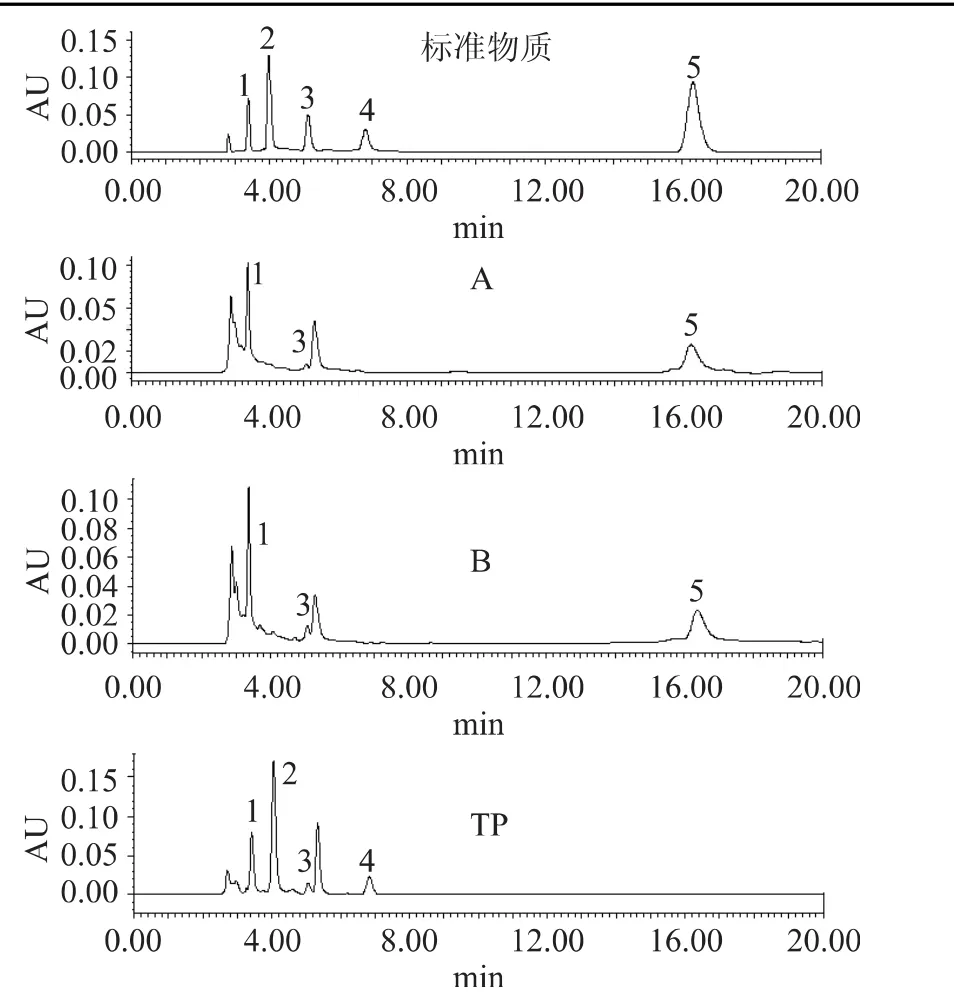
图1 芡种壳提取物和茶多酚的HPLC-UV图Fig.1 The HPLC potography of EFS extracts and tea polyphenols
2.2.2 紫外处理 将不同浓度的提取物溶液置于紫外灯下照射不同时间后取出,立即分析其总还原力和DPPH·清除活性。结果表明,所有提取物和TP、VC溶液对紫外线异常敏感,尤其是低浓度溶液,经30min照射后,芡种壳提取物的总还原力损失大半,TP和VC溶液总还原力损失96%以上。处理60min后,所有低浓度溶液还原力完全消失,高浓度溶液的损失也在45%以上,相比之下,两种芡种壳提取物损失较小(表4)。与灭菌处理相似的是,所有样品溶液在紫外处理后的DPPH·清除活性变化幅度不大,但是在较低浓度(0.05mg/mL)时,随紫外处理时间的延长,DPPH·清除活性显著降低(p<0.05),在较高浓度时,降低不显著(表5)。

表4 紫外处理后提取物溶液还原力损失率(%)Table 4 Reducing power lose rate of extracts and AA solutions in ultraviolet(%)
2.2.3 酸处理 将不同浓度的样品溶液用3.25mol/L的盐酸溶液处理1~3h后,测定其总还原力和DPPH·清除活性。结果表明,酸处理1h后,所有低浓度样品溶液的还原力均显著增高,其中芡种壳提取物还原力增加了1倍多。随样品溶液浓度的增加,酸处理后还原力增加幅度降低(表6)。一般认为,多酚类物质在酸性条件下比较稳定,但在较高的酸浓度下,一些多酚物质分子结构中的化学键(如糖苷键、酯键)可能会发生水解,产生了还原力更强的物质,从而导致样品溶液的还原力显著增加,如芡种壳提取物中检出的芦丁、儿茶素类物质。随酸处理时间延长,各样品还原力增加不显著(p<0.05)。酸处理条件下,各样品DPPH ·清除活性在处理1h后显著增加(p<0.05)并达到峰值,此后,随时间延长,增加不明显(表7)。
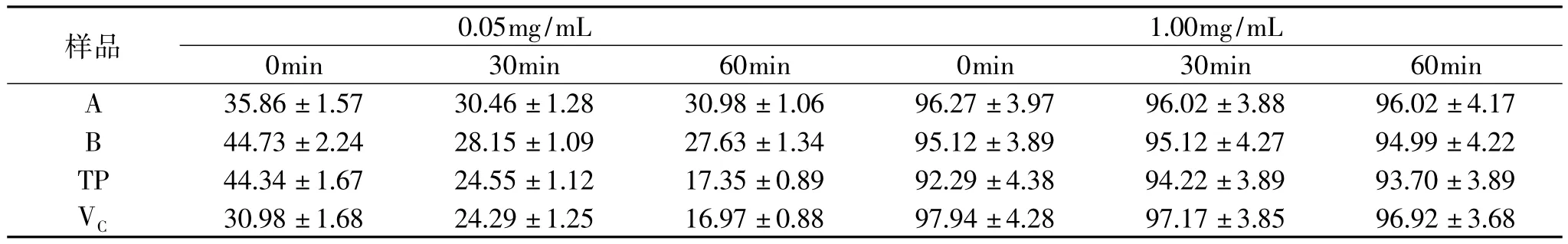
表5 紫外处理后样品溶液DPPH·清除活性变化(%)Table 5 The scavenging DPPH·activities of extracts treated with ultraviolet(%)
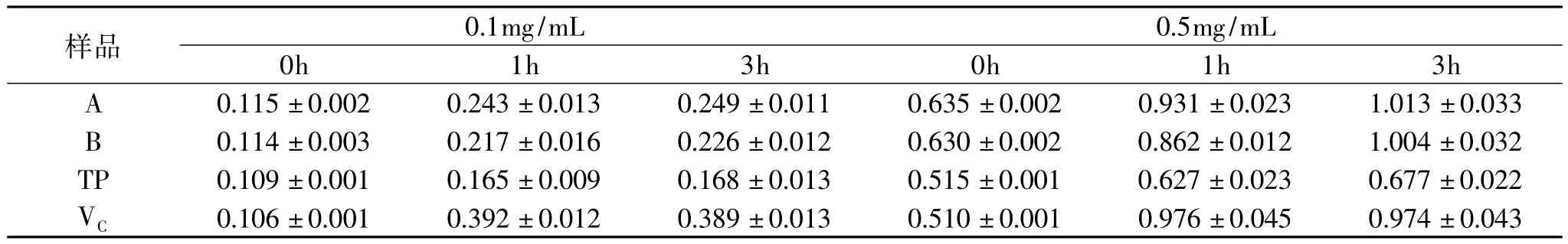
表6 酸处理下提取物总还原力变化Table 6 The total reducing power changes of extracts treated with acid
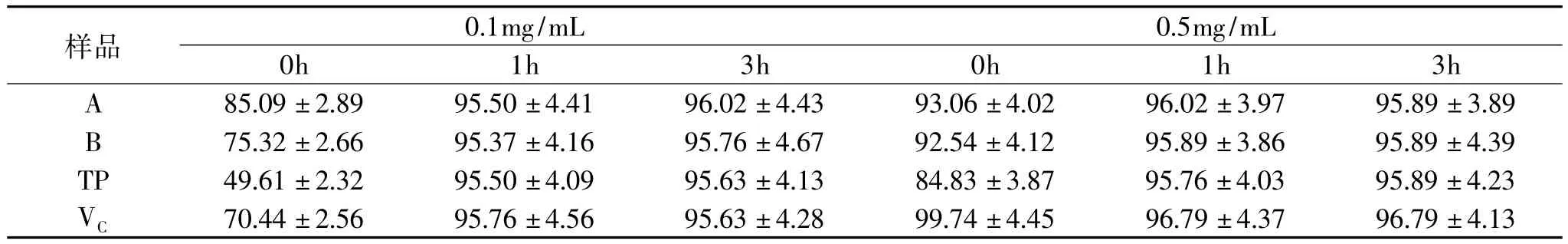
表7 酸处理下提取物DPPH·清除活性变化(%)Table 7 The DPPH·scavenging ability of extracts treated with acid(%)
2.2.4 碱处理 各样品溶液(5mL)中加入0.1mL 0.5mol/L的NaOH溶液,混合5min后分别测定其还原力和DPPH·清除活性。结果表明,所有样品溶液在碱性环境下均极不稳定,其还原力和DPPH·清除活性均损失大半,其中低浓度下损失更大(表8)。相同样品的还原力和DPPH·清除活性变化趋势不尽相同,还原力在高浓度下损失较少,而DPPH·清除活性损失率随样品浓度增加,变化不显著(p<0.05)。芡种壳提取物在碱性条件下极不稳定,这是因为酚类物质在碱性条件下会快速分解,从而导致其抗氧化性显著降低[23-24]。
3 结论
采用乙醇和50%乙醇分步浸提法,分别从芡种壳中得到两种提取物A和B,其中含有丰富的多酚类物质(763.65、517.04mg/g)和一定量的总糖(11.72、12.32mg/g),总样品得率超过 20%。HPLC-UV法分析结果表明,A和B两种芡种壳提取物中主要的多酚物质组分为:没食子酸(314.0、281.4mg/g)、儿茶素类、芦丁(54.68、44.81mg/g)和少量绿原酸。
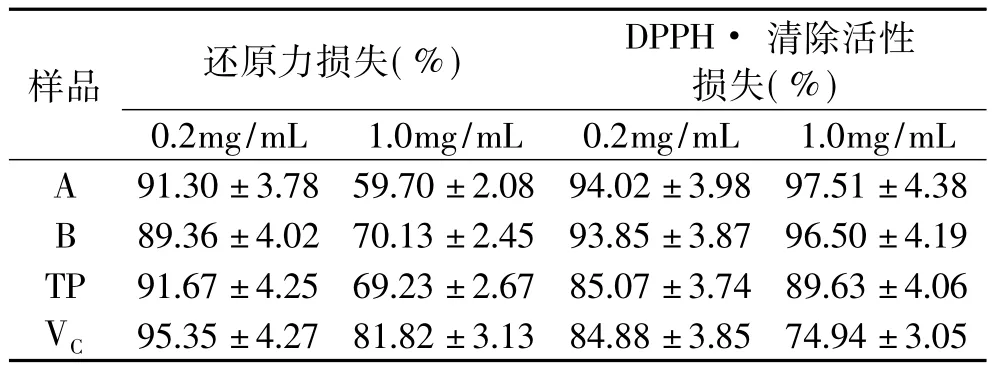
表8 碱处理下提取物还原力和DPPH·清除活性损失率(%)Table 8 The antioxidant capacities lose rate of extracts treated with alkali
抗氧化稳定性分析结果表明,芡种壳提取物对高压灭菌条件、紫外线处理和强碱性环境均非常敏感,尤其是碱性条件下,其抗氧化活性(还原力和DPPH·清除活性)几乎损失殆尽。在强酸性条件下,其还原力和DPPH·清除活性均会显著增加,原因可能是其中一些多酚分子发生水解,形成抗氧化性更强的物质。所以,芡种壳提取物可以考虑添加到一些酸性食品中。
[1]刘玉鹏,刘梅,刘俊英,等.30种中草药的抗氧化活性研究[J].烟台大学学报:自然科学与工程版,2000,13(1):70-73.
[2]李成良,陈学好,李良俊,等.芡实黄酮类物质的提取及抗氧化性研究[J].长江蔬菜:学术版,2010(14):57-61.
[3]Samarjit Das,Peter Der,Utpal Raychaudhuri,et al.The effect of Euryale ferox(makhana),an herb of aquatic origin,on myocardial ischemic reperfusion injury[J].Molecular and Cellular Biochemistry,2006,289:55-63.
[4]Jha V,Barat G K,Jha U N.A Nutritional evaluation ofEuryale feroxSalisb(Makhana)[J].Journal of Food Science and Technology,1991(8):326-328.
[5]张名位,池建伟,孙玲,等.潮州芡实的营养学评价[J].广东农业科学,1999(2):27-29.
[6]Lee S E,Mi J E,Hee K J.Antioxidant activity of extracts fromEuryale feroxseed[J].Experimental and Molecular Medicine,2002,34:100-106.
[7]Mamta Shankar,Neha Chaudhary,Dheer Singh.A review on gorgon nut[J].InternationalJournalofPhamaceutical&Biological Archives,2010(1):101-107.
[8]Puri A,Sahai R,Singh KL.Immunostimulant activity of dry fruits and plants materials used in Indian traditional medical system for mothers after child birth and invalids[J].Journal Ethnopharmacology,2000,71:89-92.
[9]JhaS N,Suresh Prasad.Determination ofProcessing Conditions for Gorgon Nut(Euryale ferox)[J].J Agric Engng Res,1996,63:103-112.
[10]邓宇.表面活性剂在芡实栲胶提取中作用的初步研究[J].化学工业与工程技术,2002,23(2):1-3.
[11]王和才.芡实种皮总鞣质的提取及含量测定[J].食品工业科技,2009,30(8):224-226.
[12]孙文凯,袁怀波,许卫,等.芡实壳提取物抗氧化能力研究[J].食品工业科技,2011,32(4):100-102.
[13]张汆,薛连海,贾小丽,等.D101树脂分离纯化芡实多酚的特性研究[J].食品科学,2009,30(20):260-264.
[14]Chung S Yang,Joshua D Lambert,Shengmin Sang.Antioxidative and anti-carcinogenic activities of tea polyphenols[J].Arch Toxicol,2009,83:11-21.
[15]Linette Castillo-Pichardo,Michelle M Martı'nez- Montemayor E,Joel E Martı'nez,et al.Inhibition of mammary tumor growth and metastases to bone and liver by dietary grape polyphenols[J].Clin Exp Metastasis,2009,26:505-516.
[16]Kyoichi Osada,Takashi Suzuki,Yuki Kawakami,et al.Dosedependent hypocholesterolemic actions of dietary apple polyphenol in rats fed cholesterol[J].Lipids,2006,41:133-139.
[17]张立华,张元湖,安春艳,等.石榴皮提取物的大孔树脂纯化及其抗氧化性能[J].农业工程学报,2009,25(增刊1): 142-147.
[18]Gulcin I,Huyut Z,Elmastas M,et al.Radical scavenging and antioxidant activity of tannic acid[J].Arabian Journalof Chemistry,2010(3):43-53.
[19]Roussis IG,Lambropoulos I,Tzimas P,et al.Antioxidant activities of some Greek wines and wine phenolic extracts[J].Journal of Food Composition and Analysis,2008,21:614-621.
[20]Chatchawan Chotimarkorn,Soottawat Benjakul,Nattiga Silalai.Antioxidant components and properties of five long-grained rice bran extracts from commercial available cultivars in Thailand[J].Food Chemistry,2008,111,636-641.
[21]Seok Hyum Nam,Sun Phil Choi,Mi Young Kang,et al.Antioxidative activities of bran extracts from twenty one pigmented rice cultivars[J].Food Chemistry,2006,94:613-620.
[22]Chang W Choi,Sei C Kin,Soon S Hwang,et al.Antioxidant activity and free radical scavenging capacity between korean medicinal plants and flavonoids by assay-guided comparison[J].Plant Science,2002,163:1161-1168.
[23]Huang D,Ou B,Prior RL.The chemistry behind antioxidant capacity assays[J].Journal of Agriculture and Food Chemistry,2005,53:1841-1856.
[24]Boyer J,Brown D,Liu RH.In vitro digestion and lactase treatment influence uptake of quercetin and quercetin glucoside by the Caco-2 cell monolayer[J].Nutrition Journal,2005(4):1-8.
Antioxidative stability of extracts fromEuryale feroxseed shell
ZHANG Cuan1,2,XU Xing-lian1,*,ZHOU Guang-hong1,LI Chun-bao1,LI Ling1
(1.Key Lab of Meat Processing and Quality Control,Ministry of Education,Nanjing Agricultural University,Nanjing 210095,China;
2.School of Biology and Food Engineering,Chuzhou University,Chuzhou 239000,China)
Two kinds of extracts,A and B,were obtained from Euryale ferox seed shell(EFS)extracted with ethanol and its 50%aqueous solution,respectively.The constituents and major polyphenols compounds in extracts were determined by HPLC-UV method,and the antioxidative stabilities under different environments were also investigated in present article.The results showed that there are highly content total phenol in extracts of A and B,they are 763.65and 517.04mg/g,respectively.The major polyphenols compounds in extracts were gallic acid(314.0 and 281.4mg/g),catechins,rutin(54.68 and 44.81mg/g)and little of chlorogenic acid.The analysis results of antioxidative stability indicated that two kinds of EFS extracts were very sensitive to the high pressure sterilization,ultraviolet and alkali,especially to the alkali,the total reducing power and DPPH radical scavenging ability of extracts completely lost.Treated with strong acid,the total reducing power and DPPH radical scavenging ability had not lost but significantly enhanced.So,the extracts from euryale ferox seed shell could be used in acidic food materials.
Euryale ferox seedshell(EFS)extracts;antioxidant activity;stability
TS201.2
A
1002-0306(2012)21-0057-05
2012-04-16 *通讯联系人
张汆(1970-),女,副教授,博士,主要从事食品化学与营养学、膳食蛋白、功能食品方面的研究。
公益性行业科研专项(200903012);江苏省科技成果转化专项基金(BA2009007);安徽省教育厅项目(KJ2012B128)。
