生石灰降低南极磷虾酶解液中氟含量的研究
2012-10-24吕传萍李学英杨宪时郭全友
吕传萍,李学英,杨宪时,*,郭全友
(1.中国水产科学研究院东海水产研究所,上海 200090; 2.上海海洋大学食品学院,上海 201306)
生石灰降低南极磷虾酶解液中氟含量的研究
吕传萍1,2,李学英1,杨宪时1,*,郭全友1
(1.中国水产科学研究院东海水产研究所,上海 200090; 2.上海海洋大学食品学院,上海 201306)
含氟量高是制约南极磷虾食品开发的一个重要因素,利用生石灰降低南极磷虾酶解液中的氟含量、成本低、效果好、无残留,可为南极磷虾商业化食品开发提供技术依据。吸附反应有多种类型,分析XRD图谱可知生石灰与南极磷虾酶解液中氟的吸附反应是离子反应。以降氟率为指标,生石灰添加量(X1)、初始pH(X2)、时间(X3)和温度为考察因素,对生石灰降低酶解液中氟含量进行了单因素实验和响应面优化实验,建立了二次响应面回归模型Y=84.49+ 4.29X1+2.77X2+0.18X3-0.93X1X2-1.09X2X3-2.11X21-0.55X22+0.81X23。在此基础上结合实际生产确定降氟最优条件为生石灰添加量0.009685g/mL,pH11.50,时间45min,温度(25±2)℃,此条件下降氟率达到88.25% ±1.43%(p<0.05)。降氟后,水解液中TCA-NSI降低了2.55%,DH降低了7.85%,说明生石灰对酶解液营养影响较小。反应后体系通过0.40μm滤膜除去Ca(OH)2和CaF2,实现降氟材料的无残留。
南极磷虾,降氟,生石灰,响应面
南极磷虾资源丰富,据估计最高有数亿吨,开发和利用潜力巨大。南极磷虾营养丰富,蛋白质、脂肪、矿质元素等含量高。其肌肉鲜样中含粗蛋白16.31%,必需氨基酸指数(EAAI)为54.94[1],含量满足FAO/WHO/UNU1985推荐的成年人对蛋白的摄入要求[2];粗脂肪含量为1.30%,不饱和脂肪(UFA)占67.6%[3];必需营养微量元素铁、锰、锌、铜的比例正常,且含硒量很高,是生物界硒的重要来源[1]。因此,南极磷虾应该作为人类的食品新资源来开发应用。目前世界各国的科学家们已经研发出部分南极磷虾产品,如“奥肯”蛋白块、虾糕以及南极磷虾香肠馅等;部分研究人员还从南极磷虾中提取具有功能性的虾油[4]及抗心血管疾病的功能性肽[5];还有研究将南极磷虾在生物酶的作用下酶解,制得高氨基酸和短肽含量的酶解液。南极磷虾体内含有大量的氟,德国科学家Soevik等人测得冰冻贮存的整体磷虾氟含量约为2400mg/kg。张海生等认为活着的磷虾中氟富集是一个主动吸收的过程。南极磷虾死后,甲壳中的氟会慢慢转移至肌肉中[6]。适量的氟有利于人类骨骼和牙齿的生长,但摄入过量会导致骨骼畸形[7]。根据中国营养学会推荐,成年人每天应摄取氟1.5~3mg,由此可见南极磷虾体内的氟远超人体的适应范围,氟含量过高的南极磷虾食品会影响人体健康。因此,为实现南极磷虾产品的可食用化,必须降低产品中的氟含量。目前降低溶液中氟含量的方法有很多,主要有化学沉淀法[8]、离子交换法[9]、滤膜法[10]、电解法[19]及吸附法[11]。在这些方法中,具有高效性和易操作性的吸附法最常用,现已开发出不同种类的吸附剂,例如活性氧化铝、骨碳、合成离子交换材料等[12]。吸附反应过程是指氟离子通过界面层的离子交换或表面化学反应[13]。但是很多降氟方法和工具都价格不菲或操作不便,且南极磷虾酶解液中含有大量营养成分和活性物质,降低氟含量的同时要求不能影响原有酶解液的营养功能,因此选择经济方便且降氟效率高的降氟方法很重要。生石灰价格便宜且降氟能力较好[14],降氟过程不会降低酶解液的营养价值,因此是一种理想的降氟方法。目前使用生石灰降低南极磷虾酶解液中的氟含量的方法尚未见报道,本研究以南极磷虾酶解液为原料,通过单因素实验和响应面设计优化降氟工艺,最终得到营养几乎未受损失的低氟量酶解液,为低氟化南极磷虾食品商业化开发提供理论依据。
1 材料与方法
1.1 材料与仪器
南极磷虾 我国“南极海洋生物资源开发利用项目组”于2010年1月南极FAO 48.1区捕捞,2010年4月冷冻条件运抵实验室,在-28℃条件下贮藏备用;Alcalase酶 实测酶活力109387U/g,Novozyme (中国)生物技术有限公司;生石灰、硫酸铜、硫酸钾、甲醛、氢氧化钠、盐酸、硼酸等 国药集团化学试剂有限公司,均为国产分析纯。
x’Pert PRO型X射线衍射仪 荷兰P Analytical公司;BioTek 213751型微孔板扫描分光光度计 美国Bio-Tek公司;CF 16XII型高速冷冻离心机 日本Hitachi公司;KIELETEC ANALYSISER全自动凯氏定氮仪 瑞典Foss公司;电热恒温水浴锅 上海精宏实验设备有限公司;85-2型恒温磁力搅拌器
上海梅颖浦仪器仪表制造有限公司;FA1004A型电子天平 上海精天电子仪器有限公司;testo 230型pH/温度测量仪 德图仪器上海有限公司;DS-1型组织捣碎机 上海精科实业有限公司;ZHWY-200H型恒温培养振荡器 上海智成科学仪器有限公司。
1.2 测定方法
1.2.1 酶活力的测定 改进的Folin-酚法[15]。
1.2.2 氟含量的测定方法 按GB/T5009.18-2003食品中氟的测定中氟离子选择电极法进行。
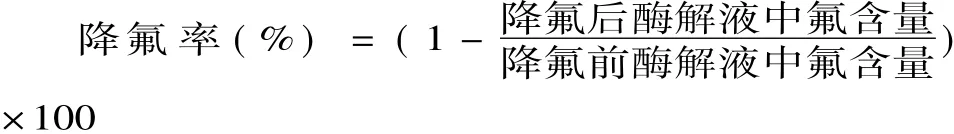
1.2.3 总氮测定 按GB/T5009.5-2003食品中蛋白质的测定中凯氏定氮法进行。
1.2.4 短肽得率测定 三氯乙酸可溶性氮法[16]。
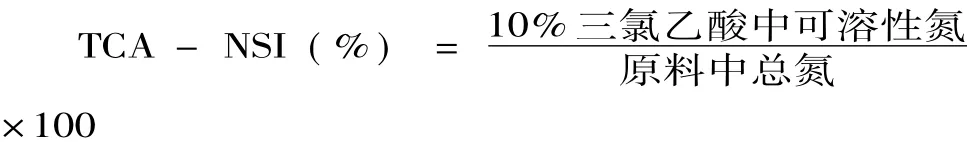
1.2.5 氨基态氮的测定 甲醛电位滴定法[17]。

1.3 实验方法
1.3.1 酶解液的制备 由正交旋转组合实验优化得到A lcalase酶水解南极磷虾的工艺为:酶解温度50.7℃,酶解时间239m in,加酶量3010U/g,pH8.01,固液比为南极磷虾∶蒸馏水=1∶3[18]。
1.3.2 生石灰的制备 生石灰于研钵中磨碎,过120目标准筛,实验前将生石灰置于90~105℃下烘干4h,于干燥器中储存。
1.3.3 反应机理的分析 用X射线粉末衍射仪分析生石灰与南极磷虾酶解液反应前后的图谱变化,分析该反应的机理。
1.3.4 降氟工艺的单因素实验 基于生石灰在其他氟溶液中的应用条件[14],生石灰降低南极磷虾酶解液中氟含量的基本条件定为:生石灰添加量0.01g/m L,pH11.50,时间75m in,温度(25±2)℃。改变其中的一个条件,固定其它条件分别分析其对生石灰降低酶解液中氟含量的影响。各因素浓度梯度为:添加量0.001~0.012g/mL;pH2.00~14.00(使用浓度为0.01mol/L的NaOH溶液调节);时间4~120min;温度2~50℃。
1.3.5 响应面法优化降氟工艺 通过单因素实验发现,温度对生石灰降低南极磷虾酶解液中氟含量的影响较小,当温度为(25±2)℃时即可满足条件,因此选择CaO添加量(X1)、初始pH(X2)、时间(X3)3个因素进行响应面优化实验。按Box-Bohnken设计法每因素取3水平,以降氟率为响应值,使用Design Expert 8.0.5进行数据分析,建立响应曲面模型,以得到最优降氟工艺。因素设计表如表1所示。

表1 响应面因素设计表Table 1 Factors design of response surface
2 结果与分析
2.1 XRD图谱分析
图1为生石灰吸附氟离子前后的XRD图谱。吸附反应前后XRD图谱变化较大,其中a图谱在2θ= 37°、54°、32°、64°和67°出现明显的峰,这与CaO标准样(01-077-2376)在强度、峰位置以及峰高上匹配良好;b图谱在2θ=34°、51°、28°、47°、54°、63°、37°出现明显的峰,这与 Ca(OH)2标准样(00-044-1481)匹配得分达88,与CaF2也有良好的匹配,可见生石灰与溶液反应后形成Ca(OH)2,部分Ca(OH)2又与溶液中的F-反应形成CaF2。这说明,生石灰吸附氟离子的反应是一个离子交换的化学反应过程。
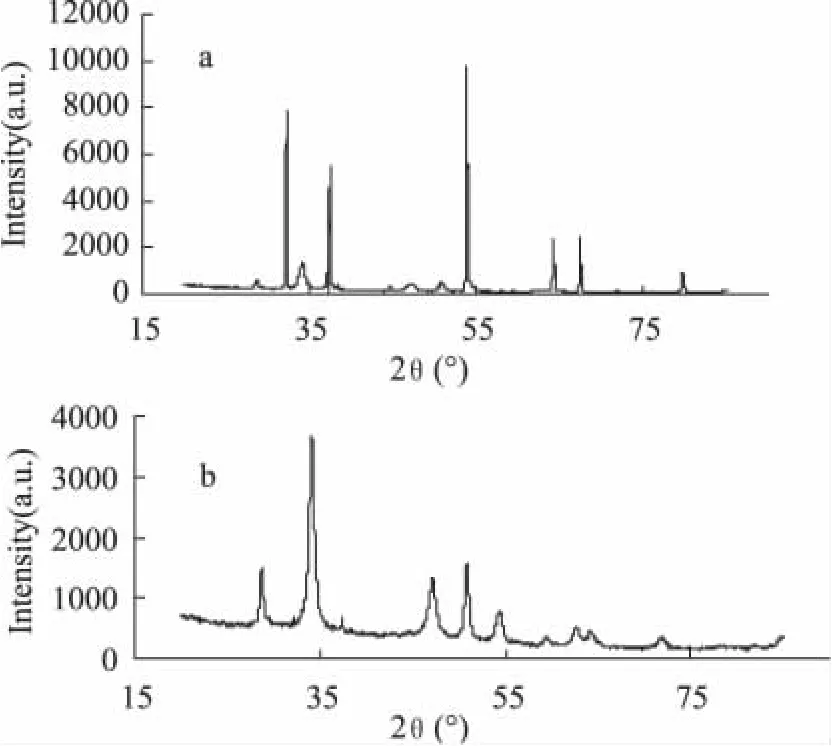
图1 生石灰XRD衍射图谱Fig.1 XRD patterns of quick lime
2.2 氟离子标准曲线的绘制
按GB/T5009.18-2003食品中氟的测定中的氟离子选择电极法获得氟离子标准曲线为y=-50.722x+290.18,R=0.9997。其中y为电位(mV),x为氟离子浓度的对数(),线性关系良好。测得
1.3.1条件下南极磷虾水解液中氟含量为17.17mg/kg。
2.3 生石灰降低南极磷虾酶解液中氟含量的单因素实验
2.3.1 生石灰添加量的确定 实验以生石灰添加量10-3g/m L为基础,逐步提高生石灰添加量来研究其对降氟率的影响。如图2所示,生石灰添加量为1× 10-3~7×10-3g/m L范围内,随着生石灰添加量的增加,降氟率从21.26%迅速增加到74.67%,涨幅为53.41%,而生石灰添加量为7×10-3~12×10-3g/m L范围内,降氟率只增加了8.56%,这说明生石灰添加量为0.14g时即接近添加量高点,同时,由于添加过量的生石灰会造成酶解液的酸涩味和苦味,因此生石灰的添加量并非越多越好,故选择7×10-3~10× 10-3g/m L响应面因素取值范围。这可能是由于当生石灰量过高时,活性部位重叠导致降氟速率下降,活性部位的减少导致交换粒子的凝集[19]。
2.3.2 pH的确定 实验分析了pH2.00~13.00范围内降氟率的变化情况。由图3可知,当pH11.50时降氟率达到最大,为82.47%,比pH2.00时高46.19%,比pH13时高3.55%。因此选择11.50为反应的最适pH。根据钙盐在其他降氟实验中的应用条件发现pH选择范围为7.0~11.8[20]。生石灰在溶液中部分以Ca2+形式存在,若溶液环境呈碱性,则Ca2++2OH-= Ca(OH)2反应向右进行,加速生石灰中Ca2+的释放,但由于该反应是可逆反应,当反应达到平衡时,OH-量的增加不会引起Ca2+量的变化,反而由于生成的Ca(OH)2微溶于水而造成Ca2+浓度的下降,因此本实验选择pH10.00~11.50为响应面因素取值范围。
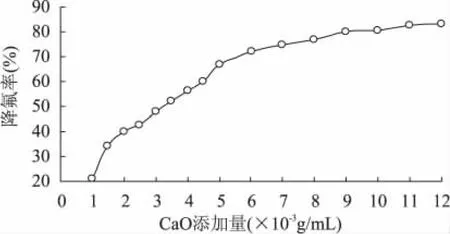
图2 生石灰添加量对降氟率的影响Fig.2 Effect of CaO doseage on fluoride removal rate

图3 pH对降氟率的影响Fig.3 Effect of pH on fluoride removal rate
2.3.3 时间的确定 不同时间条件下生石灰降低南极磷虾酶解液中氟含量如图4所示。反应时间为4m in时,降氟率即已达到78.92%,反应时间为75m in时,降氟率为83.23%,之后再增加反应时间降氟率没有任何变化。这说明生石灰吸附南极磷虾酶解液中氟离子的反应是一个快速的过程。因为生石灰吸附氟离子是化学反应过程,反应速率大,短时间内即可完成,因此4min内降氟率已达到很高,但由于F-和OH-存在竞争作用,该竞争作用存在下反应达到平衡时所需的时间为75m in,之后溶液体系是一个平衡体系,F-浓度不再发生变化,即降氟率维持83.23%不变。但由于反应时间增长会相对降低反应速率,结合工业生产上的设备利用率及能耗等问题,选择45~75min为响应面因素取值范围。
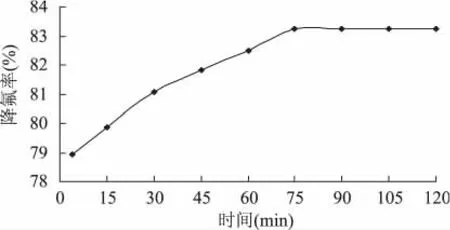
图4 时间对降氟率的影响Fig.4 Effect of time on fluoride removal rate
2.3.4 温度的确定 由图5可知,当反应温度为2℃时,降氟率为76.88%,当反应温度为25℃时,降氟率为83.23%,之后,再增加反应温度降氟率没有变化。这说明温度为室温25℃是该反应的最佳温度。在实际实验或生产过程中,25℃是室温环境,同时避免了高温或低温引起的成本和能源的浪费,因此,生石灰降低南极磷虾酶解液中氟含量的温度即取25℃。

图5 温度对降氟率的影响Fig.5 Effect of temperature on fluoride removal rate
2.4 响应面实验结果分析
2.4.1 响应面实验结果及方差分析 根据表3的方差分析结果知,模型的p值极显著(p<0.0001),失拟项不显著(p=0.3830>0.05),模型的复相关系数=97.31%,说明残差相互独立,建立的模型极显著,失拟项不显著,实验误差小,因此本实验建立的回归模型可信。
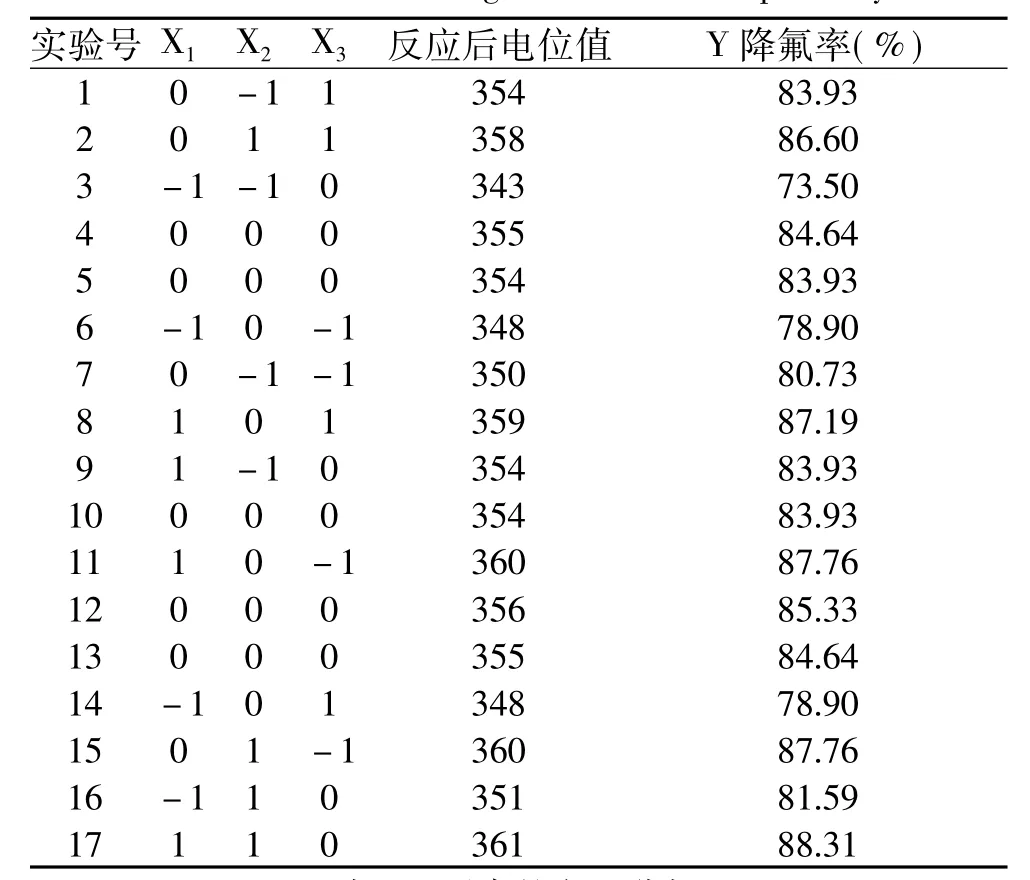
表2 Box-Bohnken设计方案及响应值结果Table 2 Box-Bohnken design scheme and responsivity result
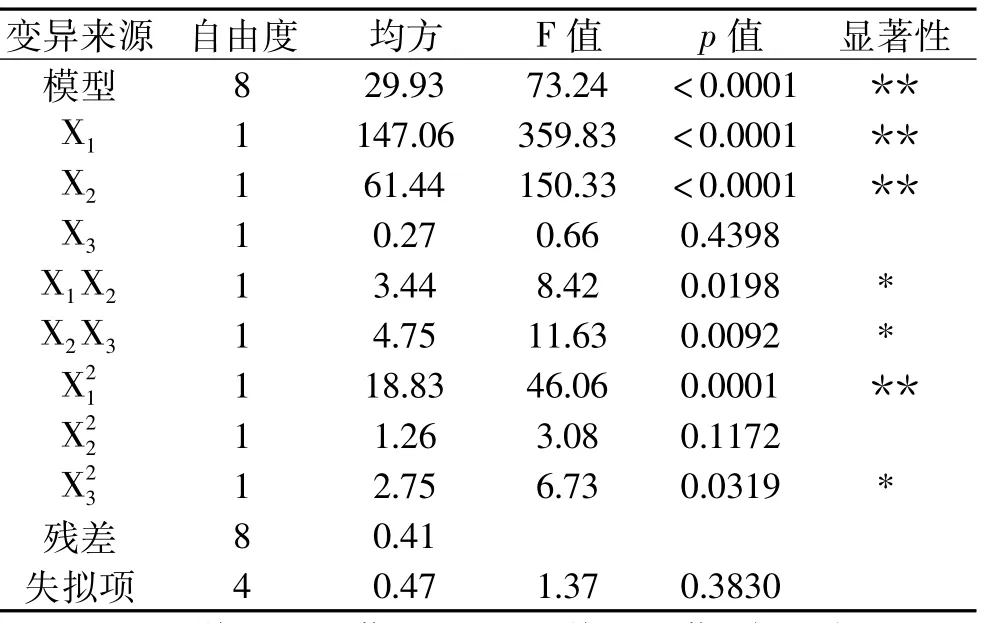
表3 因素的方差分析Table 3 Variance analysis of factors
使用Design Expert 8.0.5对实验结果进行二次多元回归拟合,手动除去不显著的项X1X3得到的回归模型方程为:Y=84.49+4.29 X1+2.77 X2+0.18 X3-0.93 X1X2-1.09 X2X3-2.11-0.55+0.81,其中Y为降氟率。
根据回归模型得到降氟率最大时的优化组合为X1=0.79,X2=1.00,X3=-1.00,即生石灰添加量为0.009685g/m L,pH11.50,时间为45m in时,生石灰对南极磷虾酶解液中氟离子的吸附能力最强,达到89.77%。最优组合同单因素实验结果基本一致。
2.4.2 响应曲面分析 手动优化后,图6和图7为回归方程中的交互项所作的响应曲面图。从图6中可以看出,在给定范围内,降氟率随着pH的升高而增大,随着生石灰添加量的增加而增大,随着时间的延长而增大。且生石灰添加量与pH的交互作用比较显著,而与时间的交互作用影响不显著,这与模型数据分析结果一致。
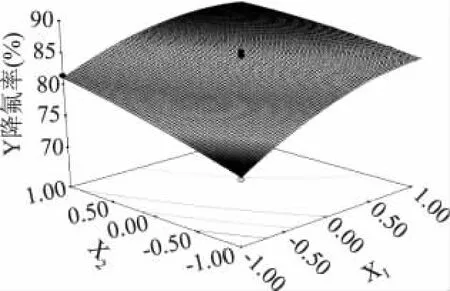
图6 生石灰添加量和初始pH对除氟率的影响Fig.6 Effect of addition amount of quick lime and original pH on fluoride removal rate
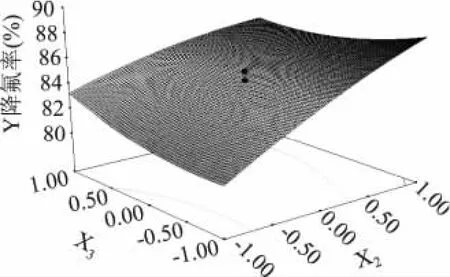
图7 时间和初始pH对除氟率的影响Fig.7 Effect of time and original pH on fluoride removal rate
2.4.3 验证实验 根据回归模型得到降氟率最大时的优化组合即生石灰添加量为0.009685g/m L,pH为11.50,时间为45m in,温度为(25±2)℃条件下进行3次验证实验,所得降氟率为88.25%±1.43%,实际值与预测值有着良好的吻合性。
2.4.4 水解液中营养物质的变化 生石灰在降低南极磷虾水解液中氟含量的同时可能会对水解液中的营养物质产生影响。因此,以短肽得率和氨基态氮为指标来反应水解液中营养物质的变化情况。表4反映了生石灰加入南极磷虾水解液前后TCANSI和DH的变化,从表4中数据可知,生石灰加入南极磷虾水解液后TCA-NSI降低了2.55%,DH降低了7.85%。根据图1生石灰加入南极磷虾水解液前后XRD图谱变化情况可知,反应后除了Ca (OH)2和CaF2外,并未引入其他新的杂质,因此可以认为加入生石灰后对南极磷虾的营养成分含量影响不大。
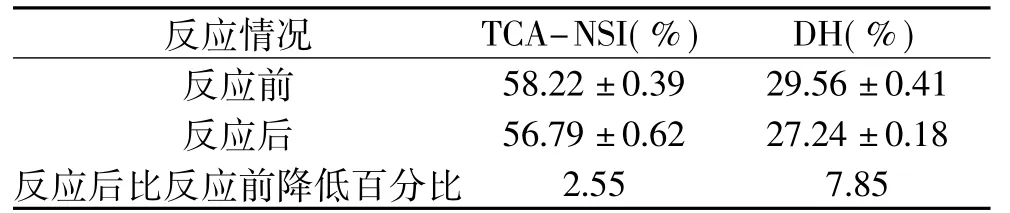
表4 反应前后TCA-NSI和DH的变化Table 4 Changes in TCA-NSIand DH before and after reaction
2.4.5 反应结束后降氟材料的去除 由于生石灰与南极磷虾水酶液中氟离子反应结束后溶液是固液混合体系,为了实现南极磷虾酶解液的食用,必须去除该体系中悬浮的Ca(OH)2和CaF2。本实验采用将水解液通过直径为0.40μm的滤膜,沉淀物Ca(OH)2和CaF2会被过滤在滤膜之外,滤液即为降低了氟含量的南极磷虾水解液。残留的钙离子浓度为0.02mol/L,满足人体需求。
3 结论
生石灰能降低南极磷虾酶解液中的氟含量,该反应是离子型吸附反应。
以降氟率为指标,以生石灰添加量(X1)、初始pH(X2)、时间(X3)为因素,对生石灰降低酶解液中氟含量进行了响应面优化实验,建立了二次响应面回归模型 Y=84.49+4.29X1+2.77X2+0.18X3-0.93X1X2-1.09X2X3--+。在此基础上结合实际生产确定降氟最优条件为生石灰添加量 0.009685g/m L,pH11.50,时间 45m in,温度(25±2)℃,此条件下降氟率达到88.25% ±1.43% (p<0.05)。
生石灰对酶解液营养影响较小。以短肽得率(TCA-NSI)和水解度(DH)为指标来反应水解液中营养物质的变化情况,降氟实验结束后,水解液中TCA-NSI降低了2.55%,DH降低了7.85%。
反应后体系通过0.40μm滤膜除去Ca(OH)2和CaF2,实现降氟材料的无残留,此时溶液中钙离子浓度为0.02mol/L,满足人体健康需求。
[1]孙雷,周德庆,盛晓风.南极磷虾营养评价与安全性研究[J].海洋水产研究,2008,29(2):57-64.
[2]Chen Y C,Tou J C,Jaczynski J.Amino acid and mineral composition of protein and other components and heir recovery yields from whole Antarctic krill(Euphausia superba)using isoelectric solubilization/precipitation[J].J Food Sci,2009,74 (2):31-39.
[3]刘丽,刘承初,赵勇,等.南极磷虾的营养保健功效以及食用安全性评价[J].食品科学,2010,31(17):443-447.
[4]Kassis N,Beamer S K,Matak K E,et al.Nutritional composition of novel nutraceutical egg products developed with omega-3 rich oils[J].LWT-Food Science and Technology,2010,43(8):1204-1212.
[5]Bunea R,Deutsch L.Evaluation of the effects of neptune krill oil on the clinical course of hyperlipidemia[J].Alternative Medicine Review,2004,9(4):420-428.
[6]Janet C,Jacek J,Chen Y.Krill for human consumption: nutritional value and potential health benefits[J].Nutrition Reviews,2007,65(2):63-77.
[7]Wang Y,Chen N P,Wei W,et al.Enhanced adsorption of fluoride from aqueous solution onto nanosized hydroxyapatite by low-molecular-weight organic acids[J].Desalination,2011,276 (1-3):161-168.
[8]Yang M,Zhang Y,Shao B,et al.Precipitative removal of fluoride from electronics wastewater[J].J Environ Eng,2001,127:902-907.
[9]Liu R X,Guo J L,Tang H X.Adsorption of fluoride,phosphate,and arsenate ions on a new type of ion exchange fiber[J].JColloid Interface Sci,2002,248(2):268-274.
[10]Tahaikt M,Habbani R,Haddou A,et al.Fluoride removal from groundwater by nanofiltration[J].Desalination,2007,212 (1-3):46-53.
[19]Amor Z,Bariou B,Mameri N,et al.Fluoride removal from brackish water by electrodialysis[J].Desalination,2001,133(3): 215-223.
[11]Tripathy S,Bersillon J,Gopal K.Removal of fluoride from drinking water by adsorption onto alum-impregnated activated alumina[J].Separation and Purification Technology,2006,50 (3):310-317.
[12]Mohapatra M,Anand S,Mishra B,et al.Review of fluoride removal from drinking water[J].JEnviron Manage,2009,91(1): 67-77.
[13]Yang C L,Dluhy R.Electrochemical generation of alumina sorbent for fluoride adsorption[J].J Hazard mater B,2002,94:239.
[14]Islam M,Patel R K.Evaluation of removal efficiency of fluoride from aqueous solution using quick lime[J].Journal of Hazardous Material,2007,143(1-2):303-310.
[15]Kamarudlin M S,Jones D A,Vay L L,et al.Ontogenetic change in digestive enzyme activity during larval development of macrobrachium rosenbergii[J].Aquaculture,1994,123:320-324.
[16]Jang A,Lee M.Purification and identification of angiotensin converting enzyme inhibitory peptides from beef hydrolysates[J]. Meat Sci,2005,69:653-661.
[17]张宇昊,王强.Alcalase酶水解花生蛋白制备花生短肽的研究[J].农业工程学报,2007,23(4):258-263.
[18]吕传萍,李学英,杨宪时,等.南极磷虾酶解工艺优化及模型建立[J].食品科学,2011,32(18):142-147.
[19]Tahir H.Comparative trace metal contents in sediments and liquid wastes from tanneries and the removel of chromium using Zeolite-5A[J],EJEAF Chem,2005,4(4):1021-1032.
[20]王歆然,石健,严淑,等.pH对氯化钙除氟效率的影响研究[J].消费导刊,2008(7):71-72.
Study on removal efficiency of fluoride from Antarctic krill hydrolyzate using quick lime
LV Chuan-ping1,2,LIXue-ying1,YANG Xian-shi1,*,GUO Quan-you1
(1.East China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Shanghai200090,China; 2.Food Science College of ShanghaiOcean University,Shanghai201306,China)
High-fluorine was a significant fac tor to restrict the develop ing of Antarc tic Krill in food industry.In this article,quick lim e was used to reduce fluorine content in Antarc tic Krill hyd rolyzate,this method was low-cost,effective and non-residual,so it p rovided technical references for comm ercialapp lication of Antarc tic Krillas food. There were quantities of kinds of absorp tion reac tion,the reaction between quick lime and fluoride from Antarctic krill hyd rolyzate was p roved to be ionic reac tion by analyzing XRD patterns.With fluoride removal rate as index,evaluation of removalefficiency of fluoride from Antarctic krillhyd rolyzate using quick lime was studied w ith sing le factor experiments and response surface op tim ization experiments,which inc luded quick lime add ition(X1),initial pH(X2),tim e(X3)and tem perature.Simultaneously,secondary response surface reg ression m odel was estab lished,which was Y=84.49+4.29 X1+2.77 X2+0.18 X3-0.93 X1X2-1.09 X2X3-2.11 X21-0.55 X22+0.81 X23,in which Y was fluoride rem oval rate.On this basis,combined w ith the p ractice,the op timal technology conditions were as follows:quick lime additive dosage 0.009685g/m L,pH 11.50,time 45m in,tem perature(25±2)℃,under this cond ition,fluoride removal rate was 88.25% ±1.43%(p<0.05).After defluorination,TCA-NSI of hyd rolyzate reduced by 2.55%,DH of hyd rolyzate reduced by 7.85%,which p roved that nutrition constituents in Antarctic krill hyd rolyzate changed little.After defluorination reac tion,all of quick lime changed into Ca(OH)2and CaF2,as sed iment,they could be removed by 0.40μm filtration membrance,so the material of defluoridation was removed com p letely.
Antarc tic krill;fluoride removal;quick lime;response surface
TS254.1
A
1002-0306(2012)12-0106-05
2011-10-24 *通讯联系人
吕传萍(1986-),女,研究方向:食品新产品开发与质量安全。
国家“863”计划项目(2011AA090801);中央级公益性科研院所基本科研业务费专项(2011T05)。
