不同方法提取艾纳香叶挥发性成分的气相色谱-质谱分析
2012-10-24王远辉田洪芸何思佳胡乾鹏王洪新邹纯礼
王远辉,田洪芸,2,何思佳,胡乾鹏,王洪新,3,*,邹纯礼,王 兴
(1.江南大学食品学院,江苏无锡 214122; 2.山东省产品质量监督检验研究院,山东济南 250103; 3.江南大学食品科学与技术国家重点实验室,江苏无锡 214122; 4.贵州艾源生态药业开发有限公司,贵州罗甸 550100)
不同方法提取艾纳香叶挥发性成分的气相色谱-质谱分析
王远辉1,田洪芸1,2,何思佳1,胡乾鹏1,王洪新1,3,*,邹纯礼4,王 兴4
(1.江南大学食品学院,江苏无锡 214122; 2.山东省产品质量监督检验研究院,山东济南 250103; 3.江南大学食品科学与技术国家重点实验室,江苏无锡 214122; 4.贵州艾源生态药业开发有限公司,贵州罗甸 550100)
采用气相色谱-质谱法(GC-MS)分析水蒸汽蒸馏法(SD)、同时蒸馏萃取法(SDE)和顶空固相微萃取法(HSSPME)3种方法提取的艾纳香叶挥发性成分。结果表明:3种方法提取艾纳香叶挥发性成分中主要是醇类和烯类化合物,其中萜类物质占较大比例。3种方法的提取物中分别鉴定出化合物50种(SD)、24种(SDE)和49种(HS-SPME)。水蒸汽蒸馏法和同时蒸馏萃取法提取的油状挥发物中主要成分相似,水蒸汽蒸馏法提取油状挥发物与顶空固相微萃取法提取挥发性成分的种类和相对含量相似,同时蒸馏萃取法提取油状挥发物中低沸点化合物较少。
水蒸汽蒸馏,同时蒸馏萃取,顶空固相微萃取,气质联用,艾纳香叶,挥发性成分Analysis of volatile com ponents from
艾纳香(Blumeabalsamifera(L.)DC.)为菊科艾纳香属(Compositae)植物,是贵州罗甸县的地道药材[1]。艾纳香叶和嫩枝可制取艾片(左旋龙脑)和艾纳香挥发油[2]。艾纳香挥发油有独特香气,具有抗菌、消炎、消肿、止痛等作用,受到医疗美容和香精香料行业的亲睐。挥发油的传统提取方法为水蒸汽蒸馏法,郝小燕等[3],周欣等[4],杜萍等[5],Bhuiyan等[6]都使用水蒸汽蒸馏法(steam distillation,SD)制取艾纳香挥发油,并研究其组成,但是水蒸汽蒸馏耗时长,馏出水量大,萃取时消耗溶剂量大,操作繁琐。近几十年多种挥发油提取方法得到发展,同时蒸馏萃取法(simultaneous distillation extraction,SDE)是水蒸汽蒸馏与溶剂萃取二合为一,用于提取挥发油可减少操作步骤,节省萃取溶剂,设备相对简单[7]。顶空固相微萃取 (headspace solid-phase m icroextraction,HS-SPME)是一种集采样、萃取、浓缩、进样于一体的无溶剂样品预处理技术,具有处理时间短、不使用有机溶剂、真实反映样品中挥发性物质组成等优点[8],适用于艾纳香叶挥发性物质组成分析。本研究利用气质联用(GC-MS)技术分析SD和SDE提取的艾纳香叶油状挥发物,并分析HS-SPME提取的艾纳香叶挥发性物质组成,对三者的化学成分进行对比,为选择合适的艾纳香叶油状挥发物的提取方法提供参考。
1 材料与方法
1.1 材料与仪器
艾纳香叶 贵州艾源生态药业开发有限公司(样品采摘时间为2010年11月,产地贵州省罗甸县);所用试剂 均为分析纯。
Varian 1200L GC/MS-MS气相色谱质谱联用仪美国Varian公司;DB-5弹性石英毛细管柱 30m ×0.25mm,0.25μm,美国Agilent公司;Supleco固相微萃取装置、75μm CAR/PDMS萃取头 美国Supelco公司。
1.2 实验方法
1.2.1 水蒸汽蒸馏 称取艾纳香叶粉碎物(60~80目)50.00g置于2000m L圆底烧瓶中,加入1000m L去离子水,电热套加热蒸馏,蒸馏过程中持续加入去离子水以补充馏出水,馏出液达到5000m L时停止蒸馏(耗时约10h),合并馏出液,用等体积石油醚(30~60℃)萃取1h,分液,加入无水硫酸钠干燥,以上操作重复3次(共使用原料约150g)。合并石油醚,水浴加热 50℃回收石油醚,最终获得黄色挥发物4.4907g,得率为 2.99%。将黄色挥发物与石油醚(30~60℃)按1∶5(g∶m L)配制成溶液,4℃存放24h进行重结晶,分出晶体,剩余物挥干石油醚,得到黄色油状挥发物质量 1.4132g,得率为 0.94%,用于GC-MS分析。以上实验平行3次。
1.2.2 同时蒸馏萃取 称取艾纳香叶粉碎物(60~80目)50.00g置于2000m L圆底烧瓶中,加入1000m L去离子水,电热套加热(与1.2.1项保持相同加热强度);在另一500m L烧瓶中加入200m L石油醚(30~60℃),水浴加热50℃,同时蒸馏萃取10h,取下石油醚相烧瓶,加无水硫酸钠干燥,以上操作重复3次(共使用原料约150g)。合并石油醚,水浴加热50℃回收石油醚,最终获得黄色挥发物4.62g,得率为3.08%。将黄色挥发物与石油醚(30~60℃)按1∶5 (g∶m L)配制成溶液,4℃存放24h进行重结晶,分出晶体,剩余物挥干石油醚,得到黄色油状挥发物质量1.9067g,得率为1.27%,用于GC-MS分析。以上实验平行3次。
1.2.3 固相微萃取 称取艾纳香叶5g置于样品瓶中,用聚四氟乙烯隔垫密封,使用CAR/PDMS萃取头进行萃取,环境温度45℃条件下顶空吸附30min。以上实验平行3次。
1.3 仪器条件
1.3.1 色谱条件 升温程序:初温40℃保持3m in,然后以8℃·m in-1升至280℃,保持10m in;进样口温度250℃;载气(He)流速1.0m L·m in-1。萃取头在进样口于250℃解析3m in。
1.3.2 质谱条件 电子轰击离子源(EI),离子源温度200℃,电子能量70eV,发射电流34.6(A,检测器电压 1000V,接口温度 280℃,扫描质量范围35~500amu。
1.3.3 数据处理 采集到的质谱图同时与NIST和W iley标准谱库对照,对组分定性,仅报道正反匹配度均大于800(最大值1000)的鉴定结果。用峰面积归一法计算各化学成分的相对含量。
2 结果与分析
2.1 SD、SDE提取油状挥发物和HS-SPME提取挥发性物质成分
采用SD和SDE提取艾纳香叶油状挥发物,并用HS-SPME提取艾纳香叶挥发性物质,联合GC-MS技术对3个提取物样品进行分析,初步定性组分70种,其中有50种属于萜类化合物,萜烯种类最多,共30种,其他依次为萜醇16种、萜酮2种、萜醛1种、萜酯1种。图1为3个样品的GC-MS总离子图。通过谱库检索和分析,检出3个样品的成分组成见表1。3个样品的相对含量前5位的组分中,l-龙脑与樟脑香气相似,具有类似松木的气息,香气清凉尖刺,微带药香、胡椒香;(E)-石竹烯具有辛香、木香、柑橘香、樟脑香,温和的丁香香气;花椒素具有浓郁的花椒香气;桉叶醇具有桉树特有的气味和樟脑气息,并有清凉的草药味道;(+)-γ-古芸烯具有古芸香脂香气;(E)-罗勒烯具有草香、花香并伴有橙花油气息[9-13]。从高相对含量组分的香气特征发现,3个样品的主体香气相似,以清凉的樟脑香和花椒香气为主,而油状挥发物的气味浓郁,这与作者的直观嗅觉结果一致。
2.2 SD提取油状挥发物和HS-SPME提取挥发性物质比较
SD提取油状挥发物和HS-SPME提取挥发性物质共同含有组分35种,在两样品的组分中相对含量分别为89.28%和86.67%,其中萜类32种。共有醇类13种,相对含量分别为57.51%和21.09%,萜醇12种;酮类2种,樟脑属萜酮;醚类1种,即百里氢醌二甲醚;酯类1种,即乙酸龙脑酯;烯类18种,全是萜烯,相对含量分别为19.06%和54.93%。以上数据表明,两者共有组分种类占总种类数近70%,相对含量之和占各自总量近90%,可充分代表自身的香气特征,两者主体香气特征相似。不同类别化合物在两样品中相对含量差异极大,主要表现在醇类、酮类和烯类物质,相对含量相差近3倍。SD油状挥发物中醇类物质相对含量普遍高于HS-SPME挥发性物质中2倍以上,而HS-SPME挥发性组分中烯类物质相对含量普遍高于SD油状挥发物中。从单一组分上看,SD油状挥发物中l-龙脑、樟脑和HS-SPME挥发性物质中(+)-γ-古芸烯、(E)-石竹烯的相对含量都超出对方近3倍,并且这几种组分都是高含量组分。

图1 HS-SPME(A)、SD(B)和SDE(C)提取组分的GC-MS总离子图Fig.1 GC-MS total ion chromatogram of components of HS-SPME(A),SD(B)and SDE(C)
SD油状挥发物独有组分15种(萜类7种),相对含量为3.17%,其中醇类4种(0.78%),酮类2种(0.24%),醛类2种(0.3%),酯类1种(0.44%),烯类2种(0.24%),苯环类1种(0.66%)、烷烃类1种(0.26%)和酸类2种(0.25%);HS-SPME挥发性物质中独有组分 14种(萜类 11种),相对含量为4.56%,其中醇类1种(0.28%),酮类2种(0.26%),烯类11种(4.02%)。以上数据表明,两者各自独有组分相对含量较低,除罗汉柏烯-13外都不足1%,SD油状挥发物独有组分主要是高沸点化合物,HSSPME挥发性物质中独有组分主要是烯类化合物,易被氧化。由于SD提取过程蒸馏温度(100℃)远高于HS-SPME提取过程温度(45℃),因此低沸点、低含量、易氧化分解化合物不易保留,而高沸点化合物被收集得到。两者独有组分相对含量不高,对自身香气影响不大,可认为SD油状挥发物与HS-SPME提取的挥发性化合物组成相似。一般认为HS-SPME提取的挥发性化合物更接近原始样品的香气组成,因此可认为SD油状挥发物代表艾纳香原始香气。经作者本人嗅闻认为油状挥发物气味较浓郁,可认为油状挥发物浓缩了艾纳香叶香气成分。
2.3 SDE油状挥发物和HS-SPME提取挥发性物质比较
SDE油状挥发物和HS-SPME挥发性物质共同含有组分18种,在SDE和HS-SPME提取组分中相对含量分别为88.21%和62.45%,其中萜类16种。共有醇类12种,相对含量分别为61.44%和20.78%,萜醇12种;酮类1种,即花椒素;醚类1种,即百里氢醌二甲醚;烯类4种,全是萜烯,相对含量分别为9.29%和31.81%。以上数据表明,两者共有组分相对含量之和相差大,不同类别化合物在两样品中相对含量差异极大,主要表现在醇类、酮类和烯类物质,相对含量相差近3倍。SDE油状挥发物中醇类物质相对含量普遍高于HS-SPME挥发性物质中近3倍,而HS-SPME挥发性物质中烯类物质相对含量普遍高于SDE油状挥发物中近3倍。从单一组分上看,SDE油状挥发物中 l-龙脑、(-)-愈创木醇、10-表位-γ-桉叶醇、γ-桉叶醇、4,4-二甲基-四环[6.3.2.0(2,5).0(1,8)]十三碳-9-醇、β-桉叶醇、绿花白千层醇和花椒素的相对含量超出HS-SPME挥发性物质中2倍以上;HS-SPME挥发性物质中(E)-石竹烯、α-石竹烯和别香橙烯的相对含量都超出SDE油状挥发物中近5倍,两者间差异较大。
SDE油状挥发物独有组分6种(萜类1种),相对含量为4.5%,其中酮类1种(1.37%),醛类1种(0.51%),酯类3种(2.26%),烯类1种(0.36%); HS-SPME挥发性物质中独有组分31种(萜类27种),相对含量为28.92%,其中醇类2种(0.59%),酮类3种(0.82%),酯类1种(0.36%),烯类25种(27.15%)。以上数据表明,两者独有组分相对含量差异巨大,SDE油状挥发物独有组分相对含量之和较小,主要是高沸点的酯类化合物,HS-SPME挥发性物质中独有组分相对含量之和较大,主要是低含量烯类化合物。由于SDE过程中蒸馏和萃取温度较SD过程还高,低沸点、低含量、易氧化、酯化化合物更不易保留,因此SDE油状挥发物中酯类物质较多。两者间共有组分与独有组分的化合物种类和相对含量差异较大,SDE油状挥发物并不能充分代表艾纳香挥发性成分,但是经作者嗅闻认为差异并不明显,只是油状挥发物气味较浓郁。
2.4 SD与SDE提取油状挥发物成分比较
两油状挥发物共同含有组分17种,在SD和SDE提取油状挥发物中相对含量分别为79.38%和85.48%,其中萜类15种。共有醇类11种,相对含量分别为56.78%和58.71%,都属萜醇;酮类1种,即花椒素;醚类1种,即百里氢醌二甲醚;烯类4种,全是萜烯,相对含量分别为12.53%和9.29%。以上数据表明,两者共有组分几乎涵盖了各自相对含量超过1%的全部组分,相对含量之和占总量80%左右,足以代表自身的香气特征。两油状挥发物的组分种数相差巨大,SD油状挥发物组分总数比SDE多26个,SD油状挥发物独有组分33种(萜类23种),相对含量为13.7%,其中醇类 6种(1.51%),酮类 3种(2.68%),醛类2种(0.3%),酯类2种(0.64%),烯类16种(6.77%),苯环类1种(0.66%)、烷烃类1种(0.26%)和酸类2种(0.25%);SDE油状挥发物独有组分 7种,相对含量为 7.23%,其中醇类 1种
(2.73%),酮类1种(1.37%),醛类1种(0.51%),酯类3种(2.26%),烯类1种(0.36%)。SD油状挥发物中独有的醇类和烯类化合物达22种,大部分属于低沸点或低含量化合物,SDE油状挥发物中独有组分都是高沸点化合物。此结果可能是因为SDE过程中萃取温度(50℃)高于 SD过程中萃取温度(<20℃),经过长时间运行,低沸点和易氧化化合物难以保留。两油状挥发物共有组分相对含量之和接近,不同类别组分的相对含量差值不大,独有组分种类差异大,但是相对含量低,因此可认为两油状挥发物的组分相似,经作者嗅闻认为两者气味相似。
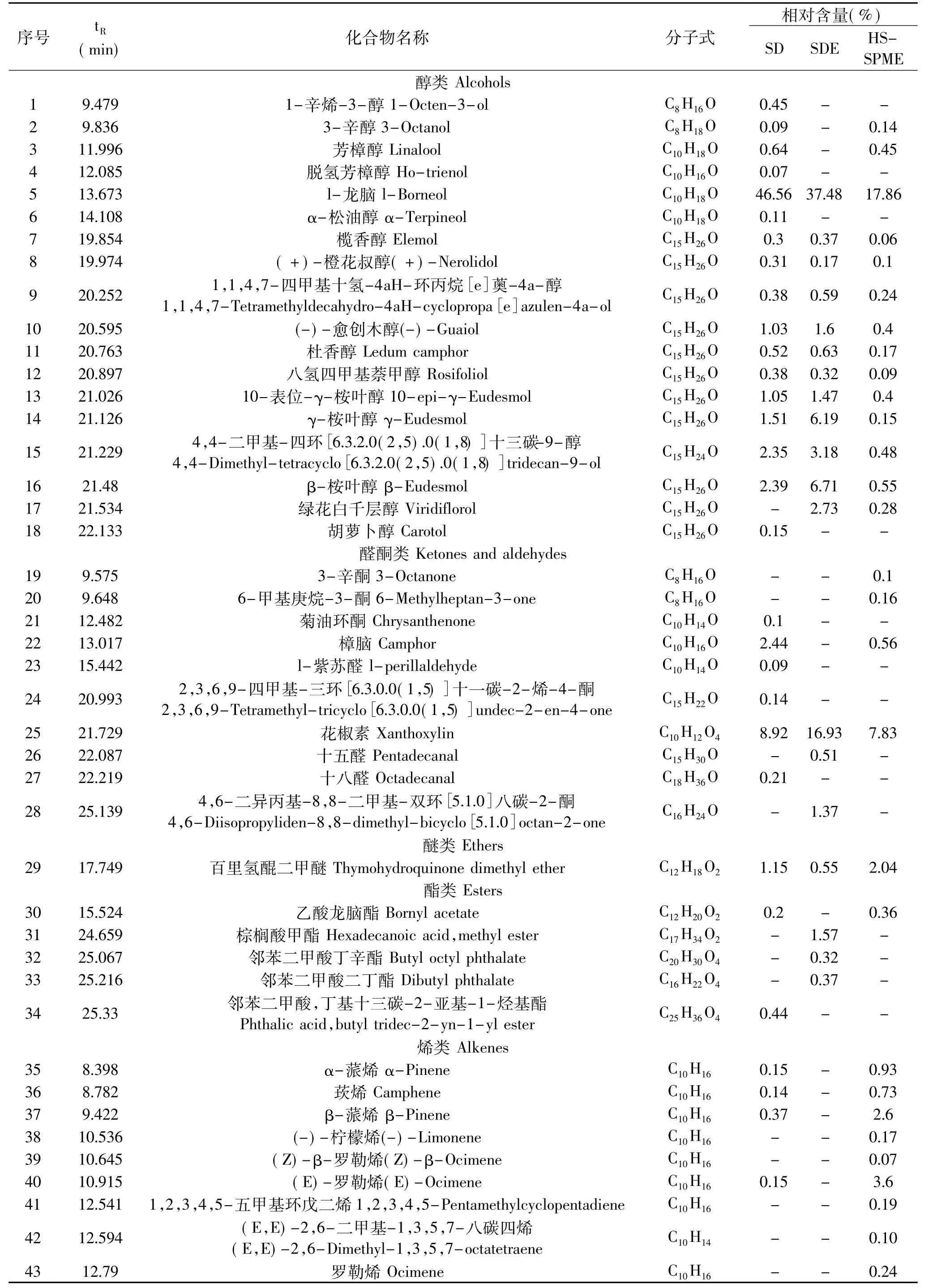
表1 SD、SDE和HS-SPME提取成分组成Table 1 Components of SD,SDE and HS-SPME

续表
综上所述,艾纳香叶挥发性成分中主要为醇类和烯类物质,其中大部分都是萜类物质,樟脑香和花椒香为其主体香气。SD油状挥发物中所含组分比SDE油状挥发物中丰富,保留较多低沸点、低含量化合物,与HS-SPME提取挥发性成分相比,又多收得高沸点化合物。SDE油状挥发物组分种类少,含有高沸点化合物种类较多。由此认为,SD提取的油状挥发物更接近原料挥发性成分组成,SDE提取的油状挥发物组成与原料挥发性成分差异稍大,不适合提取低沸点化合物。而艾纳香叶中低沸点化合物含量低,因此认为SD和SDE油状挥发物组成差异不大。
分析艾纳香挥发性成分时,HS-SPME更能反映艾纳香的香气组成,但是对高沸点化合物提取效果不佳;SDE提取的组分少,但是对高沸点化合物提取效果好;SD提取的组分接近原料的挥发性成分组成,但是耗时长,耗溶剂多,操作繁琐;综合考虑,HS-SPME和SDE并用可达到满意的分析效果。制取艾纳香油状挥发物时,HS-SPME不适用,只能用于检测;SD虽提取组分丰富,但是消耗大,成本高; SDE虽提取组分少,但是基本代表原料的挥发性成分,经作者初步感官评价差异不明显,而且此法用水和溶剂量都大大减少,过程简化,设备简单,成本降低,适合应用于大规模制取艾纳香油状挥发物。
3 结论
利用SD和SDE提取艾纳香叶油状挥发物,并利用HS-SPME提取艾纳香叶挥发性成分,再结合气质联用技术对其进行分析,初步定性出挥发性成分70种,以醇、烯类物质居多,且多为萜类物质。与HS-SPME提取挥发性成分相比,SD油状挥发物保留艾纳香叶挥发性组分较多,SDE油状挥发物中低沸点化合物少,由于艾纳香叶中低沸点化合物含量较低,所以两油状挥发物主要成分相似,其中相对含量最高的是l-龙脑。SDE与SD相比,操作简单,消耗少,成本低,具有良好的工业化应用前景。本实验对不同提取方法制得的艾纳香叶油状挥发物和艾纳香叶挥发性成分组成进行分析,为选择合适的艾纳香叶挥发性成分提取分析方法和艾纳香叶油状挥发物制取方法提供参考。本实验中油状挥发物的嗅觉感官评价由作者直观评判,而油状挥发物的感官特征由香气物质的种类、数量、单个物质的感觉阈值及其之间的相互作用决定,因此有待于结合嗅觉感官分析进一步研究证实。
[1]林镕.中国植物志[M].北京:科学出版社,1979:19-20.
[2]中国药典[S].一部.2010.
[3]郝小燕,余珍,丁智慧.黔产艾纳香油状挥发物化学成分研究[J].贵阳医学院学报,2000(2):121-122.
[4]周欣,杨小生,赵超.艾纳香油状挥发物化学成分的气相色谱-质谱分析[J].分析测试学报,2001(5):76-78.
[5]杜萍,张先俊,孙晓东.滇产艾纳香叶油状挥发物化学成分的GC-MS分析[J].林产化学与工业,2009(2):115-118.
[6]BHUIYAN M N I,CHOWDHURY JU,BEGUM J.Chemical components in volatile oil from Blumea balsamifera(L.)DC.[J]. Bangladesh Journal of Botany,2009,38(1):107-109.
[7]KRUEGER H.Characterisation of chamomile volatiles by simultaneous distillation solid-phase extraction in comparison to hydrodistillation and simultaneous distillation extraction[J].Planta Medica,2010,76(8):843-846.
[8]HO C W,WAN AIDA W M,MASKAT M Y,et al. Optimization of headspace solid phase microextraction(HSSPME)for gas chromatography mass spectrometry(GC-MS) analysis of aroma compound in palm sugar(Arenga pinnata)[J]. Journal of Food Composition and Analysis,2006(19):822-830.
[9]黄致喜,王慧辰.萜类香料化学[M].北京:中国轻工业出版社,1999:273-286.
[10]纪莹,钱海峰,周惠明.固相微萃取与气-质联用分析菊花曲奇饼干的香气成分[J].食品与生物技术学报,2005(3): 87-93.
[11]康文怀,徐岩,范文来,等.基于HS-SPME和GC/MS定量分析杨梅特征香气成分[J].食品工业科技,2009(12): 380-384.
[12]宋国新,余应新,王林祥,等.香气分析技术与实例[M].北京:化学工业出版社,2008:20-33.
[13]孙宝国,郑福平,谢建春,等.香精配方手册[M].北京:化学工业出版社,2005:3-74.
Blumeabalsamifera(L.)DC.leafw ith different extraction methods by gas chromatography-mass spectrometry
WANG Yuan-hui1,TIAN Hong-yun1,2,HE Si-jia1,HU Qian-peng1,WANG Hong-xin1,3,*,ZOU Chun-li4,WANG Xing4
(1.School of Food Science and Technology,Jiangnan University,Wuxi214122,China; 2.Shandong Supervision and Inspection Institute for Product Quality,Jinan 250103,China; 3.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi214122,China; 4.Guizhou Ai Yuan Eco-Pharmaceutical Development Co.,Ltd.,Luodian 550100,China)
The volatile components in leaf of Blumea balsam ifera(L.)DC.were extracted by steam d istillation(SD),simultaneous d istillation extrac tion(SDE)and headspace solid-phase m icro-extraction(HS-SPME)and analyzed by gas chromatog raphy-mass spec trometry(GC-MS).The result ind icated that the m ost volatile com pounds extracted by three methods were alcohols and alkenes,in which terpenoids accounted for a large p roportion.The chem ical components which were extracted by three methods were identified 50(extrac ted by SD),24(extrac ted by SDE)and 49(extracted by HS-SPME)kinds of compounds respectively.Main oily volatile components from SD and SDE were sim ilar,species and relative content of oily volatile com ponents from SD and volatile components from HS-SPME were sim ilar,oily volatile com ponents from SDE inc luded less low boiling point com pounds.
steam d istillation;simultaneous d istillation extraction;headspace solid-phase m ic ro-extrac tion; GC-MS;Blumea balsam ifera(L.)DC.leaf;volatile com ponents
TS207.3
A
1002-0306(2012)12-0097-06
2011-10-11 *通讯联系人
王远辉(1983-),男,博士生,主要从事食品功能因子方面的研究。
科技型中小企业技术创新基金(11C26215205838);贵州省科技型中小企业技术创新基金(黔科合字【2011】5002号)。
