α-转移葡萄糖苷酶的转苷作用机理探究
2012-10-24黄金莲黄秀娟钟振声
黄金莲,黄秀娟,钟振声
(华南理工大学化学与化工学院,广东广州 510640)
α-转移葡萄糖苷酶的转苷作用机理探究
黄金莲,黄秀娟,钟振声*
(华南理工大学化学与化工学院,广东广州 510640)
通过用高效液相色谱(HPLC)全程跟踪转苷反应过程的方法,对α-转移葡萄糖苷酶将麦芽糖转变为异麦芽糖的酶促反应作用机理进行了探讨。结果表明,在转化过程中α-转移葡萄糖苷酶先把麦芽糖的α-1,4糖苷键打断,分解为两个葡萄糖单元,然后再通过α-1,6糖苷键连接的方式重新键合,完成从麦芽糖到异麦芽糖的异构化过程。而由麦芽糖生成异麦芽糖的整个转苷过程是在分子内进行的。与此同时,由麦芽糖分解出来的部分葡萄糖单元通过分子间作用的方式与麦芽糖或异麦芽糖发生反应,生成潘糖或者异麦芽三糖。
α-转移葡萄糖苷酶,异麦芽糖,催化,机理,转苷
α-转移葡萄糖苷酶(α-transglucosidase E.C. 2.4.1.24)又称α-葡萄糖苷酶(α-glucosidase E.C.3.2.1.20),是工业生产低聚异麦芽糖(IMO)的关键酶之一,在国内外食品工业界备受重视。它广泛分布在自然界中,种类繁多,性质各异,几乎存在于所有生物体内,在人类的糖原降解及动物、植物和微生物的糖类代谢方面具有重要的生理功能[1]。我国对α-转移葡萄糖苷酶的研究主要集中在菌种的筛选和应用以及体外抑制等方面[2-8],对其性质、化学结构尤其是催化作用机理等方面的报道较少[9-10]。目前国内食品工业生产IMO所用的α-转移葡萄糖苷酶主要来自进口,而且主要用于生产,并未对其进行系统深入的研究。作者对日本天野制药公司生产的α-转移葡萄糖苷酶对麦芽糖的转苷作用机理进行了探究,初步确定其催化机理为分子内转化机理,为科学用酶提供理论依据。麦芽糖是由两个葡萄糖分子通过α-1,4糖苷键连接而成的双糖,异麦芽糖是由两个葡萄糖分子通过α-1,6糖苷键连接而成的双糖。有文献[11]报道α-转移葡萄糖苷酶的催化过程分两步完成,第一步α-转移葡萄糖苷酶的活性中心与底物结合;第二步进行催化反应生成产物。据此加上转苷过程中葡萄糖的含量增多的事实,作者推断,转化过程中在α-转移葡萄糖苷酶的酶促反应作用下,麦芽糖分子中α-1,4糖苷键发生断裂,水解成两分子葡萄糖;然后两分子葡萄糖通过α-1,6糖苷键重新组合,生成异麦芽糖。结构见图1。问题是,上述分子重组有可能是通过分子内作用的方式发生,也有可能通过分子间作用的方式来完成。两种不同的作用机理会导致不同的反应结果,反应产物存在差异。控制反应的手段也有所不同。分子间重组机理,示意图见图2。分子内重组机理,示意图见图3。如果是分子间重组机理,只要体系内存在葡萄糖分子,在α-转移葡萄糖苷酶的酶促作用下都能够生成异麦芽糖,达到反应平衡时,剩余的葡萄糖比较少,而且应该保持一个恒定值,不随时间延长而变化。如果是分子内重组机理,在α-转移葡萄糖苷酶的酶促作用下麦芽糖生成异麦芽糖的过程不受反应体系内其他糖存在的影响,例如体系内原来存在的葡萄糖分子不会转变为异麦芽糖。反应过程中葡萄糖的含量会呈现出先升高后下降的过程。本文将通过分析实验数据,讨论上述两种过程的可能性,并确定转苷过程到底是分子内还是分子间过程。
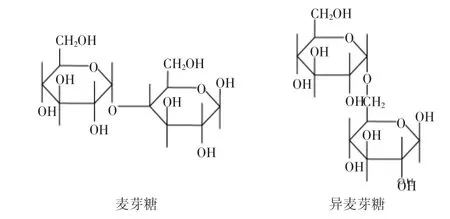
图1 麦芽糖和异麦芽糖的结构图Fig.1 Structures of maltose and isomaltose
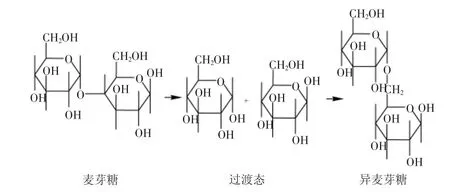
图2 分子间过程示意图Fig.2 Process of intermolecular
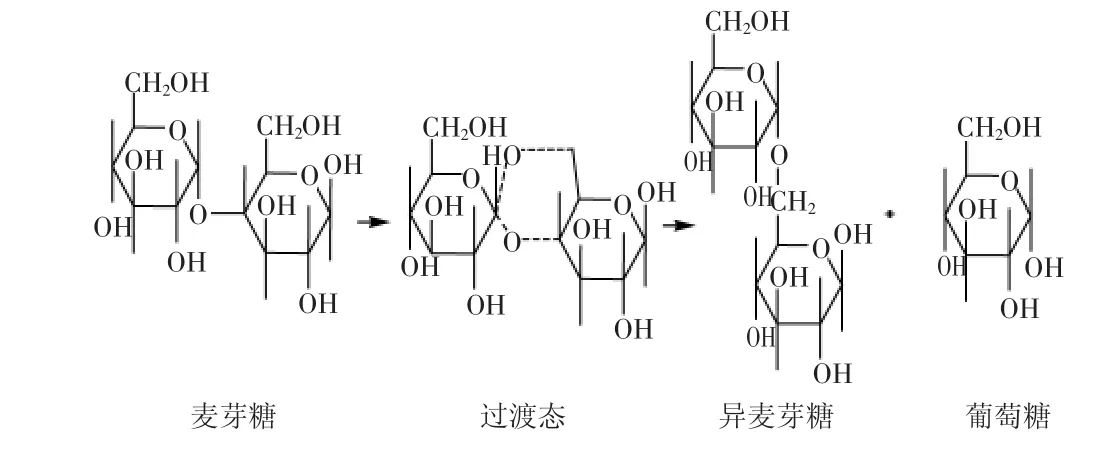
图3 分子内过程示意图Fig.3 Process of intramolecular
1 材料与方法
1.1 材料与仪器
α-转移葡萄糖苷酶 日本天野制药公司中国上海代理商;葡萄糖、麦芽糖 上海伯奥生物科技有限公司。
SHZ-82A恒温振荡器 常州澳华仪器有限公司;高效液相色谱仪Agilent1100和waters1525。
1.2 实验方法
1.2.1 麦芽糖转苷实验 分别将分析纯的葡萄糖和生化试剂的麦芽糖加蒸馏水调配成质量分数为30%的糖浆,调合适的pH,分别加入相当于糖干物质质量5‰的α-转移葡萄糖苷酶,在(58±1)℃的温度下用振荡器恒温振荡反应预定的时间。
1.2.2 糖液成分分析 高效液相色谱法:色谱柱Ultimate Column Ultimate XB-NH2,5μm,4.6×250mm;流动相乙腈∶水=70∶ 30;流速1mL/min;柱温35℃,柱压8.27×106Pa左右,进样量20μL;检测器温度35℃。用标准样品确定各色谱峰的归属,用峰面积归一化计算各成分的相对比例。
2 结果与分析
2.1 麦芽糖转苷过程单双糖成分的变化
以麦芽糖为起始物,用高效液相色谱(HPLC)全程跟踪α-转移葡萄糖苷酶将麦芽糖转变为异麦芽糖的转苷反应过程,谱图见图4~图6,数据列于图7和表1。
可以明显地观察到体系中葡萄糖的变化。随着反应进程,产生了葡萄糖,并且比例大幅度上升,由7.15%最高升至56.36%,而与此同时麦芽糖逐渐减少,异麦芽糖生成并且比例逐渐增加至某个平衡值。此结果预示着麦芽糖的转苷过程有一个先水解为葡萄糖的过程。
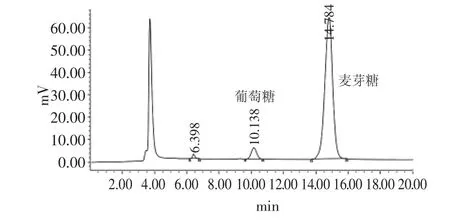
图4 起始麦芽糖图谱Fig.4 HPLC of initial maltose
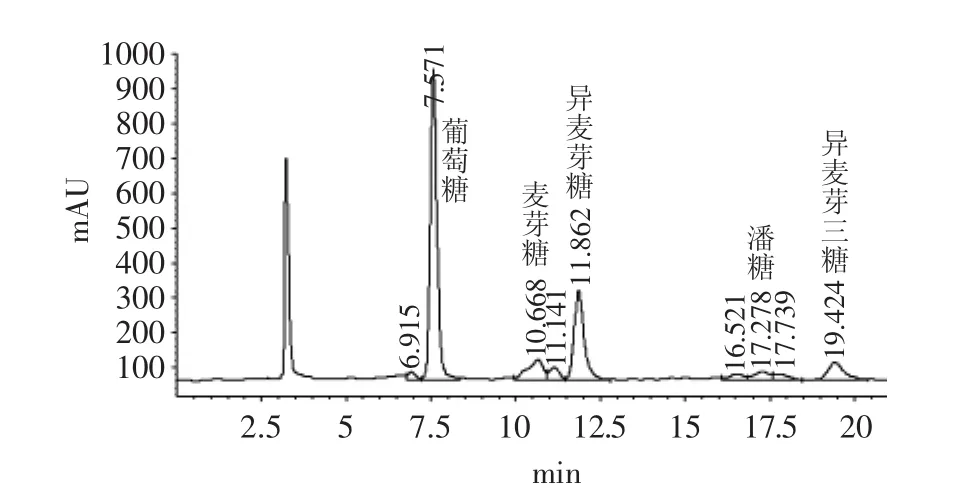
图5 麦芽糖转苷16h液相图谱Fig.5 HPLC of 16th hour’s glycoside transferred maltose
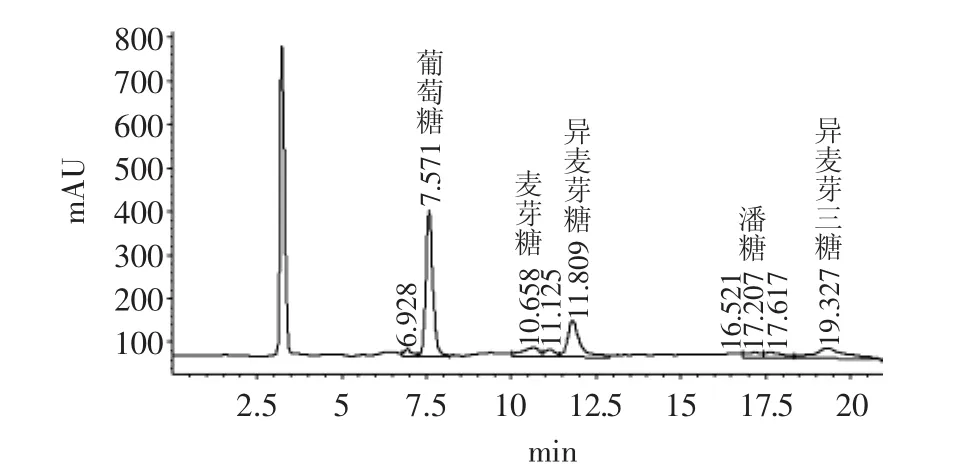
图6 麦芽糖转苷32h液相谱图Fig.6 HPLC of 32th hour’s glycoside transferred maltose
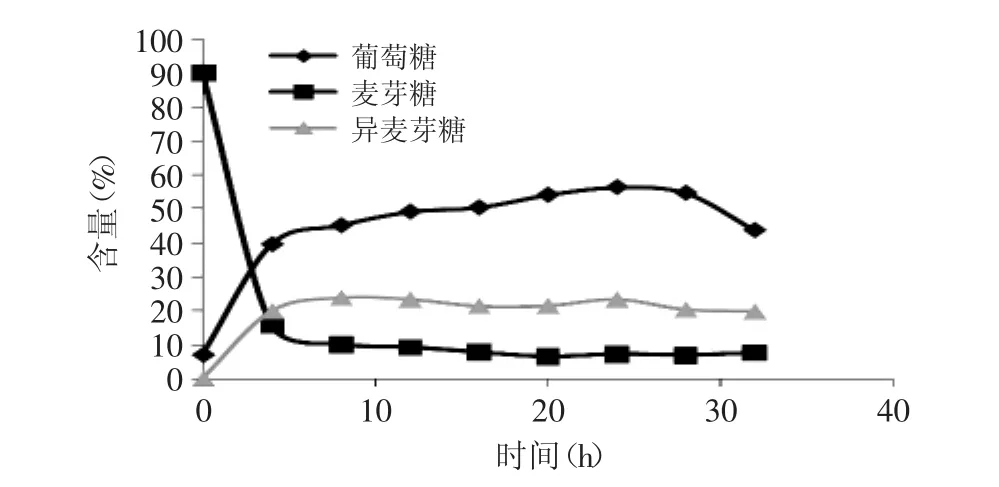
图7 转苷过程中单糖和二糖含量变化Fig.7 Content of monosaccharide and disaccharide in the transferring process
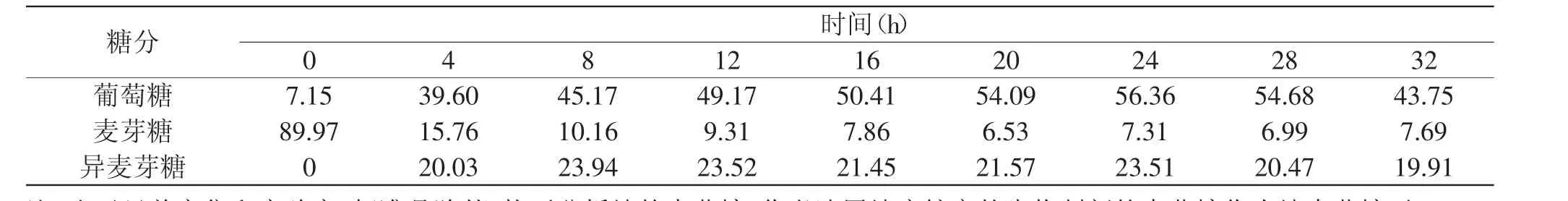
表1 麦芽糖转变为异麦芽糖过程的糖分变化情况(%)Table 1 Sugar contents during maltose changed into isomaltose(%)
2.2 单纯葡萄糖转苷实验结果
采用分析纯葡萄糖作为起始物,加入α-转移葡萄糖苷酶进行反应,用高效液相色谱(HPLC)全程跟踪糖分的变化。实验结果如表2。
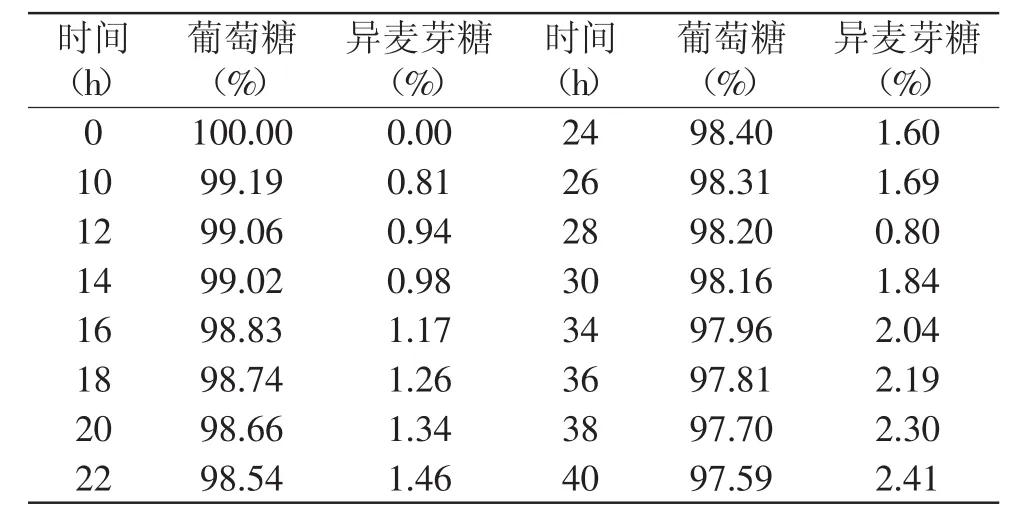
表2 纯葡萄糖转苷实验结果Table 2 Results of pure glycosides glucose-transferred
尽管反应时间延长到40h,体系中葡萄糖和异麦芽糖的比例变化不超过3%。也就是说,α-转移葡萄糖苷酶不能把处于游离状态的葡萄糖通过糖苷键连接成为双糖。
由此可以合理地推测,在α-转移葡萄糖苷酶的酶促反应作用下,麦芽糖分子中α-1,4糖苷键发生断裂,再重组为α-1,6糖苷键连接的异麦芽糖分子[12],反应过程中虽然先水解产生葡萄糖,但所产生的葡萄糖并非处于游离状态,而是局限在很近的距离,彼此之间存在某种范德华作用力互相牵制。也就是说,所产生的葡萄糖不是一种中间体,而只是处于过渡状态,单糖分子在分子内发生转移,甚至有可能是α-1,4糖苷键断裂与α-1,6糖苷键生成是同步进行的。转苷过程应该是在分子内发生的,遵从分子内反应机理。
相反,如果转苷过程是分子间反应机理,由麦芽糖水解出来的葡萄糖超出了分子的距离,处于游离状态,那么用外加的葡萄糖也应该能够在α-转移葡萄糖苷酶的酶促反应作用下生成异麦芽糖。实验事实是相反的,所以分子间反应机理应该不成立。
2.3 麦芽糖转苷过程三糖含量的变化
在上述由麦芽糖作为起始物的转化反应中观察到,除了生成异麦芽糖以外,还有数量不少的三糖,包括潘糖和异麦芽三糖生成。实验结果见图8。
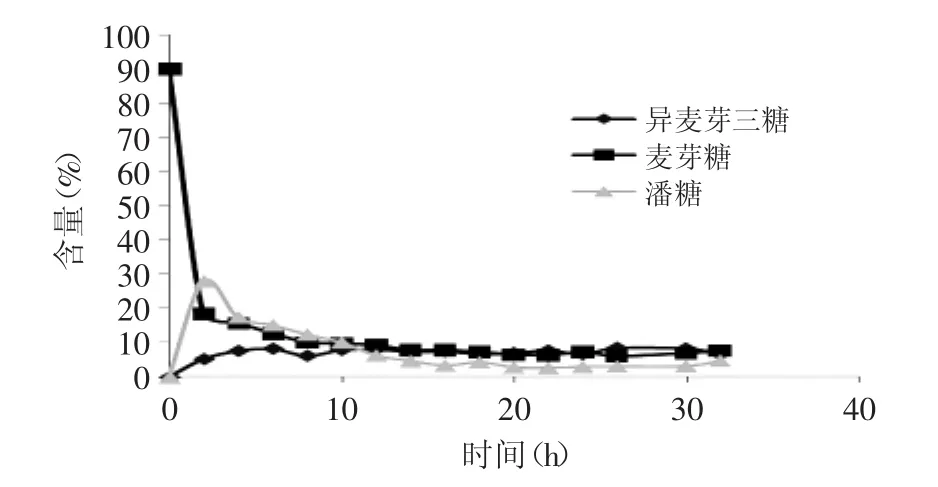
图8 转苷过程中二糖和三糖含量变化Fig.8 Content of disaccharide and trisaccharide in the transferring process
实验数据显示:转苷过程中潘糖的含量在转苷开始时迅速升至很高,比例达到27.91%,随着转苷不断进行,比例逐步减少,16h后比例趋向平衡。转苷开始时异麦芽三糖的比例急剧增加,8h之后比例变化不规则,大致趋向平衡。
上述结果表明,α-转移葡萄糖苷酶的酶促反应并不是一个选择性很高的专属反应[12]。麦芽糖转苷过程水解出的葡萄糖在α-转移葡萄糖苷酶的促进下也可以与麦芽糖自身发生作用,通过α-1,6糖苷键生成潘糖和异麦芽三糖。其过程如图9、图10所示。
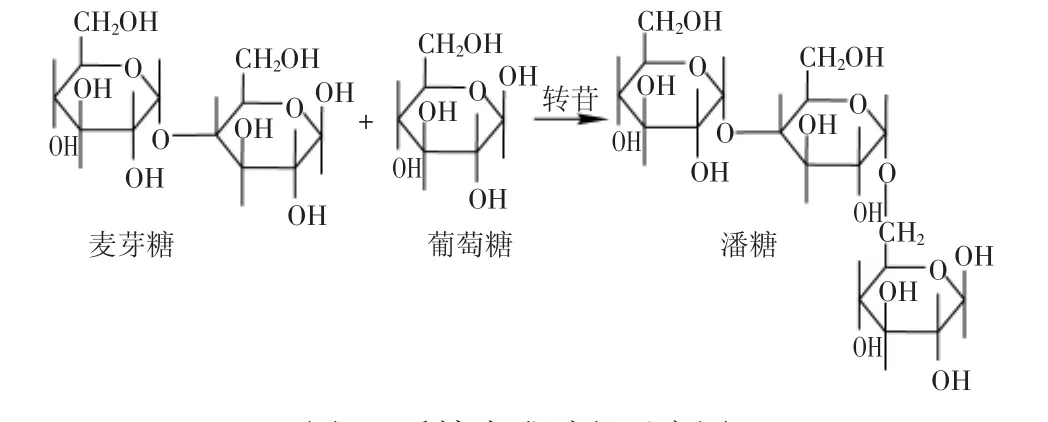
图9 潘糖生成过程示意图Fig.9 The generation of panose
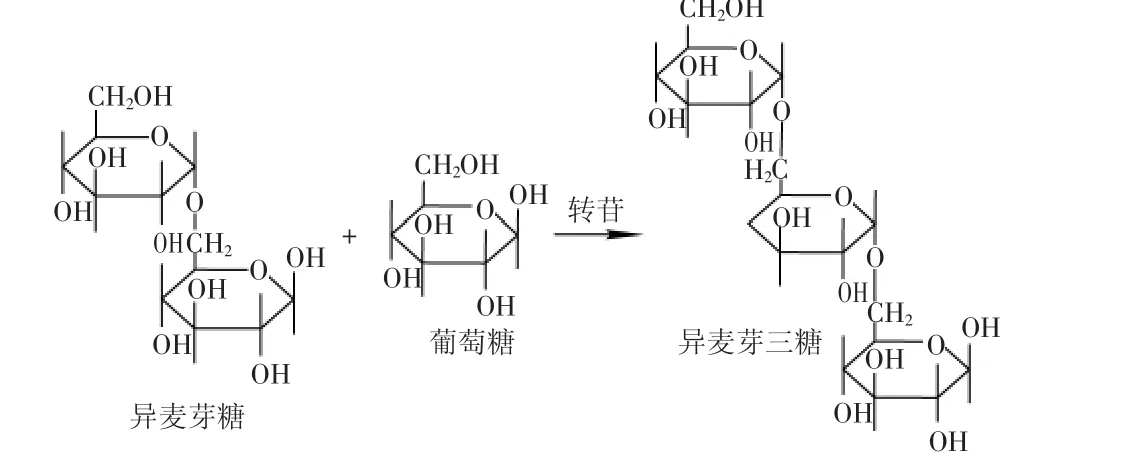
图10 异麦芽三糖生成过程示意图Fig.10 The generation of isomaltotriose
麦芽糖与葡萄糖结合形成三糖的过程是分子内反应还是分子间反应,其机理由下文实验结果推断。
2.4 葡萄糖与麦芽糖混合物转苷结果分析
按葡萄糖质量分数分别为5%、10%、15%、20%、25%、30%的比例与麦芽糖混合作为起始物,反应28h,同等条件下与纯麦芽糖做起始物对比,观察在α-转移葡萄糖苷酶的酶促反应作用下生成双糖、三糖的情况。实验结果如表3所示。
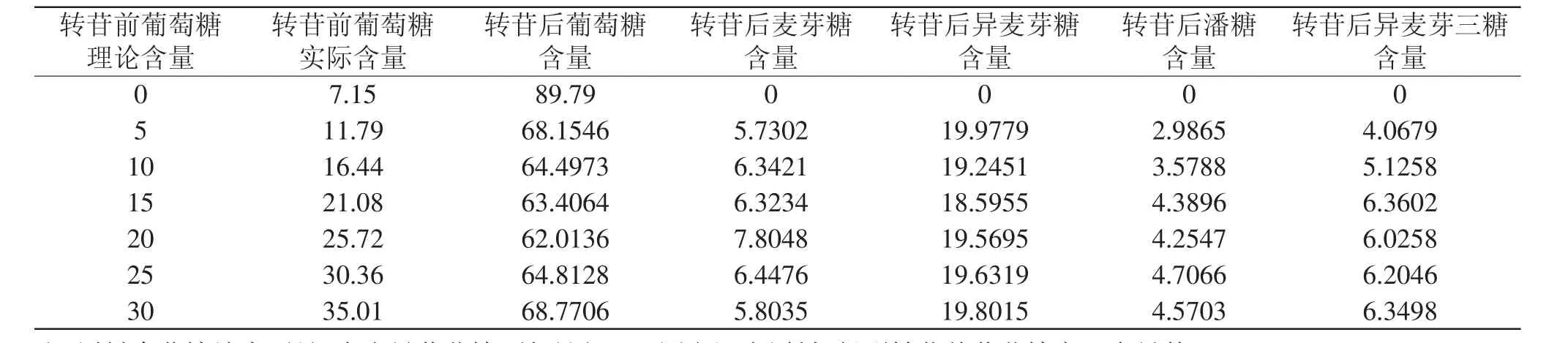
表3 葡萄糖与麦芽糖混合转苷实验结果(%)Table 3 Results of maltose glucose-transferred with glucose(%)
实验数据表明:尽管作为起始原料的混合糖中葡萄糖的含量大幅度发生变化,但是转苷后产物中麦芽糖、异麦芽糖的比例并没有明显变化,印证了上文“转苷过程应该是在分子内发生的,遵从分子内反应机理”的推论。同时,转苷后产物中潘糖、异麦芽三糖的含量差别很小,这点在加入葡萄糖多时表现得尤为明显,说明外加葡萄糖并不能提高转苷效率,而与二糖结合产生三糖的单糖也是转苷过程中产生的特殊状态的单糖。
3 结论
α-转移葡萄糖苷酶作用于麦芽糖的转苷过程是在分子内发生的,遵从分子内反应机理。在α-转移葡萄糖苷酶的酶促反应作用下,麦芽糖分子中α-1,4糖苷键发生断裂,再重组为α-1,6糖苷键连接的异麦芽糖分子,这个过程中产生的葡萄糖不是一种处于游离状态的中间体,而是某种过渡态。
[1]LEVETTAN C.Oral antidiabetic agents in type 2 diabetes[J]. CurrMed Res Opin,2007,23(4):945-952.
[2]Tanriseven A,Dogan S.Production of isomalto-oligosaccharides using dex-transucrase immobilized in alginate fibers[J].Process Biochemistry,2002,37:1111-1154.
[3]康文艺,张丽,张倩.黄连提取物对α-葡萄糖苷酶抑制作用研究[J].天然产物研究与开发,2009,21(6):992-994.
[4]祝宇铭,丁红,王竹,等.表没食子儿茶素没食子酸酯体外α-葡萄糖苷酶活性的影响[J].卫生研究,2009,39(2):168-171.
[5]康文艺,宋艳丽,崔维恒.槐花α-葡萄糖苷酶抑制活性研究[J].精细化工,2009,26(1):1077-1092.
[6]康文艺,张旭,刘瑜新.何首乌对α-葡萄糖苷酶的抑制活性[J].精细化工,2009,26(10):965-967.
[7]康文艺,张丽,宋艳丽.滇丁香中抑制α-葡萄糖苷酶活性成分研究[J].中国中药杂志,2009,34(4):406-409.
[8]张倩,常星,康文艺.芭蕉的α-葡萄糖苷酶抑制活性[J].食品工业科技,2010,31(2):125-130.
[9]毕金峰,魏宝东,李长彪.黑曲霉产α-转移葡萄糖苷酶固态发酵条件优化[J].食品与生物技术学报,2005,24(2):65-68.
[10]周敏,王正祥.黑曲霉CICIM F0410中α-葡萄糖苷酶的酶学性质研究[J].生物技术通报,2009(1):130-133.
[11]毕金峰,刘长江.高纯度低聚异麦芽糖的研究进展和应用前景[J].粮食与饲料工业,2002(3):35-37.
[12]王良东.制备淀粉糖常用酶[J].粮食与油脂,2008(8):4-7.
Exploration into the enzymatic mechanism of α-transglucosidase
HUANG Jin-lian,HUANG Xiu-juan,ZHONG Zhen-sheng*
(School of Chemistry and Chemical Technology,South China University of Technology,Guangzhou 510640,China)
Using High Performance Liquid Chromatography(HPLC)to track the transfer-glycoside process all the way.The enzymatic mechanism of α-glucosidase transferring maltose into isomaltose has been discussed. The results showed that in the transformation process,the α-glucosidase cut the α-1,4 glycosidic bonds into two glucose units firstly,then re-bonded by α-1,6 glycosidic linkage.And the isomerization process from maltose to isomaltose finished.The transglycosidation was happened intramolecularly.At the same time,the glucose units which dissociated from maltose reacted intermolecularly with maltose or isomaltose to generate panose or isomaltotriose.
α-transglucosidase;isomaltose;catalysis;mechanism;transglycosidation
TS201.2+5
A
1002-0306(2012)07-0108-04
2011-05-12 *通讯联系人
黄金莲(1988-),女,硕士研究生,研究方向:食品化学。
