海带中昆布素的荧光定量检测及提取工艺优化
2012-10-23崔志松郭秀春
郑 立, 韩 平, 刘 涛, 崔志松, 郭秀春, 罗 丹, 高 伟
(1. 国家海洋局 第一海洋研究所, 山东 青岛 266061; 2. 中国海洋大学, 山东 青岛 266003)
海带中昆布素的荧光定量检测及提取工艺优化
郑 立1, 韩 平1, 刘 涛2, 崔志松1, 郭秀春1, 罗 丹2, 高 伟1
(1. 国家海洋局 第一海洋研究所, 山东 青岛 266061; 2. 中国海洋大学, 山东 青岛 266003)
针对昆布素检测技术的难点, 利用昆布素与苯胺蓝能特异性结合的特点, 采用荧光分光光度计建立了昆布素含量的荧光快速检测方法。实验结果表明: NaOH浓度对昆布素立体结构影响较大, 在昆布素解旋过程中加入70 μL 3 mol/L的 NaOH 能使昆布素-苯胺蓝荧光复合物具有最大的荧光信号; 通过三维荧光扫描, 确定昆布素-苯胺蓝荧光复合物的最佳激发和发射波长分别为398 nm和502 nm, 在此条件下昆布素-苯胺蓝荧光复合物浓度与其荧光值正相关(R2=0.999 4); 方法学分析表明: 该测定方法具有较高的精密度(RSD为2.52%)和稳定性(RSD为2.09%), 检测范围为20~80 mg/L。基于所建立的昆布素含量快速检测方法, 本文设计了有关提取温度、提取时间、pH以及乙醇浓度四个因素三个水平的正交试验对海带中昆布素的提取条件作了初步优化, 结果表明: 海带中昆布素的最佳提取条件是:置于稀盐酸(pH为1)溶液中于25℃下提取4 h, 90%乙醇沉淀。
昆布素; 苯胺蓝; 荧光; 定量测定; 提取工艺
昆布素(laminarin)又称海带淀粉、褐藻淀粉, 其基本结构单位为 β-1,3-葡萄糖苷(图 1), 是一种低分子质量葡聚糖, 广泛存在于褐藻门、海带科、昆布属等植物体中的。
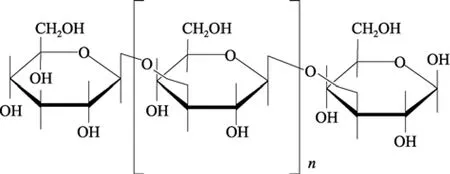
图1 昆布素基本结构单位图Fig. 1 The structure of laminarin unit
有报道称昆布素具有抗肿瘤、抗氧化、保护肝脏、降低血压等多种生物活性, 还可以作为免疫增强剂, 预防放疗所致造血组织损伤, 刺激造血恢复及增强癌症患者的免疫功能[1-4], 所以不少学者开展了昆布素提取制备的研究, 以加深对其应用机理的认识, 但目前昆布素仍没有进行应用, 其中最主要的原因之一是对于昆布素含量的测定还没有简单易行的方法。尽管利用光谱技术可以对单糖和多糖进行含量检测[5], 但如何专门针对昆布素进行特异性检测还鲜有报道, 大多数的方法是在提取昆布素后,水解多糖, 测定葡萄糖的含量来推算昆布素的含量。例如, Cameron等[6]就是测定样品经酵母处理前后的还原力差值, 以计算葡萄糖含量来计算昆布素 , 该方法处理时间长, 且步骤繁琐, 不能得到广泛应用;Miyanishi 等[7]则利用固定化葡萄糖氧化酶及β-1,3-葡萄糖苷酶的装置酶解昆布素, 通过电流法测定葡萄糖含量来推算昆布素含量, 该方法虽然快速、操作简单, 但受所须仪器的限制, 所以不适合在实验室广泛使用。
如何建立快速, 简便、准确的昆布素含量的检测方法, 是其提取制备的前提, 也为它的应用提供基础依据。苯胺蓝是一种荧光染料, 能与β-1,3-葡聚糖特异性结合生成荧光复合物, 荧光强度与β-1,3-葡聚糖正相关[8], 由于昆布素的基本结构单位为 β-1,3-葡萄糖苷, 所以笔者认为昆布素可被苯胺蓝标记, 但在检测过程中的最佳条件还需要进一步探讨。本文即针对上述问题, 开展了基于荧光染色原理的昆布素快速定量测定方法的研究, 并对海带昆布素的酸提醇沉提取工艺进行了研究, 针对提取温度、pH、提取时间以及乙醇浓度四个影响昆布素提取效率的主要因素[9-11], 设计正交试验, 采用荧光染色方法定量测定提取到的昆布素, 对昆布素提取条件也进行了初步优化。
1 材料与方法
1.1 材料与试剂
盐酸(1 mol/L); 氨基乙酸 (0.2 mol/L); 苯胺蓝(1 mg/L); 氢氧化钠 (0.2 mol/L、3 mol/L); 以上药品均为分析纯, 以上溶液均用超纯水配制; 昆布素标准品(提取于Laminaria digitata, Sigma), 1 000 mg/L;日本真海带(Laminaria japonica)。
1.2 实验仪器
FW100型高速万能粉碎机; SHB-Ⅲ循环水式多用真空泵; DHG-9075A型电热恒温鼓风干燥箱;EYELA 数显水浴锅 SB-1000; EYELA 旋转蒸发仪N-1000; TGL-16G台式离心机; Hitachi FL-4500荧光分光光度计。
1.3 实验方法
1.3.1 实验试剂制备
氨基乙酸/氢氧化钠缓冲液的制备(pH 9.5): 取250 mL 0.2 mol/L的氨基乙酸溶液和 100 mL 0.2 mol/L NaOH溶液加水定容至1 000 mL。苯胺蓝混合染料制备: 取400 mL 1 μg/mL苯胺蓝溶液和200 mL 1 mol/L的盐酸混合, 然后加入600 mL pH 9.5的氨基乙酸/氢氧化钠缓冲液。
1.3.2 最佳荧光测定及染色条件的确定
自然状态下, 昆布素(1,3-β-葡聚糖)结构为三股螺旋, 而在碱性条件下, 其结构会发生由三股螺旋向单股螺旋的转变(解旋过程), 单股螺旋是与苯胺蓝结合的最佳形式[12-14]。取体积为 65 μL 3 mol/L NaOH, 加水至 100 μL, 与 500 μL 昆布素(1000 μg/mL)溶液混合, 80℃下水浴30 min(解旋反应), 水浴完毕后加入1 000 μL苯胺蓝混合染料, 50℃水浴30 min 进行染色反应, 之后将其置于常温下使未结合的苯胺蓝染料褪色。反应完毕后在激发波波长300~450 nm, 发射波波长300~600 nm范围内对其进行三维荧光扫描, 根据三维荧光光谱, 确定最佳激发和发射波长。本文所有荧光检测均以超纯水作空白对照, 并均设有三个平行样。
在昆布素解旋过程中, 分别加入不同体积的NaOH(3 mol/L)溶液, 以上述确定的最佳激发和发射波长对昆布素-苯胺蓝荧光复合物进行二维扫描, 确定昆布素的最佳解旋条件。加入的 NaOH体积分别为 55、60、66、70、75、80、85、90 μL。
1.3.3 标准曲线的绘制及方法学考察
配制系列浓度为 10、20、30、40、50、60、70、80、90、100 mg/L的昆布素标准品溶液, 按照1.3.2确定的最佳激发发射波长及荧光染色条件, 通过二维扫描建立昆布素浓度与其荧光信号的线性关系方程并确定线性范围。将标准溶液稀释至低浓度进行荧光测定, 测其峰高响应值及极限噪音强度, 以三倍信噪比计算昆布素的检出限。将昆布素标准品溶液荧光染色后重复测定6次, 计算RSD (相对标准偏差), 并在其荧光染色后0、8、16、24 h分别进行测定, 计算其RSD, 考察稳定性。
1.3.4 昆布素的提取
将海带样品50℃过夜烘干后粉碎成末, 称取10 g干海带粉末, 置于含200 mL盐酸溶液三角瓶中提取, 间歇搅拌。对温度、提取时间、pH及乙醇浓度4个因素进行3个不同水平的正交试验分析。表1为本实验设计的正交试验因素水平表。
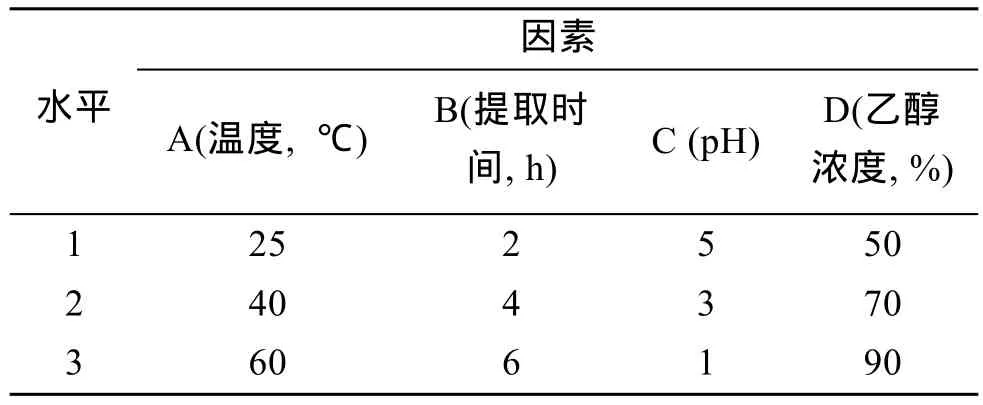
表1 昆布素提取正交试验因素水平表Tab. 1 The factors and levels of the orthogonal experiment
提取完毕后, 用sevag法除蛋白[15]。提取液离心(5 000 r/min, 20 min), 取上清液, 分别用50%、70%、90%乙醇进行沉淀, 离心后收集沉淀, 60℃烘干, 即为粗多糖。将粗多糖配成浓度为100 mg/L的溶液待用。
1.3.5 不同提取条件海带粗多糖中昆布素含量的测定
将1.3.4中不同提取条件得到的海带粗多糖水溶液, 按照 1.3.2确定的条件进行荧光测定, 得到的荧光值代入1.3.3建立的昆布素浓度与荧光信号的线性关系方程, 计算出昆布素含量, 从而确定最优化的昆布素提取条件。
2 结果与分析
2.1 最佳测定波长及最佳染色条件的确立
本实验对昆布素-苯胺蓝荧光复合物进行三维荧光扫描, 图2为其三维荧光谱图, 可以看出在激发波波长300~450 nm, 发射波波长300~600 nm范围内有一强峰, 其对应值即最佳激发和发射波长, 分别为398 nm和502 nm。为了确定苯胺蓝对昆布素染色反应最佳条件, 在昆布素解旋过程中分别加入不同体积的NaOH(3 mol/L)溶液, 在激发波波长398 nm、发射波波长502 nm条件下测定荧光信号, 其相关结果见图3。

图2 昆布素标准品与苯胺蓝复合物三维荧光图(65 μL 3mol/L NaOH)Fig. 2 3D fluorescent spectroscopy of laminarin and aniline blue fluorescent complex

图3 昆布素解旋过程加入NaOH(3 mol/L)体积对二维荧光信号强度的影响Fig. 3 The influence of NaOH on the fluorescence of laminarin-aniline blue complex in the process of laminarin derotation
从图3可以看出加入70 μL NaOH(3 mol/L)后得到的荧光信号最强, 达到了9 744。 而加入过多或过少的 NaOH都会使荧光信号迅速减弱, 由此可以推断合适的碱性条件对昆布素-苯胺蓝复合物的信号测定起到非常重要的作用, 即在此碱性条件下, 昆布素的三股螺旋转变为单股螺旋, 最大限度地与苯胺蓝染料结合生成荧光复合物。
2.2 方法学考察
配制系列浓度的昆布素标准品溶液, 以上述确定的最佳荧光染色条件(加入70 μL 3 mol/L NaOH进行解旋)与苯胺蓝反应生成荧光复合物, 在激发波波长 398 nm, 发射波波长 502 nm下检测荧光信号强度。昆布素浓度与荧光信号呈线性相关, 其线性关系见图4。
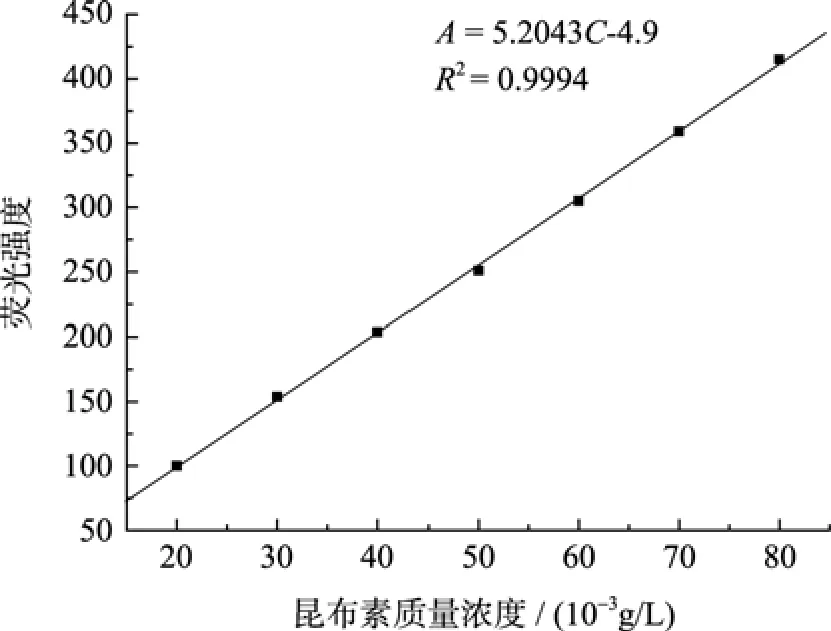
图4 昆布素浓度与荧光强度线性关系(EX398/EM502)Fig. 4 The linear correlation between concentration and fluorescence of laminarin
在浓度20~80 mg/L范围内, 昆布素浓度与荧光强度线性关系良好,R2达到了 0.999 4, 其回归方程为A=5.2034C-4.9(式1), 式中C为昆布素的浓度,A为昆布素苯胺蓝荧光复合物信号强度(EX398/EM502)。将标准品溶液稀释至低浓度, 测得其检出限为0.75 mg/L。根据重复测定6次测定的结果, 计算RSD为2.52%, 说明该方法重复性良好。根据样品染色后 0、8、16、24 h分别进行测定的结果,计算出其相对标准偏差 RSD为 2.09%, 说明昆布素的苯胺蓝荧光复合物在24 h内化学性质稳定。
2.3 海带中昆布素提取条件的优化
将海带多糖粗样品通过所建立的昆布素含量测定方法, 计算得到不同提取条件下昆布素的含量(表 2)。

表2 昆布素提取正交试验与结果Tab. 2 Orthogonal experiment program and results of laminarin extraction
在设计四因素三水平正交试验中, 9组实验结果显示10 g干海带中昆布素的提取量在15.3 mg到67.5 mg之间; 根据极差分析, pH对昆布素提取效率影响最大; 昆布素提取的最佳提取条件是: 稀盐酸(pH为1)溶液于25℃下提取4 h, 提取液用90%的乙醇进行沉淀, 在此条件下, 进行了 10 g干海带昆布素的提取, 含量达到70.1 mg。
3 讨论
昆布素为低分子量β-1,3-葡聚糖, 本身无紫外可见光吸收及荧光特性, 目前对昆布素含量的检测多采用衍生化手段, β-1,3-葡聚糖特有的 3股螺旋的立体结构使其能与刚果红[14]、苯胺蓝[8]、荧光增白剂[16]等衍生试剂特异性结合。昆布素与刚果红结合形成的复合物在550 nm处有吸收, 可用于昆布素的含量检测, 但是该方法操作复杂, 检出限极低, 不适用于常规实验室的检测; 而使用荧光增白剂时, 由于本底值过高, 与昆布素结合后的荧光值较大且容易溢出, 超出检测限, 使得测定结果不准确。Ko 等[8]曾利用衍生试剂苯胺蓝, 采用荧光方法检测了食物中β-1,3-葡聚糖的分布情况, 但是目前还没有针对海带中昆布素的衍生化定量快速检测方法, 而这也是限制海带昆布素提取制备及其应用的主要瓶颈。
本文对昆布素荧光测定方法进行了研究, 利用苯胺蓝染料与昆布素特异性结合原理, 验证了 Ko方法[8]中的荧光复合物的最佳激发和发射波长(EX398/EM502), 并在此基础上优化染色条件, 确定了染色过程中最佳的 NaOH浓度, 建立了针对海带中昆布素含量的荧光测定方法, 方法学考察表明其具有较高的精密度(RSD=2.52%)和稳定性(RSD=2.09%), 与 Cameron[6]法以及 Miyanishi[7]法相比, 更简便和快速, 更适用于实验室应用, 是昆布素含量有效的检测手段, 可以促进昆布素功能的研究开发,具有良好的应用前景。
分析发现海带中多糖的主要成分为褐藻胶(algin)、褐藻糖胶(fucoidan) 和昆布素(laminarin) 3种, 海带粗多糖可采用热水、稀酸、弱碱、酶等方法进行提取[9,10,17], 可根据所需要的特定多糖组分进行选择。由于algin和fucoidan在海带多糖中的含量较高, 所以上述提取方法获得的海带多糖主要是这两种多糖; 而昆布素在海带中的含量少(约占海带干重的0.5%~1%)[18]、分子质量小(<104D)[19-20], 不容易提纯, 所以专门针对昆布素的提取研究还少有报道,一般采用弱酸进行提取[18,21]。本文通过正交试验初步优化了海带中昆布素的弱酸提取工艺, 结果显示低pH及高乙醇浓度时昆布素的提取率最高, 认为较低的pH有利于多糖的提取; 高浓度乙醇有利于低分子量多糖的沉淀, 但提取时间不宜过长, 长时间提取可能导致多糖的降解, 分子质量变小, 不利于乙醇对昆布素的沉淀。
[1] Bohn J A, BeMiller J N. (1,3)- β-D-glucan as biological response modifiers: a review of structure-functional activity relationship [J]. Carbohydr Polym, 1995, 28(1):3-14.
[2] Wakshull E, Brunke-Reese D, Lindermuth J, et al.PGG-glucan, a soluble β-(1,3)-glucan, enhances the oxidative burst response, microbicidal activity, and activates an NFkB-like factor in human PMN: evidence for a glycosphingolipid β-(1,3)-glucan receptor [J].Immunopharmacology, 1999, 41(2): 89-107.
[3] 许凤清, 吴皓. 海带多糖的研究进展[J]. 中国中医药信息杂志, 2005, 12(6): 107-109.
[4] Kim K H, Kim Y W, Kim H B, et al. Anti-apoptotic activity of laminarin polysaccharides and their enzymatically hydrolyzed oligosaccharides from Laminaria japonica [J]. Biotechnol Lett, 2006, 28(6): 439-446.
[5] Myklestad S M, Skanoy E, Hestmann S. A sensitive and rapid method for analysis of dissolved mono-and polysaccharides in seawater [J]. Marine Chem, 1997,56(3-4): 279-286.
[6] Cameron M C, Ross A G, Percival E G V. Methods for the routine estimation of mannitol, alginic acid and combined fucose in seaweeds [J]. J Soc Chem Ind,1948, 67(4): 161-164.
[7] Miyanishi N, Inaba Y, Okuma H, et al. Amperometric determination of laminarin using immobilized beta-1,3-glucanase [J]. Biosens Bioelectron, 2004,19(6): 557-562.
[8] Ko Y T, Lin Y L. 1,3-β-Glucan quantification by a fluorescence microassay and analysis of its distribution in foods [J]. J Agric Food Chem, 2004, 52(11):3313-3318.
[9] 陈彦, 谢继锋, 金先菊, 等. 海藻多糖的分离纯化和组成分析 [J]. 安徽农业科学, 2003, 31(5): 710-717.
[10] 杜斌, 韩华云, 张秋荣. 昆布多糖的提取分离及 F1的纯化与鉴定 [J]. 中国药学杂志, 2002, 37(9):657-659.
[11] 郭亚贞, 慥王, 曲鹏鹏. 香菇多糖的纯化和结构分析[J]. 上海水产大学学报, 2000, 9(3): 276-279.
[12] Arnosti C. A new method for measuring polysaccharide hydrolysis rates in marine environments [J]. Organic Geochemistry, 1996, 25(1-2): 105-115.
[13] Arnosti C. Fluorescent derivatization of polysaccharides and carbohydrate-containing biopolymers for measurement of enzyme activities in complex media [J].Journal of Chromatography B, 2003, 793(1): 181-191.
[14] Mao C F, Hu M C, Wang W H. Physicochemical characterization of grifolan: Thixotropic properties and complex formation with Congo Red [J]. Carbohydrate Polymers, 2007, 68(3): 502-510.
[15] 夏泉, 刘钢, 葛朝亮, 等. Sevag法去除黄芪粗多糖中蛋白质成分的研究 [J]. 安徽医药, 2007, 11(12):1069-1071.
[16] Nishikawa S, Zinkl G M, Swanson R J, et al. Callose(β-1,3 glucan) is essential for Arabidopsis pollen wall patterning, but not tube growth [J]. BMC Plant Biol,2005, 5: 22-28.
[17] 林英, 曹松屹, 曹冬煦, 等. 海带多糖提取方法研究进展[J]. 水产科技情报, 2008, 35(4): 168-170.
[18] Zvyagintseva T N, Shevchenko N M, Popivnich I B, et al. A new procedure for the separation of water-soluble polysaccharides from brown seaweeds [J].Carbohydrate Research, 1999, 322 (1-2): 32-39.
[19] 韩平, 郑立, 刘涛, 等. 高效液相色谱柱后衍生法在线测定海带淀粉的相对分子质量 [J]. 分析测试学报,2009, 28(9): 1066-1068.
[20] Rioux L E, Turgeon S L, Beaulieu M. Effect of season on the composition of bioactive polysaccharides from the brown seaweed Saccharina longicruris [J].Phytochemistry, 2010, 71(13): 1586-1595.
[21] 纪明侯. 海藻化学 [M]. 北京: 科学出版社, 1997:308-309.
Fluorescence quantitative detection and extraction process optimization of laminarin from kelp
ZHENG Li1, HAN Ping1, LIU Tao2, CUI Zhi-song1, GUO Xiu-chun1, LUO Dan2,
GAO wei1
(1. The First Institute of Oceanography, State Oceanic Administration, Qingdao 266061, China; 2. Ocean University of China, Qingdao 266003, China)
Mar.,10,2011
Laminarin; Aniline blue; Fluorescence; Quantification; Extraction technique
Laminarin is a series of bioactive low-molecular weight glucan. Aiming at resolving the difficulty of laminarin quantification in kelp, a rapid analytical method based on aniline blue staining was established. Aniline blue could combine specifically to laminarin and form a fluorescent complex which could be detected by fluorospectrophotometer. The results show that the concentration of NaOH significantly influenced the three dimensional structure of laminarin. The fluorescence intensity of laminarin-aniline blue complex reached the maximum when 70 μL of 3 mol/L NaOH was added during the process of laminarin despiralization. The optimal excitation and emission wavelengths of the fluorescent complex were 398 nm and 502 nm respectively. A linear correlation between the concentration of the complex range from 20~80 mg/L and the fluorescent intensity was obtained(R2=0.9994). The methodological study indicated that the repeatability and stability of this analytical method were 2.52% and 2.09% respectively. Using above laminarin quantitative method, we also studied the optimal extraction technique of laminarin through orthogonal experiment. The results show that the optimal condition is to keep kelp powder in hydrochloric acid (pH=1) solution for 4 hours at 25°C and precipitate laminarin with 90% ethanol.
Q539
A
1000-3096(2012)05-0075-06
2011-03-10;
2011-04-18
海洋公益性行业专项项目(200805039); 国家自然科学基金资助项目(41076108, 40806053)
郑立(1976-), 男, 湖北武汉人, 副研究员, 从事海洋活性物质研究, 电话: 0532-88961802; E-mail: zhengli@fio.org.cn
(本文编辑:康亦兼)
