利用特征色素研究长江口海域浮游植物对营养盐加富的响应
2012-10-23赖俊翔俞志明宋秀贤韩笑天曹西华袁涌铨
赖俊翔, 俞志明, 宋秀贤, 韩笑天, 曹西华, 袁涌铨
(1. 中国科学院 海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071; 2. 中国科学院 研究生院,北京 100049)
利用特征色素研究长江口海域浮游植物对营养盐加富的响应
赖俊翔1,2, 俞志明1, 宋秀贤1, 韩笑天1, 曹西华1, 袁涌铨1
(1. 中国科学院 海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071; 2. 中国科学院 研究生院,北京 100049)
于2009年5月和11月, 在长江口邻近海域通过现场营养盐加富实验, 研究了浮游植物对营养盐添加的响应。应用高效液相色谱技术分析培养样品中的特征色素组成, 通过CHEMTAX软件估算了硅藻、甲藻、隐藻、定鞭藻、金藻、绿藻、青绿藻和蓝藻 8个浮游植物类群对叶绿素 a生物量的贡献(μg/L)。加富实验结果显示: 不同海区或同一海区不同季节的浮游植物生长对营养盐响应不尽相同, 这与培养实验水样采集时浮游植物所处的 N、P限制状态有着密切的关系。营养盐的加富不仅能够促进浮游植物生物量的增加, 也可能引起浮游植物的群落结构的变化。不同浮游植物类群对营养盐添加的敏感性不同, 培养实验开始后营养盐的输入使得硅藻在竞争中取得了优势, 硅藻所占比重明显上升;但随着培养的进行, 营养盐逐渐消耗, 一些在低营养条件下竞争能力强的浮游植物类群比如甲藻、蓝藻、隐藻等对生物量的贡献逐渐上升; 同时, 培养海水中初始浮游植物群落组成对营养盐加富后群落结构的变化有着重要的影响。
光合色素; 浮游植物; 营养盐加富; 长江口
浮游植物的生长受到多种环境因素的影响比如盐度、温度、光照、营养盐等, 其中营养盐主要是N、P营养元素是控制浮游植物生长最重要的环境因子之一, 它和人类活动有着密切的关系。近年来, 随着长江流域社会、经济的不断发展将大量营养物质从陆地带入长江口海域, 使得长江口及邻近海域营养盐浓度不断升高、营养盐结构发生变化, 长江口海域富营养化程度和范围也在逐年加重和扩大[1]。长江口海域富营养化在导致浮游植物生物量大幅升高、藻华灾害频发的同时, 也改变了水体中浮游植物的群落结构组成[2-3]。浮游植物群落结构的改变, 能够对整个河口的生态和经济产生重要影响, 比如引起有害藻华、水体缺氧、降低透明度、改变水体营养结构以及损害渔业生产等[4]。因此, 研究长江口海域浮游植物生长和群落结构对营养盐变化的响应特点具有重要的意义。
目前, 许多研究者在长江口及邻近海域开展了相关研究, 蒲新明等[5]利用现场加富培养实验的方法对春季长江口海域浮游植物营养盐限制状况进行了研究。赵卫红等[6]通过同样的方法发现, 夏季在长江口冲淡水域磷为浮游植物生长的显著潜在限制因子, 离岸较远的远河口海域氮是潜在限制因子, 中间海域是磷、氮潜在限制过渡区。刘媛等[7]指出营养盐的添加一定程度上改变了浮游植物的粒级结构。李雁宾等[8]通过对东海赤潮高发区现场培养实验样品的显微镜镜检分析发现, 中肋骨条藻、米氏凯伦藻和东海原甲藻等对营养盐需求不同。但由于许多微型浮游植物缺少明显的分类学形态特征, 很难在显微镜下鉴定和计数; 一些种类很脆弱, 无法固定保存或固定后易变形, 也进一步增加了分类难度[9], 因此以往的研究主要关注硅藻、甲藻等少数类群对营养盐变化的响应。随着高效液相色谱色素分析技术的发展, 利用光合色素来分析浮游植物群落组成的方法逐渐发展起来, 成为从宏观上研究浮游藻群落组成和丰度的良好工具[10], 并已应用到东海海域的研究中[11-12]。
本文利用特征色素通过现场培养实验研究了NO3-N和PO4-P加富对长江口浮游植物生长和群落组成的影响, 分析了不同藻类类群对不同营养盐添加水平的响应, 为确定长江口浮游植物对营养盐输入的响应阈值和解释富营养化所导致的群落组成变化提供实验依据。
1 材料与方法
1.1 实验站位
2009年5月和11月, 在长江口及邻近海域使用“科学1号”调查船进行现场培养实验。5月份实验站位为3100-2、3100-4和3150-2, 11月份实验站位为3100-2和3100-4(图1)。各实验站位的营养盐和水文状况见表1。
图1 长江口实验站位Fig. 1 Sampling sites at the Changjiang Estuary and adjacent area
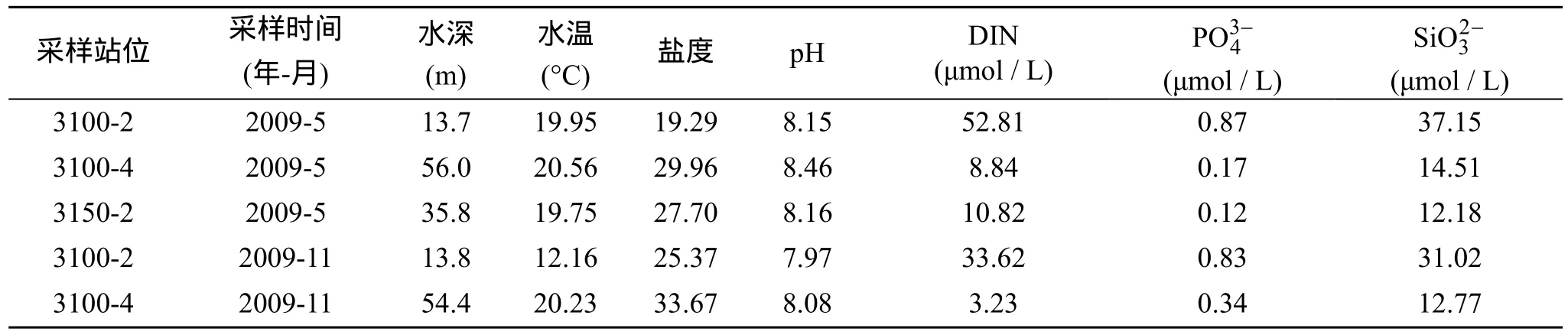
表1 实验站位表层海水中营养盐和水文状况Tab. 1 Nutrient and hydrological factors in surface water at investigation stations
1.2 现场培养方法
于设定站位取表层海水, 经200 μm筛绢滤除大型浮游动物干扰后, 分装到8 L透明培养桶中。根据已有往年数据估计各个测站的营养盐浓度, 将实验站位分成两类: 浑浊区和外海区。由于两个区浮游植物对营养盐增加敏感性不同, 并参照海水水质标准设置了不同的营养盐浓度梯度组, 分别添加硝酸盐和磷酸盐。实验组的设计和培养时间见表2。

表2 现场培养实验中营养盐添加量Tab. 2 Nutrients in the field experiment
在各瓶瓶盖扎了通气孔并外加一层纱布, 扎紧后置培养箱中培养, 通循环海水以维持现场温度条件, 每天摇动培养瓶若干次, 以保持培养介质空气溶解量和防止生物聚集, 在自然光照条件下培养4~6 d, 定期取样(根据不同实验, 取样时间有所差别)。
1.3 样品采集与分析
定期采集水样, 用于营养盐分析的样品, 经47 mm的 GF/F玻璃纤维滤膜过滤后, 加入氯仿-20℃下保存。回到实验室应用SKALAR SANplus营养盐自动分析仪测定。
用于分析色素的样品, 水样在弱真空(<0.03 MPa=过滤到47mm Whatman GF/F玻璃纤维滤膜上,将滤膜折叠用锡纸包裹迅速置于液氮中保存以减少色素转化, 回到实验室进行分析。将冷冻的滤膜解冻,吸取多余水分, 剪成细条, 置于离心管中, 加入 5 mL 100 %甲醇研磨并在冰水浴中超声提取5 min, 然后通过尼龙滤膜针筒滤器(0.22 μm孔径)以除去细胞和滤膜碎屑, 后将1 mL的提取液和200 μL的超纯水混合后, 吸取100 μL注入高效液相色谱(HPLC)测定。HPLC色素分析方法是参照 Zapata等[13]的方法。分析系统为Waters Alliance 2695液相色谱系统。通过二极管阵列检测器 DAD来检测洗出峰。色谱柱为Waters Symmetry C8 柱。流动相 A: 甲醇: 乙腈: 吡啶水溶液=50:25:25(体积比); 流动相 B: 甲醇: 乙腈:丙酮=20:60:20(体积比)。梯度洗脱程序: 流速为1 mL/min, 22 min内流动相B由初始0%上升至40%,到 28 min的时候升到 95%, 并保持 10 min, 然后2 min内返回初始条件。色素的鉴定是通过色素标准、二级阵列检测器获得的光谱图、保留时间以及文献资料比较得出, 色素定量采用内标法。
1.4 利用特征色素分析浮游植物群落组成
由于不同浮游植物类群具有不同色素组成和色素比值, 因此可以利用色素的这种特性来研究和表征浮游植物的群落结构。根据检测的特征色素种类,本文分析了硅藻(Diatoms)、甲藻(Dinoflagellates)、隐藻(Cryptophytes)、定鞭藻(Prymnesiophytes)、金藻(Chrysophytes)、绿藻(Chlorophytes)、青绿藻(Prasinophytes)和蓝藻(Cyanobacteria)8个浮游植物类群。浮游藻类各类群丰度是通过CHEMTAX软件[7]分析得来, 表示为叶绿素a生物量(μg/ L), 相对丰度则通过各类群对总叶绿素 a的贡献比例来表示。CHEMTAX是Mackey等在1996年研制出的一个矩阵因子化程序, 它是从藻类初始特征色素与叶绿素a比值出发, 再根据由 HPLC分析所得的原始色素数据, 通过最速下降算法反复地优化一个包含每一个藻种的色素比率矩阵, 来定量地确定浮游藻类种群组成和丰度。各浮游植物类群的特征色素与叶绿素a初始比值参用 Mackey等[14-15]和 Furuya等[11]所报道的。
2 结果
2.1 现场培养期间理化性质的变化
培养期间培养瓶的水温在不同站位和季节存在差异, 5月份 3个培养站位水温差异不大19.75~20.56°C, 而11月份3100-2站水温要显著低于3100-4站(表 1); 在整个培养期间, 各培养瓶水温的变化小于5°C。受长江冲淡水的影响, 3100-2站盐度要显著低于3100-4和3150-2站, 但在培养期间各培养瓶的盐度无显著变化。
两个航次调查结果显示, 位于长江口邻近海域的3100-2站其本底硝酸盐和活性磷酸盐的浓度均高于离岸较远的3100-4和3150站, 因此, 在3100-2站选择了较高的加富浓度。由图2和图3可见, 在两个航次的培养实验中, 各培养组硝酸盐和活性磷酸盐的浓度都随培养时间的延长呈明显下降趋势, 一些组在实验结束时NO3-N和PO4-P几乎被浮游植物消耗殆尽。
2.2 浮游植物生长对营养盐加富的响应
2.2.1 5月份现场培养实验
2009年5月3100-2站、3100-4和3150-2站的叶绿素a初始浓度分别为2.92、1.90和1.51 μg/L。图4描述的是5月份各站培养实验中叶绿素a生物量对营养盐加富的响应变化趋势。
在 3100-2站, 对照组和各营养加富组在培养的第 2天叶绿素 a浓度与初始时刻相比均出现显著升高, 其中PO4-P加富组叶绿素a的增加更显著为初始浓度的5倍以上要明显高于NO3-N加富组; 而在培养结束时, 各培养组的叶绿素 a生物量也都出现了不同程度的下降, 但营养盐加富组的最终叶绿素 a浓度均高于初始水平。
3100-4站表层海水的溶解无机氮和活性磷酸盐浓度均较低, 限制了浮游植物的生长, 对照组培养介质中叶绿素a浓度在培养开始后有所下降, 在第6天又有所上升; N-10组和N-20组叶绿素a浓度第4天与初始水平相比略有上升, 在实验结束时又下降,但N-10组和N-20组培养结束时叶绿素a浓度均明显高于对照组; 而添加P组叶绿素a的响应较NO3-N加富组更明显, 叶绿素a浓度最高值分别达到3.65、5.59、6.77和6.47 μg/L, 说明磷酸盐的加富显著的促进了浮游植物的生长。

图2 2009年5月现场培养实验中NO3-N和PO4-P浓度的变化Fig. 2 Changes of NO3-N and PO4-P in field culture experiments conducted in May 2009
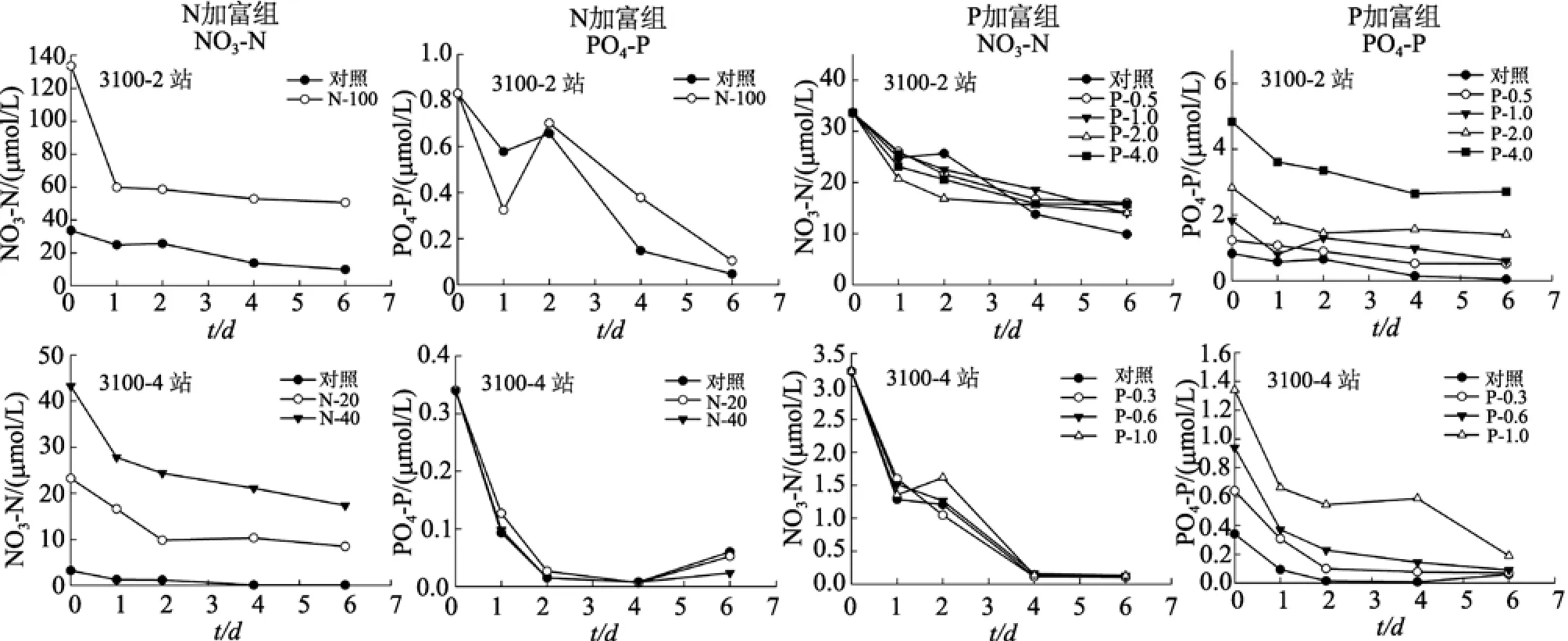
图3 2009年11月现场培养实验中NO3-N和PO4-P浓度的变化Fig. 3 Changes of NO3-N and PO4-P in field culture experiments conducted in November 2009
在 3150-2站, 与对照组相比, NO3-N加富组和PO4-P加富组在第4天均出现了明显的叶绿素a峰值,与其他站实验结果相似的是, PO4-P加富组培养介质中浮游植物生物量响应更明显, 且叶绿素 a浓度随PO4-P添加浓度升高而升高, 但在第4天达到最高值后到实验结束时, NO3-N加富组和PO4-P加富组的培养介质中叶绿素 a浓度均显著下降, 说明在培养开始时, 营养盐的加富显著的促进了浮游植物的生长,导致叶绿素 a浓度升高, 浮游植物的大量繁殖消耗了培养体系中的营养盐, 导致在实验结束时浮游植物开始死亡, 叶绿素a浓度随之下降。
2.2.2 11月份现场培养实验
11月份秋季, 长江口海域冲淡水的影响逐渐减弱, 这个季节的浮游植物生物量较 5月份有所下降,3100-2站和 3100-4站的叶绿素 a初始浓度分别为0.61和1.24 μg/L。图5是11月份各站培养实验中叶绿素a生物量对营养盐加富的响应变化图。
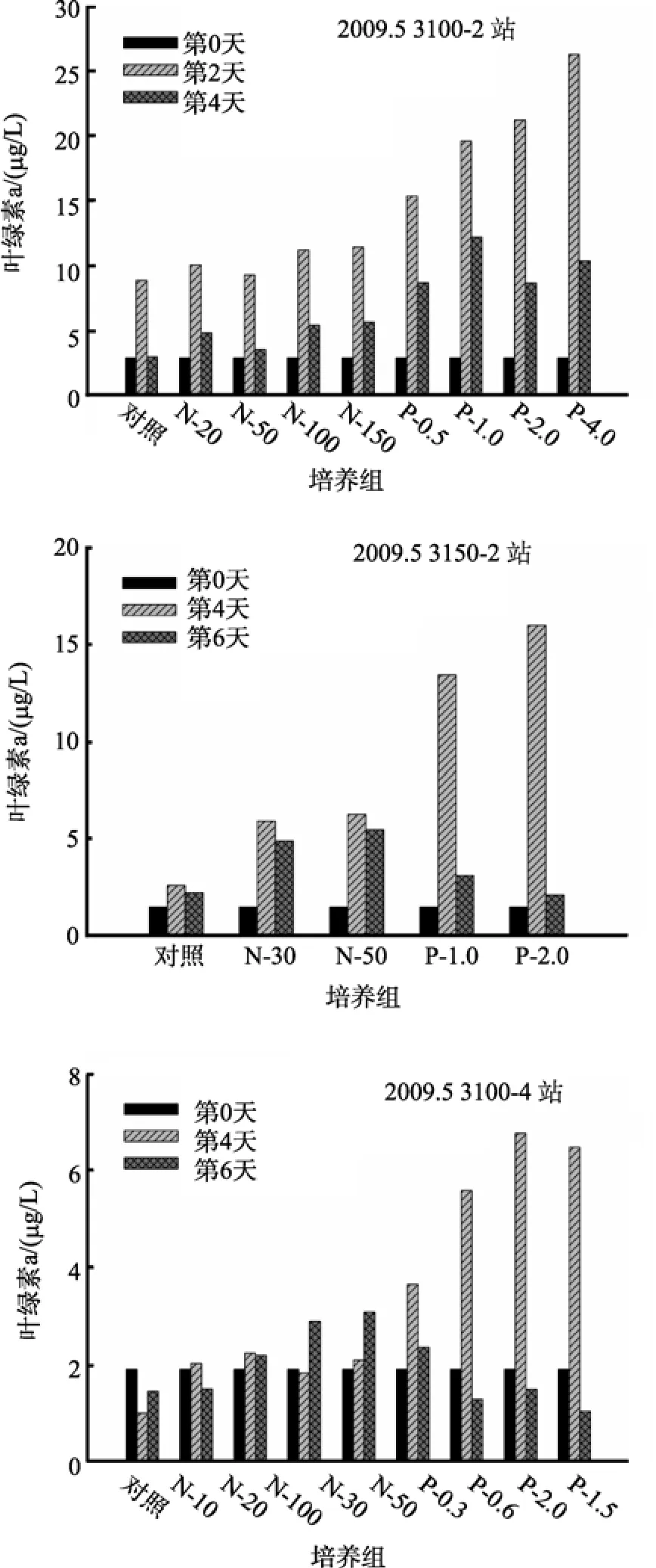
图 4 2009年 5月现场培养实验中叶绿素 a对营养盐加富的响应Fig. 4 Response of chlorophyll a to nutrient additions in field culture experiments conducted in May 2009
3100-2站培养实验结果显示, 各营养盐加富组的叶绿素 a浓度在培养开始后迅速升高, 在实验结束的第6天叶绿素a浓度并未出现下降, 对照组也表现出相同的变化趋势, 这说明在 3100-2站浮游植物的生长不存在显著的营养盐限制, 浮游植物的生长对营养盐的加富有显著的响应; 而 PO4-P加富组叶绿素a的浓度要明显高于 NO3-N加富组, 且培养瓶中叶绿素a浓度随添加PO4-P浓度的升高而升高, 在P-2.0培养组叶绿素a浓度达到12.16 μg/L。
3100-4站培养实验结果显示, 对照组叶绿素 a生物量的波动幅度较小, 实验结束时叶绿素 a浓度与初始水平差不多; 经过4天的培养, 各营养盐加富组培养介质中叶绿素 a的含量与初始水平相比都有了显著增加, 但3个PO4-P加富组之间增加程度的差别不大, 而NO3-N加富组和PO4-P加富组增加的程度有较大差别, NO3-N加富组的叶绿素a浓度更高,因此3100-4站叶绿素a对硝酸盐的加富响应更明显;此外, 各培养瓶在实验结束时, 培养介质中叶绿素 a浓度与第4天相比均有显著下降。
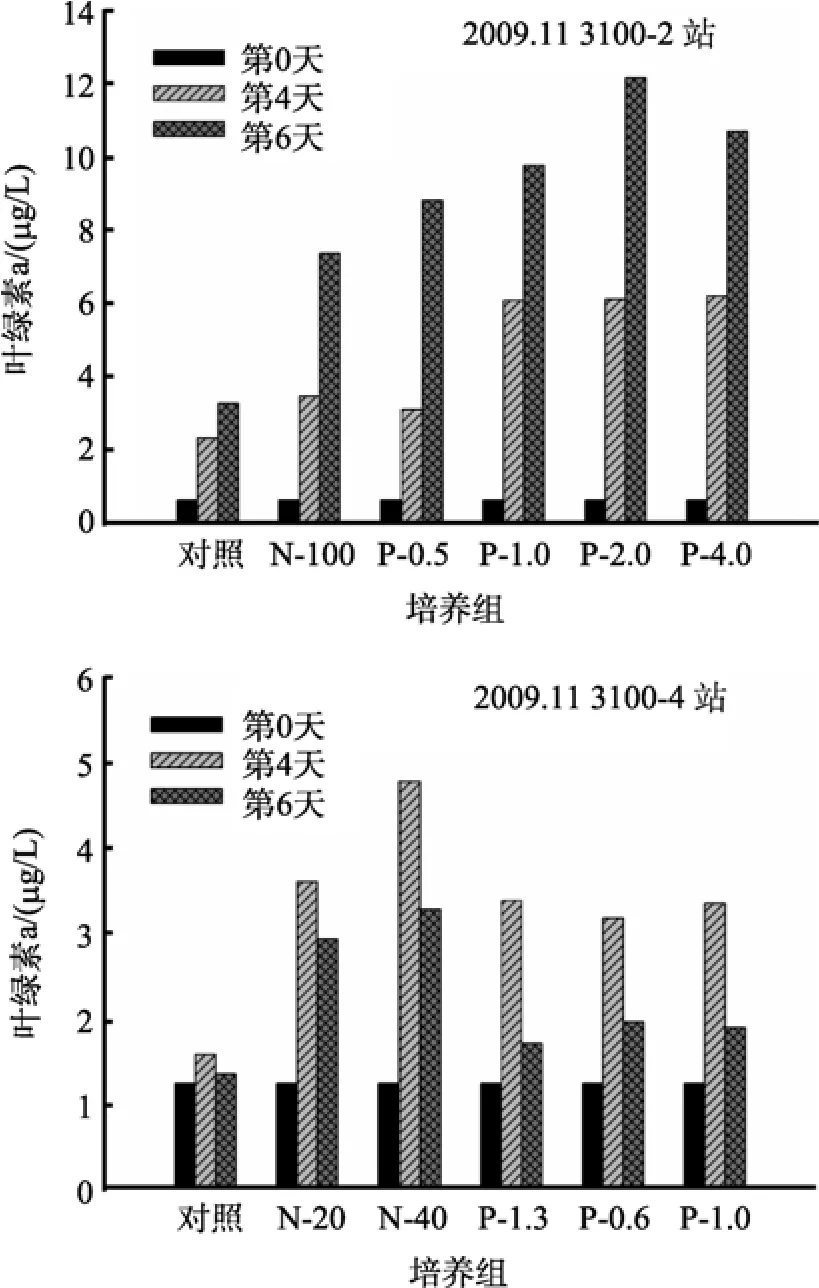
图 5 2009年 11月现场培养实验中叶绿素 a对营养盐加富的响应Fig. 5 Response of chlorophyll a to nutrient additions in field culture experiments conducted in November 2009
2.3 浮游植物群落组成对营养盐加富的响应
调查发现在不同站位采集的海水中, 浮游植物的群落组成存在很大的差异(图 6)。HPLC色素分析结果显示, 5月份3100-2站海水中含量最高的是岩藻黄素, 其次是别黄素(隐藻)和多甲藻素(甲藻), 19’-己酰基氧化岩藻黄素、19’-丁酰基氧化岩藻黄素、玉米黄素、青绿素和叶绿素 b含量均较低; 利用CHEMTAX软件对色素数据分析表明, 初始浮游植物群落组成包括硅藻、甲藻、隐藻、绿藻、蓝藻、定鞭藻、金藻和青绿藻, 它们对叶绿素a的贡献分别为49%、8.05%、36%、2.26%、0.23%、0.2%、0.38%和 3.8%; 3100-4站的生物量(Chl a, μg/L)要低于3100-2站, 初始浮游植物组成为硅藻(25%)、甲藻(3.75%)、隐藻(17.1%)、蓝藻(3.93%)、定鞭藻(37.72%)、金藻(9.4%)和青绿藻(2.73%), 在海水样品色素检测时新黄素和紫黄素含量较低低于检测限,因此培养实验开始时绿藻的比重非常低; 3150-2站硅藻和甲藻是主要优势类群, 两者贡献了 82%的生物量, 其次是隐藻(6.1%)、绿藻(4.8%)、蓝藻(0.96%)、定鞭藻(0.58%)、和青绿藻(3.52%)。11月份 3100-2站主要类群是硅藻、绿藻和隐藻, 分别贡献了60.9%、16.1%和10.4%的生物量, 其他类群所占比重较小, 比重最大的是青绿藻(7.7%); 3100-4站初始浮游植物群落中硅藻占绝对优势, 占总叶绿素 a的比重为 66.7%, 其次是甲藻(6.6%)、隐藻(7.8%)、绿藻(8.2%)和蓝藻(6.7%), 定鞭藻、金藻和青绿藻含量较低。

图6 2009年5月和11月各站位培养实验初始浮游植物群落组成Fig.6 Phytoplankton community composition at the investigation sites on Day 0 of field culture experiments conducted in May and November 2009
2.3.1 5月份现场培养实验
不同站位的培养实验其浮游植物群落组成对营养盐加富表现出不同的响应特征。如图 7所示,3100-2站, 在培养实验第2天对照组和各营养盐加富组硅藻的相对丰度显著上升, 由初始的 49%上升到 80%左右, 显示了其对外来营养盐的竞争优势; 此外, 青绿藻所占比重也略有上升, 甲藻和隐藻所占比重则明显下降, 其他类群对总叶绿素 a生物量的贡献基本无变化仍然占了很小的比重; 然而第 6天实验结束时, 硅藻对总叶绿素 a的贡献有所下降但依然是最主要的类群, 甲藻、隐藻、绿藻和蓝藻的所占比重均有所上升, 其中甲藻比重上升最大, P-0.5组在实验结束时甲藻所占比重达到25.7%。
在 3100-4站, 对照组在培养过程中浮游植物主要类群未发生较大变化, 硅藻和隐藻相对丰度略有下降, 而甲藻和蓝藻的所占比重上升了。同时, 结果显示与PO4-P加富组相比, NO3-N加富组在培养实验结束时硅藻和甲藻对总叶绿素 a的贡献率更高, 而蓝藻和定鞭藻的贡献率要低于 PO4-P加富组; 绿藻虽然在初始时刻所占的比重非常小, 但是随着培养的进行绿藻在各营养盐加富组的比重有了明显上升(图 7)。
3150-2站对照组在培养实验的第4天和第6天浮游植物群落结构变化不大, 硅藻和甲藻仍然是主要优势类群, 两者贡献了 75%以上的生物量, 但蓝藻所占比重明显上升, 由初始的不足 1%上升到 15%;其他营养盐加富组, 在实验开始后到第4天, 硅藻对浮游植物生物量的贡献明显增加占绝对优势地位,但到第 6天硅藻所占比重有所下降; 在培养实验结束时, 浮游植物群落组成对添加NO3-N与PO4-P的响应出现差异, 与第4天结果相比, 在NO3-N加富组甲藻相对丰度上升较明显而在 PO4-P加富组则是蓝藻的相对丰度有了大幅的上升(图7)。
2.3.2 11月份现场培养实验
图 8是 11月航次现场培养实验 3100-2站和3100-4站营养盐加富后各浮游植物类群的相对丰度变化趋势。3100-2站对照组在培养实验的第4天其硅藻、绿藻和蓝藻对总叶绿素a的贡献下降, 硅藻由初始的60.9%下降到45.5%, 同时甲藻、隐藻和青绿藻所占比重上升了, 分别为10.5%、30.8%和11.2%;到第6天硅藻所占的比重进一步下降为30.3%, 甲藻和青绿藻的比重上升为15.1%和18.3%。而第4天各营养盐加富组的硅藻比重均明显上升, 直到培养结束, 硅藻一直保持着优势地位。
3100-4站对照组在培养实验开始后, 硅藻对总叶绿素 a的贡献就开始下降, 一直保持在 35%左右;蓝藻和青绿藻所占比重到实验结束时则上升到21.6%和 15.5%。添加营养盐后经一段时间的培养,营养盐加富组硅藻所占比重也有所下降, 在43%~47%之间, 青绿藻的比重均明显上升。3100-4站浮游植物群落组成对硝酸盐和磷酸盐加富产生不同的响应, 在 NO3-N加富组甲藻对总叶绿素 a的贡献显著升高, 而在PO4-P加富组蓝藻对总叶绿素a的贡献则更大。
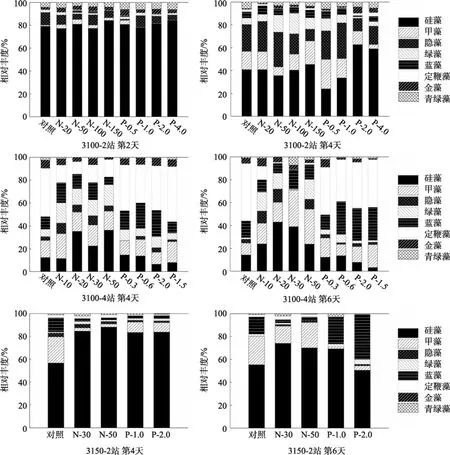
图7 2009年5月现场培养实验中浮游植物群落组成对营养盐加富的响应Fig. 7 Responses of phytoplankton community composition nutrient additions in field culture experiments conducted in May 2009
3 讨论
海水中浮游植物的生长有其最适宜的营养条件,研究表明浮游植物按 Si、N、P营养元素 16:16:1这一恒定的比例从海水中吸收营养元素, 偏离该比值过高或过低, 均可导致浮游植物的生长受到某一相对含量较低的营养元素的限制, 并改变水体中浮游植物的群落组成[16-17]。
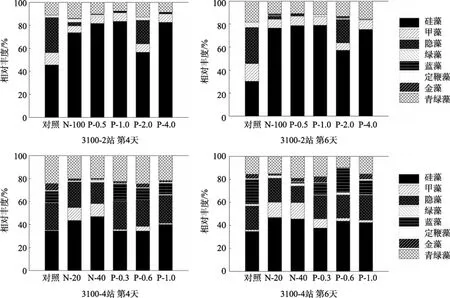
图8 2009年11月现场培养实验中浮游植物群落组成对营养盐加富的响应Fig. 8 Responses of phytoplankton community composition nutrient additions in field culture experiments conducted in November 2009
3100-2站位于长江口近河口区域, 受长江口冲淡水的影响其盐度较低, 5月份其本底DIN和PO4-P分别为52.81和0.87 μmol/L, N/P比高达60, 远高于Redfield比值, 此时浮游植物处于相对磷限制状态,但此时磷并未低于生长阈值(PO4-P=0.1 μmol/L)[18],因此对照组Chl a浓度也有明显上升, 从营养盐加富结果来看, 无论是NO3-N加富组还是PO4-P加富组到第4天都出现了Chl a的峰值, 但绝对量上PO4-P加富组要显著高于 NO3-N加富组, 这也证明了在该站 P是浮游植物生长主要的限制因子; 到了实验结束时Chl a浓度大幅下降, 这是由于此时培养介质中磷酸盐浓度均低于0.1 μmol/L, 限制了浮游植物的生长。11月份3100-2站N/P>30, 处于相对磷限制的状态, 培养实验结果也显示 PO4-P加富组浮游植物生物量的绝对值要高于其他组; 但可能由于此时该站的初始生物量较低而本底营养盐浓度较高到实验结束时除对照组外各培养组的营养盐均未耗尽, 因而并未观察到Chl a浓度下降的过程, 由此可见在营养盐充足的情况下, 营养盐的绝对浓度要比 N/P对浮游植物的生长影响更大。
3100-4站离长江河口距离增加, 受长江冲淡水的影响减小, 环境本底硝酸盐和磷酸盐浓度均显著低于 3100-2站, 磷酸盐浓度更是接近生长阈值; 因此, 由于磷酸盐的限制 NO3-N加富并未引起浮游植物生物量的显著提高, 而 PO4-P加富显著的促进了浮游植物的生长, 但是随着浮游植物大量繁殖, 培养介质中的硝酸盐大量消耗, 无法继续维持浮游植物的生长, 大量浮游植物开始死亡, 说明在 3100-4站N和 P都有可能是潜在的限制因子。从11月份3100-4站培养实验结果来看, N是最主要的限制因子,其次才是 P, 这是因为 11月份该海域受长江冲淡水影响较小, 主要受外海低营养盐水影响, N/P降低。
3150-2站其本底的磷酸盐浓度为 0.12 μmol/L,已经非常接近生长阈值, 因此与 3100-4的加富实验类似, PO4-P加富显著的促进了浮游植物的生长; 但是不同的是NO3-N加富组的Chl a浓度与对照组相比有了显著的提高, 这可能的解释是: 一方面,3150-2站悬浮物含量较高, 一些吸附在其上的 P可能在培养期间释放到培养介质中支持了浮游植物的生长; 另一方面, 培养介质中有机磷可能在细菌或浮游植物酶的作用下转化为无机磷被浮游植物利用[19]。
以上结果表明, 长江口邻近海域的浮游植物生物量能够对营养盐输入做出迅速的响应, Chl a生物量基本上随营养盐初始浓度的增加而增加; 然而,不同站位或同一站位不同季节进行的营养盐加富实验, 其浮游植物生长对营养盐响应不同, 这与该站位培养实验水样采集时的N、P限制状态有着密切的关系, 而长江口海域的N、P限制存在着明显的空间变化和季节性变化[6,20-21]。
营养盐的输入, 能够引起水体中营养盐结构发生变化, 由于不同类群的浮游植物适应新的营养环境的能力不同, 浮游植物群落结构也就在不同类群的浮游植物竞争中发生变化[22]。许多研究[22-25]表明,在营养盐丰富的水体中, 硅藻具有更高的竞争力能够迅速繁殖在浮游植物群落中占据优势地位; 而当营养盐缺乏时, 对营养盐利用能力强的浮游植物类群比如甲藻、蓝藻等会形成优势。从5月份的3100-2和3150-2站以及11月份的3100-4站培养实验结果可以看出, 营养盐的加富使培养海水中浮游植物群落组成发生变化, 当NO3-N和PO4-P加富后, 硅藻所占的比重迅速上升, 但到了实验后期营养大量消耗,这时甲藻、隐藻、蓝藻和青绿藻等类群的比重开始上升。在PO4-P加富组实验后期, 由于P的加入而使N处于相对短缺的状态, 这时在 N限制状态下有更强竞争力的蓝藻贡献明显上升。在NO3-N加富组实验后期则出现磷的相对短缺, 甲藻的比重上升较明显, 这可能是由于许多甲藻能够在营养盐丰富时过量吸收磷, 在营养盐缺乏时加以利用, 从而维持生长[26,27], 这也为解释近年来长江口海域甲藻在群落中的比重呈上升趋势提供一定的依据; 受大量使用氮肥流失的影响, 长江冲淡水输入 DIN含量大幅增加, 而PO4-P浓度偏低, 营养盐的补充引起浮游植物生物量的增加进一步消耗水体中较低的 PO4-P, 在P限制条件下甲藻更具竞争优势, 丰度上升。培养实验结果显示, 浮游植物群落组成还受到培养海水透明度的影响, 3100-2站靠近最大浑浊带, 水体悬沙含量较高, 硅藻、隐藻和绿藻能够适应高浑浊度的类群在群落中所占比重要高于3100-4站。从季节差异来看,5月份3100-2和3100-4站培养实验中, 甲藻和定鞭藻在群落结构中所占的比重要显著高于11月份; 而与5月份相比, 11月份培养实验在添加营养盐之后,青绿藻所占的比例有了显著提高, 这可能是受到 11月份水温较低的影响。
此外, 通过营养盐加富实验发现, 培养海水中初始浮游植物群落组成对营养盐加富实验的结果有着重要的影响。如果初始浮游植物群落是由一种或少数类群占优势地位, 这些类群在营养盐输入时就拥有初始优势, 当营养盐结构的改变正好是这些类群喜好的环境时, 它们很快就能够在与其他类群竞争中占据绝对优势, 其他类群丰度下降, 5月份3100-2和3150-2以及11月份3100-2培养实验就表现出相似的规律; 与此相反, 如 5月份 3100-4站培养实验中其初始浮游植物群落组成有几个类群均占有较大的比重, 群落组成较均衡, 营养盐加富后群落组成结构的变化较缓慢并未出现某一类群迅速增值而形成优势, 但是随着培养时间的延长最适应环境营养状况变化的类群仍然会逐渐占据优势地位。
以往在研究营养盐加富对自然水体中浮游植物种群组成的影响时, 主要是采用显微镜计数的方法,这往往只能提供硅藻、甲藻等少数浮游植物类群的信息, 而定鞭藻和青绿藻等在海洋中具有比较重要的生态功能, 通过传统的光学显微镜镜检很容易被忽略。与以往长江口现场培养实验结果相比, 利用色素分析的方法发现一些粒径较小的浮游植物类群(隐藻、蓝藻、定鞭藻、青绿藻)在群落组成中有着重要的贡献, 这些类群能够对环境营养盐条件的变化产生显著的响应, 进而改变水体中浮游植物群落组成。
4 结论
长江口邻近海域的浮游植物生物量对营养盐输入能够做出迅速的响应, 但不同海区浮游植物生长对营养盐的输入做出不同响应, 即便在同一海区不同季节间也是不尽相同的, 这与培养实验水样采集时浮游植物所处的N、P限制状态有着密切的关系。水体中营养盐供应状况的变化能够引起浮游植物群落结构组成的变化, 培养实验开始后营养盐的输入使得硅藻在竞争中取得了优势, 但随着培养的进行,营养盐逐渐消耗, 一些在低营养条件下竞争能力强的浮游植物类群比如甲藻、蓝藻、隐藻等对生物量的贡献逐渐上升。当 N营养输入, 使培养实验后期水体处于P限制状态时, 甲藻更具竞争力, 在群落中的比重明显上升; 而当P营养的输入, 使培养实验后期水体处于 N限制状态时, 蓝藻则更具竞争力, 在群落中的比重明显上升。培养海水中初始浮游植物群落组成对营养盐加富后群落结构的变化有着重要的影响。
在长江口海域以往现场培养实验研究中, 通常采用显微镜计数和测定叶绿素 a的方法来分析浮游植物, 显微镜计数或多或少都会对一些粒径较小的类群有所低估, 而如果仅仅通过测定叶绿素 a生物量又无法提供各浮游植物类群生物量的动态信息。因此, 以特征色素作为标志物结合 HPLC和CHEMTAX软件分析为研究长江口海域富营养化对浮游植物群落结构的影响特别是为研究微微型浮游植物类群丰度对富营养化的响应提供了一个新的途径。
致谢: 衷心感谢刘云、张德强、付梅、于海燕、林勇新、王志富、卢光远和吴在兴等同学在野外和实验室的测定工作, 感谢鹿琳同学在浮游植物分析上给予的帮助以及俞立东老师在色素分析工作中给予的热情帮助。
[1] Chai C, Yu Z M, Song X X, et al. The status and characteristics of eutrophication in the Yangtze River(Changjiang) estuary and the adjacent East China Sea,China [J]. Hydrobiologia, 2006, 563: 313-328.
[2] Wang B. Cultural eutrophication in the Changjiang(Yangtze River) plume: History and perspective [J].Estuarine, Coastal and Shelf Science, 2006, 69 (3-4):471-477.
[3] Zhou M J, Shen Z L, Yu R C. Responses of a coastal phytoplankton community to increased nutrient input from the Changjiang (Yangtze) River [J]. Continental Shelf Research, 2008, 28 (12): 1483-1489.
[4] Richardson T, Pinckney J, Paerl H. Responses of estuarine phytoplankton communities to nitrogen form and mixing using microcosm bioassays [J]. Estuaries and Coasts, 2001, 24 (6): 828-839.
[5] 蒲新明, 吴玉霖, 张永山. 长江口区浮游植物营养限制因子的研究 (Ⅱ.春季的营养限制情况) [J]. 海洋学报, 2001, 23 (3): 57-65.
[6] 赵卫红, 李金涛, 王江涛. 夏季长江口海域浮游植物营养限制的现场研究[J]. 海洋环境科学, 2004, 23(4):1-5.
[7] 刘媛, 曹振锐, 黄邦钦, 等. 东、黄海典型海区浮游植物对营养盐添加的响应[J]. 厦门大学学报(自然科学版), 2004, 43 (S1): 147-152.
[8] 李雁宾, 韩秀荣, 胡跃诚, 等. 营养盐对东海浮游植物生长影响的现场培养实验 [J]. 海洋环境科学,2008, 27 (2): 113-117.
[9] Simon N, Barlow R G, Marie D, et al. Characterization of oceanic photosynthetic picoeukaryotes by flow-cytometry [J]. Journal of Phycology, 1994, 30 (6):922-935.
[10] 邓春梅, 姚鹏, 刘淑霞, 等. 海洋浮游藻色素分析和化学分类研究进展 [J]. 中国海洋大学学报(自然科学版), 2010, 40 (4): 91-98, 104.
[11] Furuya K, Hayashi M, Yabushita Y, et al. Phytoplankton dynamics in the East China Sea in spring and summer as revealed by HPLC-derived pigment signatures [J]. Deep Sea Research Part II: Topical Studies in Oceanography,2003, 50 (2): 367-387.
[12] 陈纪新, 黄邦钦, 刘媛, 等. 应用特征光合色素研究东海和南海北部浮游植物的群落结构 [J]. 地球科学进展, 2006, 21(7): 738-746.
[13] Zapata M, Rodriguez F, Garrido J L. Separation of chlorophylls and carotenoids from marine phytoplankton: a new HPLC method using a reversed phase C-8 column and pyridine-containing mobile phases [J]. Marine Ecology Progress Series, 2000, 195:29-45.
[14] Mackey M D, Mackey D J, Higgins H W, et al.CHEMTAX — A program for estimating class abundances from chemical markers: Application to HPLC measurements of phytoplankton [J]. Marine Ecology Progress Series, 1996, 144 (1-3): 265-283.
[15] Mackey D J, Higgins H W, Mackey M D, et al. Algal class abundances in the western equatorial Pacific:Estimation from HPLC measurements of chloroplast pigments using CHEMTAX [J]. Deep Sea Research Part I: Oceanographic Research Papers, 1998, 45 (9):1441-1468.
[16] Redfield A C, Ketchum B H, Richards F A. The influence of organisms on the composition of seawater. In:Hill M N (eds). The Sea [M].New York: Wily Interscience, 1963, 26-79.
[17] 王保栋. 黄海和东海营养盐分布及其对浮游植物的限制 [J]. 应用生态学报, 2003, 14 (7): 1122-1126.
[18] Shen Z L. Historical Changes in Nutrient Structure and its Influences on Phytoplantkon Composition in Jiaozhou Bay [J]. Estuarine, Coastal and Shelf Science,2001, 52 (2): 211-224.
[19] Huang B Q, Hong H S. Alkaline phosphatase activity and utilization of dissolved organic phosphorus by algae in subtropical coastal waters [J]. Marine Pollution Bulletin, 1999, 39 (1-12): 205-211.
[20] Harrison P J, Hu M H, Yang Y P, et al. Phosphate limitation in estuarine and coastal waters of China [J].Journal of Experimental Marine Biology and Ecology,1990, 140 (1-2): 79-87.
[21] 蒲新明, 吴玉霖, 张永山. 长江口区浮游植物营养限制因子的研究 (Ⅰ.秋季的营养限制情况) [J]. 海洋学报, 2000, 22 (4): 60-66.
[22] Örnólfsdóttir E B, Lumsden S E, Pinckney J L. Nutrient pulsing as a regulator of phytoplankton abundance and community composition in Galveston Bay, Texas [J].Journal of Experimental Marine Biology and Ecology,2004, 303 (2): 197-220.
[23] Eppley R. Temperature and phytoplankton growth in the sea [J]. Fishery Bulletin, 1972, 70 (4): 1063-1085.
[24] Tilman D, Kiesling R, Sterner R, et al. Green,bluegreen and diatom algae: taxonomic differences in competitive ability for phosphorus, silicon and nitrogen[J]. Archiv für Hydrobiologie, 1986, 106 (4): 473-485.
[25] 彭欣, 宁修仁, 孙军, 等. 南海北部浮游植物生长对营养盐的响应 [J]. 生态学报, 2006, 26 (12): 3959-3968.
[26] Baek S H, Shimode S, Han M S, et al. Growth of dinoflagellates, Ceratium furca and Ceratium fusus in Sagami Bay, Japan: The role of nutrients [J]. Harmful Algae, 2008, 7 (6): 729-739.
[27] Cade-Menun B J, Paytan A. Nutrient temperature and light stress alter phosphorus and carbon forms in culture-grown algae [J]. Marine Chemistry, 2010, 121(1-4): 27-36.
Pigment-based assessment of the response of phytoplankton to nutrient addition at the Changjiang Estuary
LAI Jun-xiang1,2, YU Zhi-ming1, SONG Xiu-xian1, HAN Xiao-tian1, CAO Xi-hua1,YUAN Yong-quan1
(1. Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Graduate University of Chinese Academy of Sciences, Beijing 100049, China)
Mar.,29,2011
Photopigments; phytoplankton; nutrient enrichments; Changjiang Estuary
In situ nutrient enrichment experiments were conducted in May and November, 2009 in the Changjiang River Estuary and adjacent areas to investigate phytoplankton growth and composition response to nutrient addition.Phytoplankton samples from the field experiments were analyzed by RP-HPLC to determine pigments composition,and CHEMTAX was used to estimate the contribution of eight algal groups to total chlorophyll a. Results showed that the responses of phytoplankton to nutrients were closely related to the nutrient limitation status of phytoplankton at sampling. Nutrient additions to natural water not only stimulated phytoplankton growth but also potentially altered the phytoplankton community structure. Due to the fact rapid growth depleted nutrients, diatom had more sensitivity response to nutrient input than other phytoplankton groups, shifting the community composition toward higher relative abundance of diatoms during the early stage of incubation. However, with the nutrient consumed by phytoplankton, algal groups growing better under the condition with lower nutrients concentrations comprised more portion of the total community biomass (μg/ L) at the end of incubation. The results suggested that the effect of changing concentrations of nitrate and phosphate depends on the initial phytoplankton community present at the time of nutrient addition.
P76
A
1000-3096(2012)05-0042-11
2011-03-29;
2011-04-28
国家重点基础研究发展计划“973项目”(2010CB428706);国家自然科学基金创新研究团体项目(40821004); 国家863计划专题项目(2008AA09Z107)
赖俊翔(1984-), 男, 广西柳州人, 博士研究生, 主要从事海洋环境科学研究, E-mail: laijunxiang@qdio.ac.cn; 俞志明, 通信作者, 研究员, E-mail: zyu@qdio.ac.cn
(本文编辑:康亦兼)
