结直肠癌患者外周血CD4+CD25high调节性T细胞的作用
2012-10-17张勤英王毓明
张勤英,朱 凡,王毓明
(南京医科大学附属苏州医院、苏州市立医院北区肿瘤内科,江苏苏州215008)
近年来,有较强免疫抑制功能的CD4+T细胞亚群受到广泛关注。调节性T细胞 (regulatory T cell,Treg)作为一群具有免疫抑制效应的T细胞亚群,在维持机体自身耐受和抑制自身免疫疾病发生发展中具有重要作用,其中CD4+CD25highTreg等与肿瘤免疫逃逸有密切关系。本研究应用流式细胞仪测定了36例结直肠癌患者及30名健康对照者外周血中CD4+CD25highTreg及其表面功能性标志分子细胞毒T淋巴细胞相关抗原 -4(cytotoxic T lymphocyte antigen-4,CTLA-4)和叉状头/翅膀状螺旋转录因子(transcription factor forkhead box P3 protein,FoxP3),现将结果报道如下。
1 资料与方法
1.1 研究对象 选择2010年1月至2011年6月在我科住院接受治疗的结直肠癌患者36例,男性20例,女性16例;年龄46~73岁,平均年龄(56.6±10.2)岁。所有患者均经手术及术后病理确诊,近1个月未接受抗肿瘤治疗,近2个月未使用过免疫调节剂,无近期感染病史和自身免疫性疾病史。健康对照组为我院体检中心提供的年龄、性别具有可比性的30例体检健康者,男性17例,女性13例;年龄36~68岁,平均年龄(52.2 ±12.3)岁。
1.2 主要试剂 藻红蛋白(PE)结合的CD4-PE单抗和异硫氰酸荧光素(FITC)标记的CD25-FITC单抗购自美国BD公司;叶绿素蛋白复合物(PerCP)结合的CTLA-4 PerCP、藻青蛋白标记(APC)FoxP3单抗及配套染色试剂均购自美国eBioscience公司;阴性对照采用的IgG2a-FITC、IgG1-PE和IgG-PerCP购自美国BD公司。
1.3 检测方法 采集3 mL肘静脉血,EDTA抗凝,以淋巴细胞分离液获得单个核细胞,计数,调整细胞悬液浓度为 1 × 107mL-1,取样 100 μL,分别加入 10 μL CD25、10 μL CD4、5 μL CTLA-4 和 10 μL FoxP3 抗体,室温下避光10 min,加溶血素2 mL后再避光10~15 min,根据红细胞裂解状态,以1 500 r·min-1离心5 min,弃上清液,加PBS液洗涤1次,再加200~500 μL PBS液混匀,上流式细胞仪检测。对照管按同样测定条件上机检测。结果分析用FACSDIVA软件。在前向角散射光-侧向角散射光(FSC-SSC)散点图上选定淋巴细胞群,以CD4+和SSC设门,选择CD4+T细胞分析门内相关Treg细胞亚群。
1.4 统计学处理 采用SPSS 17.0进行统计分析,实验数据以±s表示,组间比较采用t检验,检验水准α=0.05。
2 结果
流式细胞仪分别检测CD4+T细胞、CD4+CD25highTreg、CD4+CD25highFoxP3 Treg 和 CD4+CTLA-4 Treg。R1为淋巴细胞散点图(图1),CD4+T细胞以R1设门,CD4+CD25highTreg以 CD4+设门,CD4+CD25highFoxP3 Treg和CD4+CTLA-4 Treg均以CD4+CD25high设门(图2)。与健康对照组比较,结直肠癌组患者外周血CD4+CD25+FoxP3 Treg显著增多(P <0.01),CD4+CD25highTreg和 CD4+CTLA-4 Treg增多(P <0.05),CD4+T细胞减少(P<0.05)。见表1。

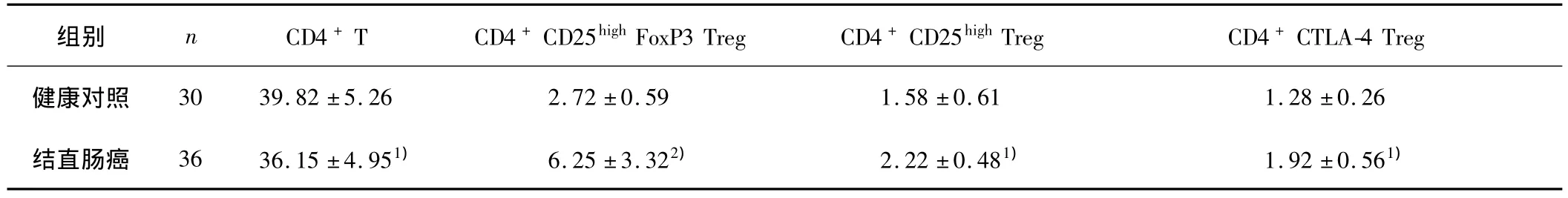
表1 各组外周血不同T细胞水平的测定结果
3 讨论
在生理状态下,机体免疫系统具有免疫监视作用,能有效防止肿瘤的发生。在肿瘤患者中免疫系统对肿瘤抗原的反应明显下降,不能有效限制、清除肿瘤细胞,这与肿瘤的形成有密切关系。目前认为这种对肿瘤抗原弱免疫应答的原因可能是肿瘤抗原为变异的自身抗原或机体免疫功能下调,即免疫稳态破坏。
Treg作为具有免疫抑制效应的T细胞亚群,能特异性抑制T细胞对外源性和自体抗原的免疫反应,因此在维持对自身成分免疫耐受的同时,也可能阻止机体对自体同源肿瘤细胞的免疫。CD4+CD25+Treg为具有独立功能的T细胞亚群,在免疫抑制机制和维持自身免疫耐受过程中具有十分重要的作用,在一些肿瘤的研究中,已证明了CD4+CD25+Treg可以抑制体内抗肿瘤反应[1]。
CD4+CD25+Treg占CD4+T细胞的5% ~10%,具有免疫调节活性的细胞主要是高表达CD25+的细胞,即CD4+CD25highTreg。结直肠癌患者Treg介导的免疫耐受和肿瘤的生长密切相关,Treg可能直接参与肿瘤的发生过程,也可以提示恶性肿瘤的预后。本研究结果显示,36例结直肠癌患者外周血CD4+CD25highTreg增加,提示结直肠癌患者免疫功能失调与其外周血Treg比例增加有关,在结直肠癌发展过程中CD4+CD25highTreg可能起着重要的作用。
肿瘤局部Treg数量升高的原因主要为:1)肿瘤抗原和趋化因子作用使得天然CD4+CD25highTreg在肿瘤局部募集和扩增,LAGE1和ARTC1等肿瘤抗原刺激其活化增殖,导致肿瘤部位肿瘤抗原特异性CD4+CD25highTreg比例增加;2)TCR刺激和TGF-β联合作用诱导FoxP3在CD4+CD25highT细胞中的表达,导致其转变成具有调节活性的CD4+CD25highTreg[2]。
CTLA-4是一种抑制性调节分子,其编码基因位于人类2号染色体q33区,表达受到严密调控。除静止T细胞外,已活化的T细胞、Treg的一些亚群和Th细胞中均存在CTLA-4。CTIA-4与CD28竞争性结合配体,在T细胞的活化反应中发挥着负性调节作用。CTLA-4和B7的结合导致细胞活化和增殖信号的下调,IL-2的合成也被抑制。CTLA-4能与 CD80和CD86结合,向T细胞发出抑制信号,使活化T细胞的子代细胞对抗原刺激的敏感性降低,从而发挥负性调节作用。
最近有研究发现,一类具有免疫抑制效应的FoxP3+Treg在肿瘤局部募集、扩增,通过细胞与细胞间接触的方式和分泌调节性细胞因子IL-10、TGF-β等的方式抑制CD4+和CD8+T细胞的分化和增殖,从而抑制 T细胞抗肿瘤免疫效应,促进肿瘤生长[3]。FoxP3并非细胞活化的标记,而是Treg内的标记分子,该蛋白的表达对CD4+CD25+Treg的发育成熟、功能发挥等方面均具有重要作用,也是目前CD4+CD25+Treg最敏感的标记,其作为特异性表达于 CD4+CD25+Treg表面的一种转录因子,有别于CD25、CTLA-4等,逐渐成为目前公认的CD4+CD25+Treg特异性的标记[4-5]。FoxP3 不但限制了特异性表达的CD4+CD25highTreg,而且对这些细胞调节功能的诱导起关键作用。将FoxP3基因导入CD4+CD25+Treg,这些细胞受刺激时就表现出与自然产生的CD4+CD25+Treg的无能或抑制表型,也能在体外抑制T细胞的免疫应答。因此,FoxP3在CD4+CD25+Treg的发育和功能发挥上是必需的。通过检测CD4+CD25highTreg百分数及其功能性标志分子FoxP3和CTLA-4可以较全面地反映CD4+CD25highTreg的数量和功能状况。
近年来,结直肠癌免疫治疗有了很大的发展,主要方法除了传统的非特异性主动免疫治疗外,还有特异性主动免疫治疗、免疫基因治疗、被动性免疫反应、靶向治疗等[6]。如表皮生长因子受体(epithelial growth factor receptor,EGFR)的表达在结直肠癌组织中明显高于正常结直肠黏膜及良性病变组织;随不典型增生的加重,EGFR表达增加。如果对于EGFR依赖性或部分依赖性的结直肠癌患者选择以EGFR为靶点的抗肿瘤治疗,患者的生存质量会大大提高[7]。本研究发现,结直肠癌患者外周血中CD4+CD25highFoxP3 Treg增高,这表明CD4+CD25highFoxP3 Treg的变化较CD4+CD25highTreg及 CD4+CTLA-4 Treg更为敏感。检测CD4+CD25highFoxP3 Treg可进一步了解结直肠癌患者体内免疫状态和疾病活动性,这些发现为肿瘤的靶向免疫治疗提供了依据。免疫调节药物的出现代表了肠道恶性肿瘤及其他恶性肿瘤免疫治疗的方向。某些药物,如自体肿瘤细胞疫苗、重组CEA疫苗等已进入临床研究。然而,本研究病例数较少,不能排除抽样误差,尚需扩大样本量进一步研究。
[1]许浪,王育斌,刘丹,等.CD4+CD25+调节性T细胞及其相关基因FoxP3在非小细胞肺癌患者外周血中的变化[J].中国医药导报,2009,6(7):23-25.
[2]张利宁.调节性T细胞与肿瘤[J].中国肿瘤生物治疗杂志,2007,14(3):201-205.
[3]陶学芳,李和权,周建英,等.FoxP3、CD3在非小细胞肺癌组织中的表达及意义[J].浙江医学,2010,32(1):46 -48,51.
[4]Sakaguchi S.Naturally arising FoxP3-expressing CD25+CD4+regulatory T cells in immunological tolerance to self and non-self[J].Nat Immunol,2005,6(4):345-352.
[5]Williams LM,Rudensky AY.Maintenance of the FoxP3-dependent developmental program in mature regulatory T cells requires continued expression of FoxP3[J].Nat Immunol,2007,8(3):277 - 284.
[6]李天煜,陈利生.结直肠癌的免疫逃逸与免疫治疗进展[J].结直肠肛门外科,2008,14(4):288 -291.
[7]刘伟东,赵巧艳,毋永娟.EGFR在结直肠癌组织中表达的意义[J].肿瘤基础与临床,2010,23(6):275 -276.
