AQP-1在肾透明细胞癌组织中的表达及临床意义
2012-10-17李世朋王朏朏丁雪贞李文雅席守民
李世朋,王朏朏,丁雪贞,李文雅,于 乐,宋 莹,席守民,2
(1.河南科技大学医学院,河南 洛阳471003;2.河南科技大学药理学与医学分子生物学重点实验室,河南洛阳471003)
肾透明细胞癌是我国常见的恶性肿瘤之一,其癌细胞通过直接蔓延、淋巴转移、血行转移及种植转移等多种方式在体内播散,从而影响疾病的预后。水通道蛋白-1(aquaporin-1,AQP-1)是对水专一的通道蛋白,其所介导的自由水快速被动地跨生物膜转运是水进出细胞的主要途径。现已明确AQP-1是肾脏重吸收水、浓缩尿液,从而维持机体水平衡的主要分子基础。研究表明,AQP-1在多种肿瘤组织、微血管内皮细胞中高表达,其与恶性肿瘤的发生、发展有着密切的关系[1]。作者采用免疫组化法检测人肾透明细胞癌组织中AQP-1的表达,旨在探讨AQP-1与肾肿瘤的生成、发展及转移的关系。
1 材料与方法
1.1 标本来源 选择河南科技大学第一附属医院2006年2月至2011年7月接受肾透明细胞癌手术治疗患者术后存档的石蜡标本25例,其中男性16例,女性9例;年龄36~73岁。所有患者均经常规病理诊断确诊,术前均未接受化疗、放疗或免疫治疗。随机选取20例正常肾脏组织存档石蜡标本作为对照组,其中男性13例,女性7例;年龄34~68岁。所有病例均有完整的临床资料。
1.2 主要试剂 AQP-1兔抗人多克隆抗体(稀释浓度1∶200)购自武汉博士德生物工程有限公司 ;DAB显色试剂盒购自北京鼎国昌盛生物技术有限公司;免疫组化试剂盒(美国ZYMED公司产品)购自北京博奥森生物技术有限公司。其他试剂均为分析纯。
1.3 方法 每例蜡块4 μm厚连续切片5张,其中1张进行HE染色,另4张进行免疫组化染色。采用免疫组化S-P二步法。石蜡切片常规脱蜡至水化,蒸馏水冲洗,0.01 mol·L-1枸橼酸缓冲液微波抗原修复15 min后自然冷却至室温,体积分数3%H2O2室温孵育10 min,以消除内源性过氧化物酶活性。PBS冲洗2 min×3次;加封闭血清,滴加一抗,4℃过夜,PBS冲洗2 min×3次;滴加生物素标记二抗,37℃孵育30 min;PBS冲洗5 min×3次;DAB显色,显微镜下控制,自来水冲洗终止反应。苏木素复染2 min,盐酸乙醇分化,自来水冲洗,梯度酒精脱水,二甲苯透明,中性树胶封片。以PBS代替一抗作为阴性对照。
1.4 结果判定 选用试剂盒中的阳性片作为阳性对照,PBS取代一抗作为阴性对照。AQP-1可以表达于细胞膜和(或)细胞质,染色呈棕黄色视为阳性。每张切片随机选择5个高倍视野,每个高倍镜视野计数100个细胞,采用半定量积分法依据染色强度和阳性细胞百分率判断染色结果。按染色强度评分,无着色:0分,浅黄色:1分,棕黄色:2分,棕褐色:3分;按阳性细胞百分率评分,无阳性细胞:0分,<25%:1分,25%~50%:2分,50% ~75%:3分,>75%:4分。2项评分之和:0分(-),1~2分(+),3~4分(++),5~7分(+++)。结果判定采用双盲法,由2名有经验的临床病理医生确定。
1.5 统计学处理 采用SPSS 13.0进行数据分析,各组间率的比较采用χ2检验,检验水准α=0.05。
2 结果
AQP-1染色主要存在于细胞膜,细胞浆亦有部分染色。在正常肾组织近曲小管上皮细胞的细胞膜和细胞质中可见大量棕黄色染色,在毛细血管内皮细胞的细胞膜上可见少量棕黄色染色,在肾透明细胞癌的癌细胞中仅见少量的细胞膜着色,而毛细血管内皮细胞中可见细胞膜和细胞质着色。与正常肾组织相比,肾透明细胞癌组织中AQP-1阳性表达明显减少,差异有统计学意义(P<0.05);而在肾透明细胞癌组织中毛细血管增生,毛细血管内皮AQP-1阳性表达明显较正常肾脏组织增多,差异有统计学意义(P<0.05)。见图 1,表 1、2。

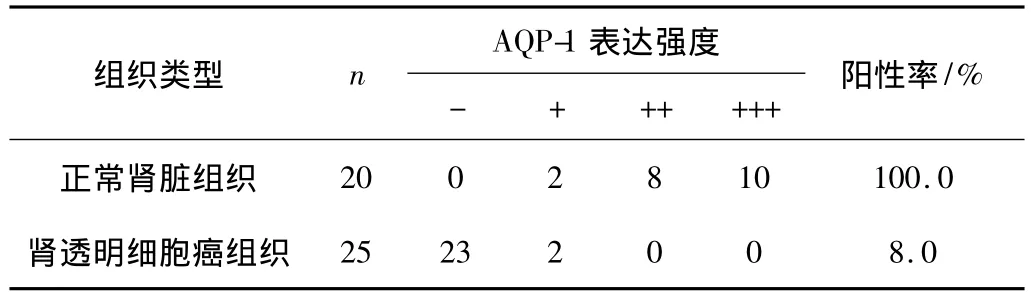
表1 AQP-1在不同肾脏组织肾小管中的表达
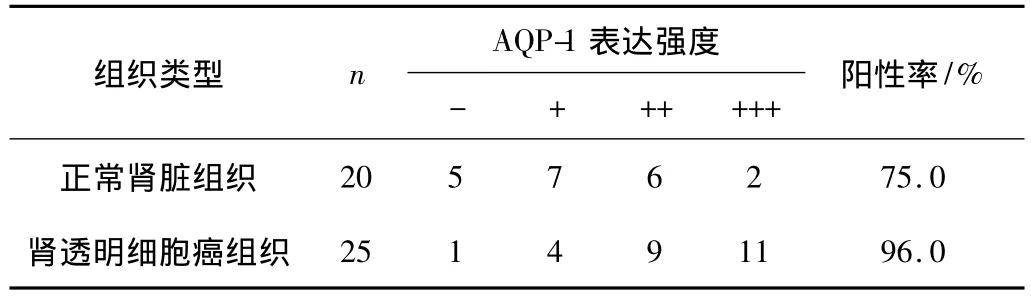
表2 AQP-1在不同肾组织毛细血管中的表达
3 讨论
在肾脏组织中,AQP-1在近曲小管、髓袢降支段的内皮细胞都有表达,AQP-1参与了尿液的浓缩并在逆流交换机制上起着重要作用。AQP-1分布广泛,不仅存在于分泌及吸收型上皮细胞中,而在毛细血管及小血管内皮细胞中也很丰富[2]。存在于淋巴管、毛细血管和小静脉内皮中的AQP-1,对于水分迅速进入淋巴管和血管床,调控细胞间渗透压和血管内的流体静压与胶体渗透压起着平衡的作用。
肿瘤的生长和转移依赖于血管的生成,为了保持肿瘤细胞无限制的侵袭性生长,肿瘤组织必须依赖持续的、广泛的新生血管形成。目前研究证明,AQP-1在血管新生和肿瘤细胞迁移中发挥着重要的作用[3-6]。在肿瘤的发生和发展过程中,肿瘤细胞增殖快,新陈代谢异常活跃,对水的需求也增加,因此水通道蛋白对肿瘤细胞的生存非常重要。AQP-1可在多种肿瘤组织、细胞系及肿瘤微血管内皮细胞中高度表达,Mobasheri等[7]认为AQP-1在疾病状态下改变了新生血管的形成,由此促进了肿瘤组织血管的异常表现,而肿瘤组织血管的生成在其生长、侵袭和转移的过程中起重要作用。
本文应用免疫组化法对AQP-1在肾透明细胞癌组织和正常肾脏组织中的表达进行了检测,结果表明,AQP-1在正常肾脏近曲小管上皮细胞呈阳性表达,而在肾透明细胞癌组织中近曲小管遭到破坏,AQP-1表达明显减少。AQP-1在两种组织中的表达,差异有统计学意义(P<0.05)。但肾透明细胞癌组织中毛细血管增生,且毛细血管内皮细胞AQP-1表达增多且呈强阳性,同正常肾脏组织的表达相比,差异有统计学意义(P<0.05)。推测AQP-1参与了肿瘤血管内皮细胞膜水和离子转运的调控,促进了血管内皮细胞的增殖和迁移,参与了肾透明细胞癌浸润与转移。AQP-1参与了肾透明细胞癌的发生、发展、肿瘤血管生成和转移,并在此过程中起促进作用。
目前对于AQP-1参与肿瘤发生、发展与转移的研究已有报道,但对AQP-1在肾透明细胞癌中的研究少见,还有许多问题尚未阐明,需进一步的深入研究。
[1]Saadoun S,Papadopoulos MC,Hara-Chikuma M,et al.Impairment of angiogenesis and cell migration by targeted aquaporin-1 gene disruption[J].Nature,2005,434(7034):786 -792.
[2]Jung JS,Preston GM,Smith BL,et al.Molecular structure of the water channel through aquaporin CHIP.The hourglass mode[J].J Biol Chem,1994,269(20):14648-14654.
[3]Verkman AS.Aquaporin water channels and endothelial cell function[J].J Anat,2002,200(3):617 - 627.
[4]Hu J,Verkman AS.Increased migration and metastatic potential of tumor cells expressing aquaporin water channels[J].FASEB J,2006,10(5):1228 -1236.
[5]Saadoun S,Papadopoulos MC,Davies DC,et al.Increased aquaporin 1 water channel expression in human brain tumours[J].Br J Cancer,2002,87(6):621 -623.
[6]Vacca A,Ribatti D,Roccaro AM,et al.Bone marrow angiogenesis in patients with active multiple myeloma[J].Semin Oncol,2001,28(6):543-550.
[7]Mobasheri A,Airley R,Hewitt SM,et al.Heterogeneous expression of the aquaporinl(AQP-1)water channel in tumors of the prostate,breast,ovary,colon and lung:a study using high density multiplehuman tumor tissue mieroarrays[J].Int J Oncol,2005,26(5):1149-1158.
