产前应用倍他米松或地塞米松对早产儿神经发育的影响研究
2012-10-17黄柏枝麦润婵
黄柏枝 麦润婵
广东省东莞市太平人民医院儿科,广东东莞 523905
早产是指妊娠满28周至不满37足周之间分娩者。此时娩出的新生儿称早产儿,出生体重多<2 500 g,各器官发育不成熟。据统计,围生儿死亡中与早产有关者占75%,因此防止早产是降低围生儿死亡率的重要环节之一[1]。随着围生医学的迅猛发展,早产儿发生率及存活率明显提高,但是神经系统后遗症的发生率并没有下降,我国是一个人口大国,抢救存活的早产儿将来能不能发展成为健康聪明的孩子,是每一个家长和医务人员极其关心的问题,所以我们迫切需要从智力低下发生率最高的早产儿进行预防性干预。本文笔者对我院2008年1月~2011年1月按照母亲产前是否应用倍他米松或地塞米松治疗的情况,对收治的28~34周的早产儿200例进行研究,观察产前应用倍他米松或地塞米松治疗对早产儿神经发育的影响,现报道如下:
1 资料与方法
1.1 一般资料
本组资料根据我院2008年1月~2011年1月收治的胎龄为28~34周早产儿200例,其中,男132例,女68例;单胎181 例,双胎 19 例;Apgar评分为(7.1±0.6)分;分娩方式:顺产152例,剖宫产48例。排除标准:染色体异常,产前类固醇接触之前,使用类固醇因其他原因。统计分析是按照意向-治疗的原则。按照母亲产前是否应用倍他米松或地塞米松治疗的情况分为两组,对照组100例未用倍他米松或地塞米松治疗;观察组给予倍他米松或地塞米松治疗1~2个疗程,两组早产儿出生后均给予对症支持治疗。两组早产儿性别、父母受教育程度、家庭月经济收入情况的比较差异无统计学意义(P > 0.05),具有可比性。 见表1。

表1 两组一般资料比较(例)
1.2 方法
根据美国国立卫生研究院即N1H1 1994年正式推荐对于24~34周且7 d内有早产风险的孕妇使用倍他米松12 mg肌内注射,每天1次,连用2 d,7 d内不重复用药或者地塞米松10 mg,肌内注射,每天1次,3 d为1个疗程。若早产风险持续存在,2次给药时间应在首次给药2周后,且总给药次数不超过2次[2]。孕周由产科病史和超声检查共同确定。
1.3 观察指标
①两组孕妇、父母教育程度、家庭收入资料比较。②两组早产儿胎龄、出生体质量、身长、头围、胸围的比较。③两组早产儿窒息、缺氧缺血性脑病(HIE)、颅内出血的发生率。④两组早产儿出生后第1天及第5天的神经行为发育,采用Brazelton评分标准[3]。并对早产儿出生后3、6、12个月的智力发育指数(MDI)和运动发育指数(PDI)量表进行检测。
1.4 统计学方法
采用SPSS 17.0软件进行统计频数分析,计数资料以率表示,采用 χ2检验,计量资料以均数±标准差(±s)表示,两独立样本的计量资料采用t检验;重复测量的计量资料采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组胎龄及体质情况比较
观察组早产儿胎龄平均(34.73±2.01)周,对照组为(34.59±1.98)周,两组比较差异无统计学意义(P>0.05);观察组早产儿体质(包括出生体质量、身长、头围、胸围等指标)与对照组比较差异无统计学意义(P>0.05),结果说明产前孕妇应用倍他米松或地塞米松治疗对早产儿的胎龄、体质等指标无影响。见表2。
表2 两组胎龄及体质情况比较(±s)
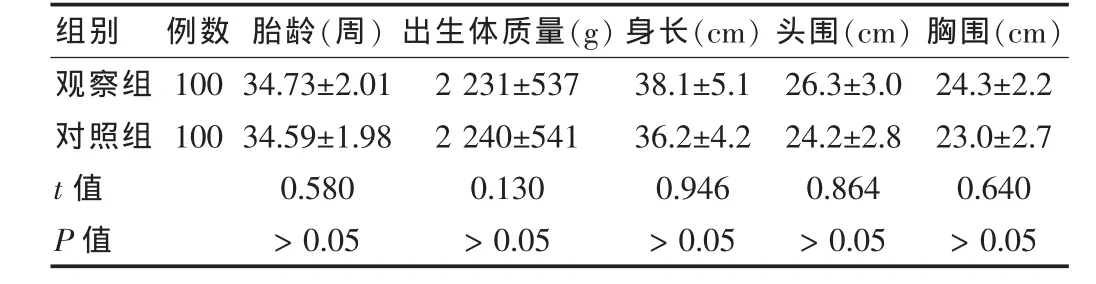
表2 两组胎龄及体质情况比较(±s)
组别 例数 胎龄(周)出生体质量(g)身长(cm)头围(cm)胸围(cm)观察组对照组t值P值100 100 34.73±2.01 34.59±1.98 0.580>0.05 2 231±537 2 240±541 0.130>0.05 38.1±5.1 36.2±4.2 0.946>0.05 26.3±3.0 24.2±2.8 0.864>0.05 24.3±2.2 23.0±2.7 0.640>0.05
2.2 两组并发症发生情况比较
观察组早产儿窒息、HIE和颅内出血的发生率与对照组比较,差异无统计学意义(P>0.05)。该研究结果与国外相关文献研究结果有差异,可能与本研究统计例数少有关。见表3。
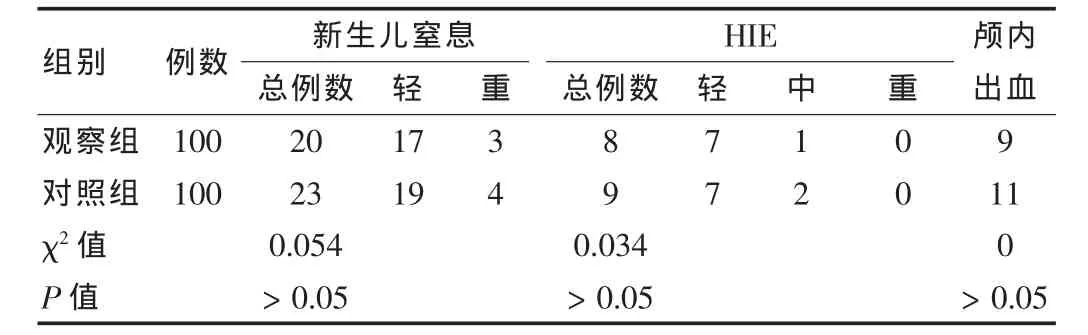
表3 两组并发症发生情况比较(例)
2.3 两组神经、智力、运动发育情况比较
观察组第1天的Brazelton评分与对照组比较差异无统计学意义(P>0.05);第5天的Brazelton评分,观察组明显高于对照组,差异有统计学意义(P<0.05),见表4。两组早产儿中观察组3、6、12个月智力发育指数和运动发育指数明显高于对照组,差异有统计学意义(P<0.05),见表5。结果说明产前应用倍他米松或地塞米松治疗能够促进早产儿神经发育,改善脑功能。
3 讨论
早产儿是智力低下脑瘫发生率较高因素之一。早产儿因过早脱离母体,神经系统的成熟受到阻碍,各脏器的成熟度较差,环境适应能力薄弱,容易发生各种并发症。如何提高早产儿的智力发育水平,有效地加速其发育速度,是一个亟待解决的问题,而家庭早期干预能起到事半功倍的效果。由于近年脑科学发展,为早期干预提供了理论依据,人出生时已经拥有大多数神经元,但神经元很幼小,在6个月时明显发育起来,神经元之间突触在6个月时增加7.2倍,1岁时增加20倍。神经元之间的回路在生后迅速建立,形成复杂的信息网络联系[4]。脑重在生后6个月增加1倍,两岁增加2倍。科学证明,婴幼儿早期是脑生长发育最快的时期,有极大的可塑能力。早产儿由于种种原因造成脑损伤,通过丰富的环境刺激和合理有计划的训练,完全有可能使受伤的大脑获得最佳的代偿能力[5]。
表4 两组Brazelton评分比较(±s,分)
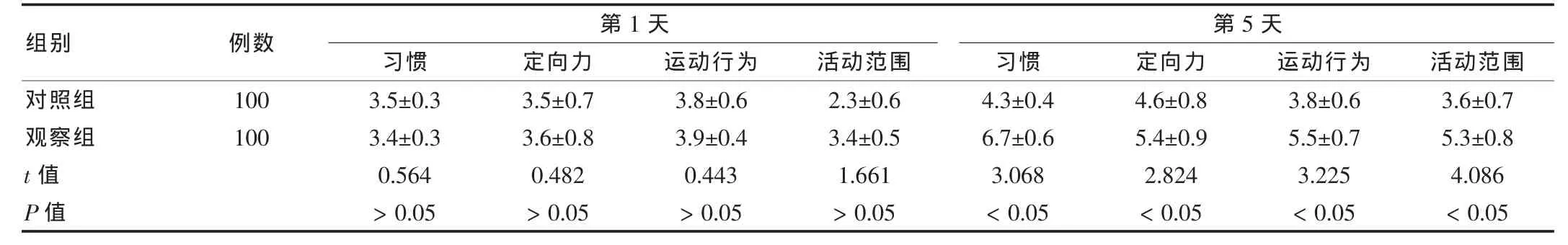
表4 两组Brazelton评分比较(±s,分)
组别 例数 第1天习惯 定向力 运动行为 活动范围第5天习惯 定向力 运动行为 活动范围对照组观察组t值 P值100 100 3.5±0.3 3.4±0.3 0.564>0.05 3.5±0.7 3.6±0.8 0.482>0.05 3.8±0.6 3.9±0.4 0.443>0.05 2.3±0.6 3.4±0.5 1.661>0.05 4.3±0.4 6.7±0.6 3.068<0.05 4.6±0.8 5.4±0.9 2.824<0.05 3.8±0.6 5.5±0.7 3.225<0.05 3.6±0.7 5.3±0.8 4.086<0.05
表5 两组不同时期智力发育指数和运动发育指数比较(±s)

表5 两组不同时期智力发育指数和运动发育指数比较(±s)
组别 例数 3个月MDI PDI 6个月MDI PDI 12个月MDI PDI观察组对照组t值P值100 100 110.54±10.05 106.79±9.95 6.25<0.05 112.42±11.55 104.31±6.42 3.75<0.05 109.19±10.69 103.46±12.53 4.26<0.05 106.59±14.69 95.54±11.56 9.33<0.05 103.80±7.69 99.80±5.96 5.05<0.05 110.06±7.84 100.17±10.33 7.92<0.05
糖皮质激素用于产前促胎儿肺成熟已有30多年的历史,使用倍他米松可有效促进早产儿肺脏发育,并减少早产儿出生后发生严重肺病的危险和患病率。但已知在早产儿出生后使用糖皮质激素会导致诸如脑瘫或心脏壁肥大等严重问题[6]。因此,对存在早产风险的孕妇,产前合理应用糖皮质激素十分重要。本文笔者2008年1月~2011年1月按照母亲产前是否应用倍他米松或地塞米松治疗的情况,对收治的28~34周的早产儿200例进行研究,观察产前应用倍他米松或地塞米松治疗对早产儿神经发育的影响,结果显示观察组早产儿胎龄平均为(34.73±2.01)周,对照组为(34.59±1.98)周,两组比较差异无统计学意义(P>0.05);观察组早产儿体质包括出生体质量、身长、头围、胸围等指标与对照组比较差异无统计学意义(P>0.05);观察组早产儿窒息、HIE和颅内出血的发生率与对照组比较,差异无统计学意义(P>0.05);观察组第1天的Brazelton评分与对照组比较差异无统计学意义(P>0.05);第5天的Brazelton评分,观察组明显高于对照组,差异有统计学意义(P<0.05);两组早产儿中观察组3、6、12个月智力发育指数和运动发育指数明显高于对照组,差异有统计学意义(P<0.05)。说明产前应用倍他米松或地塞米松治疗能够促进早产儿神经发育,改善脑功能。但是也有相关报道称,产前多疗程应用糖皮质激素,将导致儿童认知发育落后和远期的精神运动发育延迟,脑重量减轻,神经元成熟和髓鞘形成延迟,并导致剂量依赖的海马神经元变性,海马体积下降,下丘脑-垂体-肾上腺轴的负反馈敏感性降低,导致成年期血浆皮质醇水平持续升高[7-8],所以产前使用倍他米松或地塞米松治疗,应严格控制糖皮质激素使用量及疗程,避免出现相关不良反应。
[1]Mwansa KJ,Cousens S,Hansen T,et al.Antenatal steroids in preterm labour for the prevention of neonatal deaths due to complications of preterm birth[J].Int J Epidemiol,2010,39(Suppl 1):122-133.
[2]Vinukonda G,Dummula K,Malik S,et al.Effect of prenatal glucocorticoids on cerebral vasculature of the developing brain [J].Stroke,2010,41(8):1766-1773.
[3]Drake AJ,Raubenheimer PJ,Kerrigan D,et al.Prenatal dexamethasone programs expression of genes in liver and adipose tissue and increased hepatic lipid accumulation but not obesity on a high-fat diet[J].Endocrinology,2010,151(4):1581-1587.
[4]Dunn E,Kapoor A,Leen J,et al.Prenatal synthetic glucocorticoid exposure alters hypothalamic-pituitary-adrenal regulation and pregnancy outcomes in mature female guinea pigs[J].J Physiol,2010,588(Pt 5):887-899.
[5]Malaeb SN,Hovanesian V,Sarasin MD,et al.Effects of maternal antenatal glucocorticoid treatment on apoptosis in the ovine fetal cerebral cortex[J].J Neurosci Res,2009,87(1):179-189.
[6]郭艳,李红英,陈筱青,等.产前孕鼠应用地塞米松与倍他米松对早产仔鼠脑发育的影响[J].实用儿科临床杂志,2009,24(14):1061-1063.
[7]陈丽娟,程秀永,段国芳.产前地塞米松单疗程与多疗程对早产儿出生指标影响的比较[J].实用医药杂志,2009,26(5):10-11.
[8]Liu L,Zheng CX,Peng SF,et al.Evaluation of urinary S100B protein level and lactate/creatinine ratio for early diagnosis and prognostic prediction of neonatal hypoxic-ischemic encephalopathy [J].Neonatology,2010,97(1):41-44.
